氧电极法测定发芽苦荞中过氧化氢酶活性的研究
2015-12-01陈晓嫚余倩虹郭元新
陈晓嫚,余倩虹,郭元新
(安徽科技学院 食品药品学院,安徽 凤阳 233100)
苦荞(Fagopyrum Tataricum)是中国传统的杂粮作物,富含其它粮食作物中几乎没有的芦丁及硒元素,是一种粮药兼用的蓼科荞麦属双子叶作物。研究表明,苦荞发芽后蛋白酶抑制剂含量及植酸含量降低,营养成分更加合理。控制发芽条件,还能富集γ-氨基丁酸(γ-amino butyric acid,GABA)等功能性成分[1]。
在低氧、盐胁迫、冷激等逆境条件下植物中GABA含量急剧升高,这是植物在逆境下发生的一种生物抗逆性反应。逆境下发芽苦荞中各种内源酶开始动员,其中过氧化氢酶是一种重要的酶类。过氧化氢酶又称触酶(Catalase,CAT),是一类广泛存在于动、植物和微生物体内的末端氧化酶。在植物体内,适量的过氧化氢能够使植物细胞免受氧化胁迫,但是过氧化氢的含量过高会导致植物体受到损伤。另一方面,过氧化氢可能是启动衰老或细胞凋亡的重要因子,甚至是决定因子[2]。CAT能够很好地控制植物中过氧化氢的含量,从而延缓植物体内的细胞衰老甚至凋亡。监测发芽苦荞等植物中的过氧化氢酶活性的变化,具有重要的意义。目前测定其酶活常用方法有高锰酸钾滴定法、碘量法、紫外分光光度法。高锰酸钾滴定法[3]是由国家标准局1985年发布,1986年实施的一种较权威的方法,在实际运用中该方法虽然精确,但工作量大且操作繁琐。陈晓敏[4]利用碘量法对切花CAT活性进行研究,认为碘量法存在着误差大、重复性差的的缺点。杨亚平[5]等人利用紫外分光光度法测定水稻种子内CAT活性,认为该方法虽重现性好、检测线相对较低,但在测定底物或产物改变量方面不太准确。
氧电极具有灵敏度高、测量时间短、追踪氧含量变化准确、自动化控制等特点,目前主要运用于测定植物的光合作用和呼吸作用,用于测定发芽植物中过氧化氢酶的活性还未见报道。本文采用丙酮法提取过氧化氢酶,并使用硫酸铵分级沉淀的方法对过氧化氢酶进行分级纯化,利用Clark氧电极法探究分级纯化后的过氧化氢酶的最适温度、pH、底物浓度对酶活性的影响,建立了氧电极法测定发芽苦荞中过氧化氢酶活的快速简便方法。
1 材料与方法
1.1 材料
磷酸、冰丙酮、过氧化氢、硫酸铵、次氯酸钠、磷酸二氢钠、磷酸氢二钠,均为分析纯。试验所需的苦荞产自内蒙古自治区乌兰察布市,采购后存储于-20℃的冰柜中备用。
1.2 主要仪器
氧电极仪(英国Hansatech公司)、低温循环水浴锅(金坛市天竟实验仪器厂)、恒温培养箱(北京福意电器有限公司)、HH数显恒温水浴锅(金坛市金成国胜试验仪器厂)、KDC-160HR高速冷冻离心机、电动匀浆机、FA2004分析天平(上海精密科学仪器有限公司)等。
1.3 试验预处理
1.3.1 苦荞的发芽 将苦荞种子用去离子水多次清洗,随后用1%次氯酸钠溶液浸泡15min。用去离子水将苦荞种子洗至中性后加去离子水在33℃恒温水浴锅中浸泡5h后置于铺有两层滤纸的培养皿中,样品放置于25℃的恒温培养箱中培养,每隔8h浇少量的去离子水,保证培养皿湿润,培养至苦荞芽长约4~6cm即可避光保存备用。
1.3.2 酶液的制备 参照吴红梅[6]的方法,取发芽苦荞100g,加入约-20℃的冰丙酮200mL,用高速组织捣碎机匀浆5min,4层纱布过滤,混合液用真空抽滤泵抽滤,残渣反复用丙酮冲洗,抽滤,直至呈白色粉末,即为丙酮粉。称取2g丙酮粉,加入40mL 0.1mol/L的磷酸缓冲溶液(pH=7.2),0℃下在磁力搅拌器中匀浆30min,并在0~4℃高速冷冻离心机设置转速2000rpm下离心30min,上清液即为CAT粗酶液。
1.3.3 (NH4)2SO4分级沉淀纯化[7]在CAT粗酶液中缓慢加入固体硫酸铵粉末至硫酸铵饱和度达20%,继续搅拌20min后,在离心机中以2000rpm离心15min,所得沉淀用0.1mol/L磷酸缓冲溶液(pH=7.2)溶解备用。上清液继续边搅拌边加固体硫酸铵至30%的饱和度 ,然后搅拌溶液20min,在离心机中以2000rpm的转速离心15min,所得沉淀再用0.1mol/L磷酸缓冲溶液溶解备用,按着上述步骤,分别加至40%、50%的饱和度,搅拌、离心,所得沉淀分别溶于0.1mol/L磷酸缓冲溶液中,在-20℃下冷藏备用。
1.4 试验测定方法及试验设计
1.4.1 CAT活性的测定原理 CAT完整的催化机制还没有完全被了解,但其催化过程普遍被认为分为两步:
其中,“Fe(Ⅲ)-E”表示为结合在过氧化氢酶上的血红素基团(E)的中心铁原子(Fe)。Fe(IV)-E(.+)为Fe(V)-E的一种共振形式,即铁原子并没有完全氧化到+V价,反而从血红素上接受了一些“支持电子”。从而使反应式中的血红素成为自由基阳离子(+)。
过氧化氢进入活性位点的同时并与过氧化氢酶147位上的天冬酰胺残基(Asn147)和74位上的组氨酸残基(His74)相互作用,使得原子间互相传递一个质子,自由的氧原子配位结合,生成水分子和Fe(IV)=O。Fe(IV)=O再与下一个过氧化氢分子反应重新形成Fe(III)-E,并生成水分子和氧气。活性中心铁原子的反应活性可能会因为357位上酪氨酸残基(Tyr357)的苯酚基侧链的存在(帮助Fe(III)氧化为Fe(IV))而得以提高。反应的效率可能是通过His74和Asn147与反应中间体作用而得以提高[8]。
1.4.2 CAT活性的测定方法 使用主要成份为氧化铝的电极清洁剂(Hansatech Instruments)擦拭银极,直至表面无氧化层电极光亮,并用蒸馏水清洗残余的电极清洁剂,棉棒擦拭干。按操作规程安装、校正氧电极系统,通过敏感性测试后即可进行样品测试。将底物溶液在与测试温度相同的水浴锅中保温5min,循环水浴锅设置适合的温度,用一次性滴管吸取1.5ml过氧化氢磷酸缓冲溶液(pH=7.2)于反应室中,加入磁力转子,塞上电极塞,搅拌10min。当温度稳定后,用微量注射器吸取10ul过氧化氢酶溶液从电极塞的小孔中注入,即可得到耗氧或放氧曲线,选取从加入酶后60s内一段斜率比较稳定的记录结果计算,得放氧曲线线性方程,斜率即为单位时间内释放的氧气含量,定义酶活性的单位为mmol/L·s。
1.4.3 (NH4)2SO4饱和度对CAT活性影响的测定 按1.4.2的操作要求,在温度为30℃下,先往反应室中加入0.75mol/L过氧化氢磷酸缓冲溶液(pH=7.2)搅拌后,插上电极,分别加入(NH4)2SO4饱和度为20%、30%、40%、50%的10ul过氧化氢酶提取液进行5次测试,标记60s内斜率比较稳定的记录结果并保存记录。
1.4.4 不同温度对CAT活性影响的测定 0.75mol/L过氧化氢磷酸缓冲溶液(pH=7.2)在分别24℃、28℃、32℃、36℃、40℃的水浴锅中预热5min,按照1.4.2的操作要求,依次加入反应室中,并用低温循环水浴锅调节对应的温度,进行搅拌后,插上电极,用微量注射器加入10ul过氧化氢酶溶液进行5次测定,标记60s内斜率比较稳定的记录结果并保存记录。
1.4.5 不同pH对CAT活性影响的测定 用0.1mol/L磷酸二氢钠和0.1mol/L磷酸氢二钠按比例配成pH 为 6.4、6.8、7.2、7.6、8.0 的磷酸缓冲溶液,并加入 30%过氧化氢,使其溶液浓度为 0.75mol/L,在30℃的水浴锅预热5min,测定不同pH下CAT活性。
1.4.6 不同底物浓度对CAT活性影响的测定 将30%过氧化氢与0.1mol/L磷酸缓冲溶液(pH=7.2)配成底物为0.15mol/L、0.30mol/L、0.45mol/L、0.6mol/L、0.75mol/L 的过氧化氢磷酸缓冲溶液,在30℃的水浴锅预热5min,测定各底物浓度下CAT活性。
2 结果与分析
2.1 (NH4)2SO4饱和度对CAT活性的影响

表1 (NH4)2SO4饱和度对CAT活性的影响Table 1 The effects of ammonium sulfate saturation on CAT activity
图1为不同(NH4)2SO4饱和度下氧电极测定反应室中含氧量的变化。将图1数据进行线性回归,可计算得到线性方程,其斜率即为酶活性,见表1。由于(NH4)2SO4饱和程度的不同,反应释放的氧气量不同。随着(NH4)2SO4饱和度的增加,释放出氧气的速率降低,即过氧化氢酶活性降低。(NH4)2SO4饱和度为20%时,其酶活性最高,比其它浓度高出2~6倍。同时相比于粗酶液,20%(NH4)2SO4饱和溶液的酶活性高出近2倍,因此20%(NH4)2SO4饱和度为过氧化氢酶进行(NH4)2SO4分级沉淀的最佳浓度。
2.2 反应温度对CAT活性的影响

表2 反应温度对CAT活性的影响Table 2 The effects of temperature on CAT activity
图2为不同温度下氧电极测定反应室中含氧量的变化。将图2数据进行线性回归,可计算得到线性方程及酶活性,见表2。当温度达到30℃时,释放氧气的速率最大,即为酶活性最高,20℃ ~30℃随着温度的增加,酶活性增加,但在20℃ ~25℃之间的酶活性相对较低,不利于催化反应的进行,在30℃ ~40℃温度范围内的酶活性相对于在20℃ ~25℃温度范围内的酶活性较高,说明随着温度的增加,酶活性变大,但温度高于30℃,随着温度的增加酶活性反而降低,因此当反应升高温度可以加快反应速率,但反应提高到一定温度时,反应速率反而变慢,30℃为CAT活性测定的合适温度。
2.3 pH对CAT活性的影响
图3为不同pH的条件下氧电极测定反应室中含氧量的变化。将图3数据进行线性回归,可计算得到线性方程及酶活性,见表3。当反应pH范围在6.8~7.6时,释放氧气的速率最大,此时酶活性较高,其中以pH为7.2时酶的活性最高。当pH=8.0时的酶活性比pH=6.4的酶活性高,但随着pH的升高,CAT活性不断降低,在弱碱性的环境下CAT活性较大,最适的测定pH为7.2。

表3 pH对CAT活性的影响Table 3 The effects of pH on CAT activity
2.4 H2O2浓度对CAT活性的影响
图4为不同过氧化氢浓度下氧电极测定反应室中含氧量的变化。将图4数据进行线性回归,可计算得到线性方程及酶活性,见表4。当底物浓度在0.15mol/L~0.75mol/L时,过氧化氢浓度为0.75mol/L,酶的反应速率最大。当过氧化氢的浓度较低的时候其酶的反应速率较低,但随着浓度的增加,酶反应速率不断增加,说明过氧化氢酶分解过氧化氢的同时,过氧化氢的浓度液影响着酶的分解速度。由图4的变化趋势,0.6~0.75 mol/L是合适的底物浓度区域。
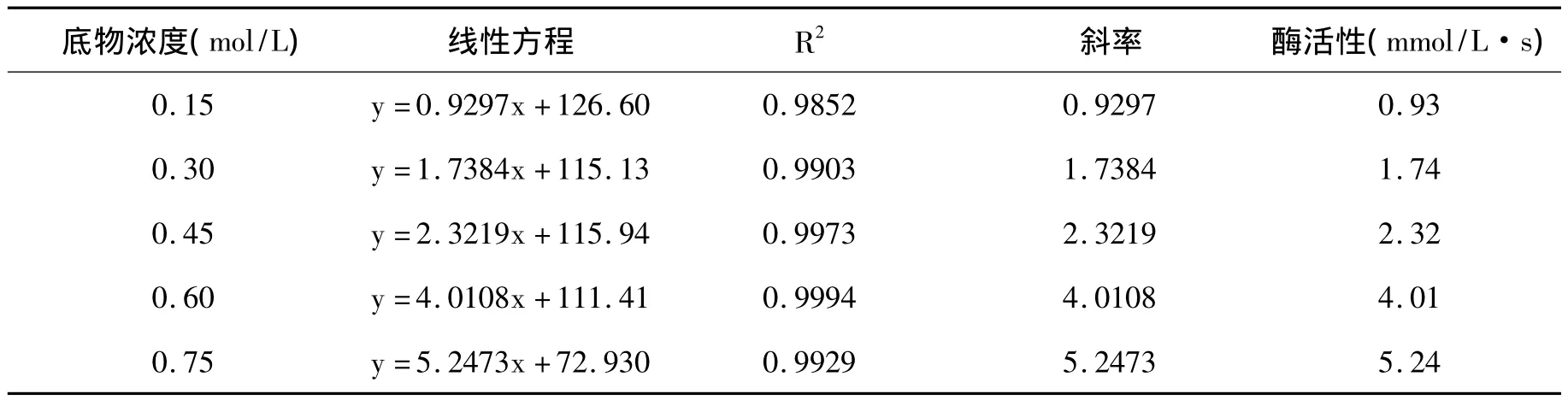
表4 H2O2浓度对CAT活性的影响Table 4 The effects of hydrogen peroxide concentration on CAT activity
3 讨论
硫酸铵分级沉淀是利用较高浓度的盐离子会与蛋白质争夺水分,使得蛋白质表层亲水的水化膜遭到破坏而使蛋白质沉淀但不会变性。研究表明,硫酸铵在高浓度时抑制蛋白酶活性,随着硫酸铵浓度的增加,过氧化氢酶活性反而减小,过氧化氢酶的硫酸铵最佳饱和浓度为20%。
朱启忠[9]对萌发棉子的酶活性研究中指出在中低温(14℃ ~22℃)处理过氧化氢酶,其活性无明显差异,高温(30℃)是室温处理的1.85倍,差异显著,效果最佳。本研究中发芽苦荞中过氧化氢酶的最适温度为30℃左右,随着温度的增加过氧化氢酶的内能增加,活化分子数目增加,酶活性增强,到30℃酶活性达到最高,温度继续增加,活性酶的浓度大大降低,但40℃未达到使蛋白质变性的温度,所以不会使酶失活,而是使酶活性降低。pH能够控制CAT分子活性部分有关的基因是否解离,在CAT最适pH时,酶分子上的活性基因最适于与底物结合,pH高于或低于最适pH时,活性基因的解离状态发生改变,酶和底物的结合力降低,使酶的反应速率降低。张福平[10]对佛手瓜中的过氧化氢酶的最佳pH范围为6.5~8.0,最适pH为7.5。发芽苦荞的最佳pH范围为6.8~7.6,pH=7.2时酶活性最大,其变化规律是随着酸性增加或碱性增加,其酶活性均逐渐减小。
CAT在底物浓度较低时,随底物浓度的增加反应速率加快,在0.15mol/L~0.75mol/L的过氧化氢浓度区间内,0.15mol/L的过氧化氢酶活性最低,0.75mol/L的过氧化氢酶活性最高。张随成[11]对土壤中的过氧化氢酶的进行研究指出过氧化氢的最佳浓度为0.741mol/L,发芽苦荞中的过氧化氢酶最佳底物浓度接近于土壤中过氧化氢酶的最佳底物浓度,因此在试验底物浓度区间中,最适底物浓度为0.75mol/L。
理论上,过氧化氢在高温下易分解,30℃以下最稳定,70℃以上反应速率更快,在碱性条件下易分解,浓度越高越容易分解,超过浓度65%会产生较大的危害[12]。商品过氧化氢药品均加有稳定剂,若要过氧化氢分解需超过其活化能,试验温度控制在25℃ ~40℃的区间内,不会使过氧化氢大量分解。从pH的角度说,利用磷酸缓冲溶液调节试验所需酸碱度,可以减少酸碱度对过氧化氢的影响,而选用0.15mol/L~0.75mol/L区间的底物浓度可防止由于过氧化氢浓度过高而导致过氧化氢分解,综上所述,试验过程可排除过氧化氢对试验的影响。
4 结论
(NH4)2SO4分级沉淀能够使过氧化氢粗酶液的酶浓度增加,达到提纯的效果,最适饱和度为20%,随着饱和度的增高,酶活性减小。研究表明,CAT活力测定最适温度为30℃,最适温度范围为30℃ ~40℃。CAT适宜偏中性环境,pH低于6.8或高于7.6的酶活性逐渐降低,在pH6.8~pH7.6之间酶活性最好,且最佳pH为7.2。当H2O2浓度较低时,过氧化氢酶会随着过氧化氢的浓度升高而变大,0.6~0.75 mol/L是合适的底物浓度区域。用氧电极测CAT活性能够很好的控制温度等条件,灵敏度高,方便快捷,是一种值得推广的方法。
[1]郎桂常.苦荞麦的营养价值及其开发应用[J].中国粮油学报,1996,11(3):10-11.
[2]南芝润,范月仙.植物过氧化氢酶的研究进展[J].安徽农学通报,2008,14(5):27-29.
[3]王华芳,展海军.过氧化氢酶活性测定方法的研究进展[J].科技创新导报,2009(19):7-8.
[4]陈晓敏.测定切花中过氧化氢酶活性的3种常用方法的比较[J].热带农业科学,2002,33(5):13-15.
[5]杨亚平,姜孝成,陈良碧,等.水稻种子老化的生理机制[J].湖南农业大学学报:自然科学版,2008,34(3):265-268.
[6]李立祥,吴红梅.提取方法对茶多酚氧化酶活性的影响[J].中国茶叶加工,2001(4):30-31.
[7]程宇,程珂,陈力宏,等.不同方法制备马铃薯蛋白的结构及功能性质研究[J].食品科技,2015,40(2):229-230.
[8]李钦,张树政.氧电极及其在生物化学分析中的应用[J].化学通报,1982(6):23-28.
[9]宋淑淑,朱启忠.不同条件下壳聚糖对棉子萌发及相关酶活性的影响[J].中国棉花,2012(7):18-20.
[10]张福平,何秀娟,张秋燕.不同因素对佛手瓜过氧化氢酶活性的影响[J].贵州农业科学,2010,38(6):47-49.
[11]罗泽娇,张随成.简易气量法测试土壤过氧化氢酶活性的研究[J].地质科技情报,2005,24(4):87-90.
[12]许志忠,李晓春.过氧化氢分解影响因素分析[J].染整技术,2006,28(1):33-36.
