超高效合相色谱/二极管阵列检测器测定螺旋藻保健食品中的类胡萝卜素
2015-11-29赵海燕李丽萍吴国华
李 兵,赵海燕*,刘 伟,范 赛,李丽萍,吴国华,薛 颖,赵 榕
(1.北京市疾病预防控制中心 营养与食品卫生所,北京 100013;2.北京市疾病预防控制中心科研教学管理办公室,北京 100013)
类胡萝卜素是一类天然存在的脂溶性色素,普遍存在于藻类、植物、真菌和细菌中。人和动物不能合成类胡萝卜素,均需通过食物获取[1-2]。近年来,大量流行病学调查显示,摄入富含类胡萝卜素的食物可以降低罹患许多慢性病的风险[3-8]。玉米黄质和叶黄素具有预防光损伤和防治老年性黄斑衰退症的功能[9]。β-胡萝卜素是一种重要的维生素A来源,通过摄入β-胡萝卜素可以有效的对维生素A进行补充[10]。因此明确食物中类胡萝卜素的含量对于探讨膳食和健康之间的特异性联系有重要意义。螺旋藻营养价值丰富,世界上很多地方将其列为保健食品,准确测定其类胡萝卜素含量,对于正确评价螺旋藻保健食品的营养价值,开展营养学研究十分必要。
植物中类胡萝卜素的检测方法有高效液相色谱法[11-12]、液相色谱 - 串联质谱法[13]、超临界流体色谱法[14-15]。由于类胡萝卜素的同分异构体较多,如玉米黄质和叶黄素的分子量完全相同,分子结构只有双键位置的差异(见图1),高效液相色谱法中较常用的C18色谱柱难以将其分离。C30色谱柱可以对二者进行分离,但需使用大量二氯甲烷、三氯甲烷等对人体危害较大的溶剂,且分析时间较长[16]。液相色谱-串联质谱法由于类胡萝卜素同位素内标较难获得,因此定量分析较为困难。超临界流体色谱(Supercritical fluid chromatography,SFC)是一种分离度高、绿色环保的分离仪器,以超临界CO2作流动相,具有接近于气体的低粘度和高扩散系数,在相同的时间内,可获得比液相色谱更高的分离度和更尖锐的峰形。目前SFC测定类胡萝卜素的报道多关注于色谱分离结果的分析与讨论,定量分析方法较少[14-15]。Abrahamsson等[14]采用SFC对栅藻中的类胡萝卜素进行了测定,并将2根5 μm粒径的C18和2-EP色谱柱串联使用,以获得良好的分离效果,然而色谱柱的增加也同时造成分析时间的延长和系统压力的增加。
超高效合相色谱(Ultraperformance convergence chromatography,UPC2)或超高效超临界流体色谱(Ultra high performance SFC,UHPSFC)[17]集SFC和UPLC的优点于一体,色谱柱采用亚2 μm的填料,与传统的5 μm色谱柱相比,粒径减小使得色谱柱理论塔板高度减小,更有利于分离[18-19]。目前尚无将UPC2应用于螺旋藻保健食品中类胡萝卜素测定的报道。本研究建立了超高效合相色谱测定螺旋藻保健食品中β-胡萝卜素、玉米黄质和叶黄素的方法。此方法可用于日常样品的定量检测,具有操作简便、快速、灵敏度高等特点。

图1 β-胡萝卜素、玉米黄质和叶黄素的分子结构Fig.1 Molecular structures of β-carotene,zeaxanthin and lutein
1 实验部分
1.1 仪器与试剂
ACQUITY UPC2系统(美国Waters公司),配ACQUITY UPC2PDA检测器;ACQUITY UPC2HSS C18SB色谱柱(150 mm×3.0 mm,1.8 μm,美国Waters公司);紫外-可见光分光光度计(日本岛津公司);离心机(美国Beckman公司);超声波清洗器(上海科导公司);FA2004电子天平(感量:0.000 1 g,上海天平仪器厂);0.2 μm GHP有机过滤膜(美国Waters公司)。
甲醇、乙醇、异丙醇(色谱纯,美国Fisher Scientific公司);二氯甲烷、丙酮、四氢呋喃、正己烷、二甲亚砜(色谱纯,美国Dikma公司);β-胡萝卜素(25 mg TypeⅡ,Synthetic,≥95%,美国Sigma公司),玉米黄质(25 mg,95.5%,美国ChromaDex公司),叶黄素(25 mg,91.5%,美国ChromaDex公司),氢氧化钾(分析纯,国药集团化学试剂有限公司),2,6-二叔丁基对甲酚(BHT,≥99.0%,美国Sigma公司)。
1.2 标准储备液制备
标准储备液配制:称取β-胡萝卜素标准品0.019 8 g,以二氯甲烷溶解,定容至100.0 mL棕色容量瓶中。称取玉米黄质标准品0.018 0 g、叶黄素标准品0.015 0 g用乙醇溶解,转移并定容至100.0 mL棕色容量瓶。3种类胡萝卜素标准储备液使用前均需校正。
标准溶液浓度的校正[20-21]:吸取0.10 mL β-胡萝卜素标准储备液至棕色容量瓶,用正己烷定容至10.0 mL,用分光光度计在453 nm校正波长下测得比吸光系数为2 592;分别吸取0.10 mL玉米黄质和叶黄素标准储备液至棕色容量瓶,用无水乙醇定容至10.0 mL,玉米黄质在450 nm校正波长下测得比吸光系数为2 540;叶黄素在445 nm校正波长下测得比吸光系数2 550。以公式C=A×10 000/计算其实际浓度(见表1)。

表1 类胡萝卜素标准储备液浓度Table 1 Concentrations of the carotenoids standard stock solutions
1.3 样品前处理
称取0.50 g样品置于50 mL离心管中,依次加入0.1 g BHT以及15.0 mL二氯甲烷-乙醇溶液(2∶1),充入氮气排出空气后盖上盖子,10℃超声提取15 min后,在10 000 r/min条件下离心10 min,转移上层清液至50.0 mL棕色容量瓶中,重复提取2次,合并提取液并定容至50.0 mL,过0.2 μm GHP滤膜后直接上机测定,实验全程避光。
1.4 仪器分析条件
色谱柱:ACQUITY UPC2HSS C18SB柱(150 mm×3.0 mm,1.8 μm);流动相:二氧化碳(A)-甲醇(B);梯度洗脱程序:0~7 min,90%~75%A;7~8 min,75%A;8~8.5 min,90%A。流速:1.0 mL/min。柱温40℃;进样量为1 μL;系统背压2 000 psi。β-胡萝卜素、叶黄素和玉米黄质的检测波长分别为436,432,438 nm。
2 结果与讨论
2.1 色谱柱的选择
采用CO2-甲醇流动相体系考察了4根Waters UPC2色谱柱对3种类胡萝卜素分离的影响,包括ACQUITY UPC2BEH色谱柱(150 mm×3.0 mm,1.7 μm,未键合型),ACQUITY UPC2BEH 2-EP色谱柱(150 mm×3.0 mm,1.7 μm,2-乙基吡啶键合相,未封端),ACQUITY UPC2CSH Fluoro-Phenyl Column色谱柱(150 mm×3.0 mm,1.7 μm,氟苯基键合相,未封端)以及ACQUITY UPC2HSS C18SB色谱柱(150 mm×3.0 mm,1.8 μm,C18键合相,未封端),结果见图2。从图中可以看出不同色谱柱对于3种类胡萝卜素的保留情况不同。但基本类似正相色谱的选择性,即极性较弱的β-胡萝卜素最先流出,极性强的叶黄素和玉米黄质较晚出峰。从BEH柱的色谱图可以看出,由于不带任何键合相的BEH色谱柱与极性基团的相互作用较强,因此能够初步分离极性稍强的叶黄素和玉米黄质,但由于非极性的β-胡萝卜素保留较弱,出峰较早,容易受到干扰;BEH 2-EP色谱柱对非极性的β-胡萝卜素保留也较弱,叶黄素和玉米黄质的峰形较差;CSH色谱柱的键合相是氟苯基,其对β-胡萝卜素、叶黄素和玉米黄质的保留均较弱,且3个组分的出峰时间短,从而造成分离度较差,叶黄素与玉米黄质二者不能很好分离。HSS C18SB色谱柱对3种类胡萝卜素的分离度高,峰形良好。可能是因为HSS C18SB色谱柱的C18键合相对这3种物质有很好的保留作用。由于CO2对于非极性的β-胡萝卜素溶解能力较强,因此首先被洗脱出,之后随着流动相中甲醇含量的增加,叶黄素和玉米黄质被洗脱下来。HSS C18SB色谱柱可以满足样品中3种类胡萝卜素的测定要求。因此实验选择ACQUITY UPC2HSS C18SB色谱柱。
2.2 助溶剂的选择
超临界CO2具有较强的非极性,通过添加助溶剂,改变流动相极性,可以实现不同极性目标物的洗脱。本研究考察了甲醇、乙醇、异丙醇作为助溶剂对3种类胡萝卜素的分离情况。实验结果表明,3种醇均能实现3种类胡萝卜素的有效分离。对于非极性较强的β-胡萝卜素,3种溶剂的洗脱能力相差不大。对于极性稍强的叶黄素和玉米黄质,随着异丙醇、乙醇、甲醇极性的递增,洗脱能力增强。因此,使用甲醇为助溶剂可以缩短分析时间,且峰形更加尖锐。因此实验选择甲醇为助溶剂。
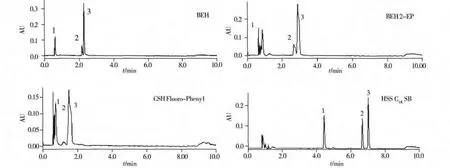
图2 β-胡萝卜素(1)、叶黄素(2)和玉米黄质(3)在4种色谱柱上的色谱图Fig.2 Chromatograms of β-carotene(1),lutein(2)and zeaxanthin(3)on 4 different columns
2.3 系统背压及温度的选择
UPC2主要采用超临界状态的CO2作流动相,流动相密度的增大可提高其对物质的溶解能力。系统背压和温度的改变均可改变流动相的密度,从而改变其洗脱能力和选择性。因此本实验考察了不同的系统背压(1 700,1 900,2 000,2 100 psi)对分离的影响。结果表明,随着背压的增大,3种化合物的洗脱能力均增强,这是由于随着超临界状态CO2密度的增大,其对类胡萝卜素的溶解能力逐渐增强,但对这3种类胡萝卜素的分离和峰形影响不大。较大的系统背压虽可以缩短分析时间,但同时也会增大系统压力,影响色谱柱和仪器的寿命。为了兼顾分析时间和系统压力,本研究选择系统背压为2 000 psi。进一步考察了不同柱温(35,40,50℃)对分离的影响,结果显示,不同温度对于类胡萝卜素分离的差异不大,但由于类胡萝卜素受热易分解,需要尽量选择较低的温度。综合考虑峰形和保留时间,选择柱温为40℃。
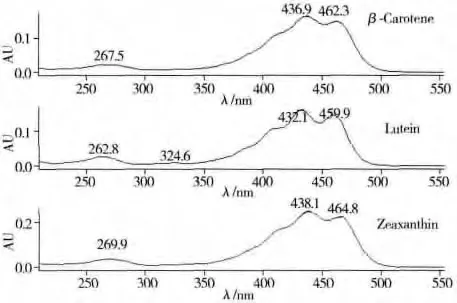
图3 β-胡萝卜素、叶黄素、玉米黄质的UPC2光谱图Fig.3 UPC2spectra of β-carotene,lutein and zeaxanthin
2.4 检测波长的选择
采用3D检测模式,对胡萝卜素、叶黄素和玉米黄质标准品进行扫描(见图3)。选择436,432,438 nm为最佳吸收波长。
2.5 UPC2与UPLC分离效果的比较
Bijttebier等[22]使用 ACQUITY UPLC HSS C18SB(100 mm ×2.1 mm,1.7 μm)色谱柱对类胡萝卜素进行了分离,采用较为复杂的流动相体系,A为5 mmol/L乙酸铵水溶液-甲醇-乙腈-乙酸乙酯(50∶22.5∶22.5∶5),B为乙腈-乙酸乙酯(50∶50),此方法对玉米黄质和叶黄素的分离较差。而本研究采用UPC2测定时二者实现了完全分离,且只需10 min即可完成样品的分析。而UPLC分析时间较长,需要17 min才能使3种类胡萝卜素完全流出。虽然UPLC和UPC2使用的色谱柱填料和粒径较为相似,但UPC2的分离效率更高,分析时间更短。
2.6 提取溶剂的选择
自然界中很多植物均富含类胡萝卜素,由于类胡萝卜素的种类繁多,从叶黄素到胡萝卜素的极性差异较大。不同植物组织结构不同,类胡萝卜素的含量也不尽相同,因此现在并没有一种公认的适用于任何植物中所有类胡萝卜素的提取方法。对于β-胡萝卜素等非极性类胡萝卜素,较常用的提取溶剂有正己烷、二氯甲烷、乙酸乙酯、氯仿、四氢呋喃等;对于叶黄素等极性类胡萝卜素,提取溶剂为乙醇、丙酮、甲醇、异丙醇等。为兼顾不同极性类胡萝卜素的提取效率,本研究选择混合溶剂提取,并对比了不同溶剂的提取效率。与Yu等[23]的报道相同,本实验发现所测样品不含叶黄素,因此叶黄素采用加标的方法进行溶剂的选取。分别称取0.50 g样品,均加入143 μg/mL叶黄素标准溶液1.00 mL,其余方法同“1.3”。分别考察了丙酮、四氢呋喃、丙酮-正己烷(2∶8)、二甲亚砜-二氯甲烷-乙醇(1∶1∶2)、乙醇-正己烷(4∶3)、正己烷-丙酮(1∶1)、二氯甲烷-乙醇(2∶1)以及丙酮-乙醇(1∶1)对β-胡萝卜素、玉米黄质和叶黄素3种类胡萝卜素的提取效果,结果见图4。结果表明,二氯甲烷-乙醇(2∶1)的提取效率最高。因此本文采用二氯甲烷-乙醇(2∶1)作为提取溶剂。
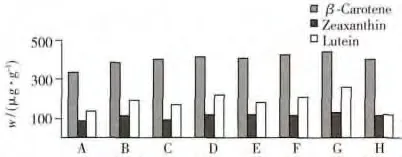
图4 不同混合溶剂对类胡萝卜素的提取结果Fig.4 Extraction amount of carotenoid in different mixture solventsA.acetone,B.THF,C.acetone-hexane(2∶8),D.DMSO-DCM-ethanol(1∶1∶2),E.ethanol-hexane(4 ∶3),F.hexane-acetone(1∶1),G.DCM-ethanol(2∶1),H.acetone-ethanol(1∶1)
2.7 方法验证实验
2.7.1 标准曲线、检出限与定量下限 准确吸取β-胡萝卜素标准储备液,配成浓度为1.12,1.87,3.74,7.48,14.96,18.70 μg/mL标准系列;准确吸取玉米黄质标准储备液配成浓度为0.835,1.67,3.34,6.68,13.36,16.70 μg/mL标准系列;准确吸取叶黄素标准储备液配成浓度为1.29,1.43,5.72,8.58,11.44,14.30 μg/mL标准系列。以标准系列溶液的峰面积(Y)对相应浓度(X,μg/mL)建立线性回归方程,各组分在线性范围内的峰面积与浓度呈良好线性关系,相关系数均不低于0.999 3。通过逐级稀释样品溶液,按信噪比S/N=3和S/N=10分别计算分析方法的检出限(LOD)和定量下限(LOQ),得到方法的LOD为0.012~0.035 mg/g,LOQ为0.040~0.120 mg/g(见表2)。

表2 3种类胡萝卜素的线性范围、线性方程、相关系数、检出限与定量下限Table 2 Linear ranges,regression equations,correlation coefficients(r2),limits of detection and limits of quantitation of three carotenoids
2.7.2 回收率与精密度 分别向样品中添加3种成分的标准品,设置低、中、高3个加标水平,按照“1.3”方法处理后上机测定,每个加标水平重复测定6次,并计算其加标回收率和相对标准偏差(RSD)。结果如表3所示,β-胡萝卜素、玉米黄质与叶黄素的平均回收率为82.5%~95.7%,RSD为7.6%~9.8%,可以满足测定需要。

表3 样品中3种类胡萝卜素的含量及其加标回收率(n=6)Table 3 Contents and spiked recoveries of three cartenoids in samples(n=6)
2.8 实际样品的测定
应用上述方法,对市售的10种螺旋藻保健食品进行测定,结果测得β-胡萝卜素含量为230~1 160 μg/g,玉米黄质含量为102~584 μg/g,均未检出叶黄素。
3 结论
本文建立了超高效合相色谱测定螺旋藻保健食品中β-胡萝卜素、玉米黄质和叶黄素的分析方法。通过对色谱柱、助溶剂、柱温和背压的优化,在10 min内实现了3种类胡萝卜素的有效分离。与传统的液相色谱方法相比,极大地缩短了分析时间。且采用CO2和少量甲醇为流动相,减少了有机溶剂的使用。本方法绿色环保、环境友好、简便、快速,可应用于实际样品的测定。
[1]Amorim -Carrilho K T,Cepeda A,Fente C,Regal P.Trac-Trend.Anal.Chem.,2014,56(4):49-73.
[2]Perera C O,Yen G M.Int.J.Food Prop.,2007,10:201-230.
[3]de Quirós A R B,Costa H S.J.Food.Compost.Anal.,2006,19:97 -111.
[4]Rao A V,Rao L G.Pharmacol.Res.,2007,55(3):207 -216.
[5]Chiu C J,Taylor A.Exp.Eye.Res.,2007,849(2):229 -245.
[6]Nishino H,Murakoshi M,Tokuda H,Satomi Y.Arch.Biochem.Biophys.,2009,483(2):165-168.
[7]Sun Y J,Qiao L P,Zhong L Z,Ye X Q.J.Chin.Inst.Food Sci.Technol.(孙玉敬,乔丽萍,钟烈洲,叶兴乾.中国食品学报),2012,12(1):160-163.
[8]Karppi J,Kurl S,Mkikallio T H,Ronkainen K,Laukkanen J A.Int.J.Cardiol.,2013,168(3):1841 -1846.
[9]Hayashi R,Hayashi S,Arai K,Sakai M,Okamoto H.Exp.Eye.Res.,2014,129:5 -12.
[10]Yu Y J,Zhao Y,Pan L L,Yin S A.J.Hyg.Res.(喻颖杰,赵耀,潘丽莉,荫士安.卫生研究),2006,28(6):461-467.
[11]Yao J H,Huang B F,Ren Y P,Liu W H.Acta Nutrimenta Sinica(姚建花,黄百芬,任一平,刘文涵.营养学报),2013,34(1):282-288.
[12]Luterotti S,Markovic K,Franko M,Bicanic D,Madzgalj A,Kljak K.Food Chem.,2013,140(1):390-397.
[14]Abrahamsson V,Rodriguez-Meizoso I,Turner C.J.Chromatogr.A,2012,1250:63-68.
[15]Matsubara M,Bamba T,Ishida H,Fukusaki E,Hirata K .J.Sep.Sci.,2009,32(9):1459-1464.
[16]Lane S,Katherine S,Matthias P.J.Chromatogr.A,2000,880(1):189 -202.
[17]Perrenoud A,Boccard J,Veuthey J L,Guillarme D.J.Chromatogr.A,2012,1262:205-213.
[18]Huang D.Chin.J.Chromatogr.(黄德.色谱),1987,5(5):287-291.
[19]Khater S,West C,Lesellier E.J.Chromatogr.A,2013,1319:148-159.
[20]Graulet B C.Anal.Bioanal.Chem.,2010,397:777-790.
[21]BS EN 12823-2:2000.Foodstuffs-Determination of Vitamin A by High Performance Liquid Chromatography-Part 2:Measurement of p-Carotene.European Committee For Standardization.British Standard.
[22]Bijttebier S,D'Hondt E,Noten B,Hermans N,Apers S,Voorspoels S.J.Chromatogr.A,2014,1332:46-56.
[23]Yu B L,Wang J,Suter P M,Russell R M,Grusak M A,Wang Y,Wang Z X,Yin S A,Tang G W.British Journal Nutrition,2012,108(4):611-619.
