长江中下游三个湖泊中鳜消化道寄生蠕虫群落的组成与多样性
2015-11-29卢明淼李文祥王微微马幸荣吴山功王桂堂
卢明淼 李文祥 王微微 马幸荣 吴山功 邹 红 王桂堂
长江中下游三个湖泊中鳜消化道寄生蠕虫群落的组成与多样性
卢明淼1, 2李文祥1王微微1, 2马幸荣1, 2吴山功1邹 红1王桂堂1
(1. 中国科学院水生生物研究所, 水生生物多样性与保护重点实验室, 武汉 430072;2.中国科学院大学, 北京 100049)
鱼类在食物网中的营养位置对其消化道寄生蠕虫的群落结构有重要作用。本研究调查了梁子湖、洞庭湖、鄱阳湖中鳜()消化道寄生蠕虫群落的组成和多样性。在3个湖泊中共发现11种寄生蠕虫, 优势种均为范尼道佛吸虫(), 频率分布中感染有1—2种寄生虫的样本占65%, 单个样本中最大物种数为6。3个湖泊中平均物种丰富度为1.53—2.13, Brillouin多样性指数为0.12—0.33, 其中鄱阳湖中的多样性最高。梁子湖和洞庭湖之间的Jaccard相似度和百分比相似指数最高。通过比较食物网中不同营养位置鱼类的消化道寄生蠕虫群落结构, 发现鳜的消化道寄生虫群落的物种丰富度与多样性水平都高于植食性和杂食性鱼类。研究还讨论了宿主食物组成对消化道寄生蠕虫群落结构的影响。
鳜; 寄生虫; 群落; 多样性
鱼类消化道寄生蠕虫一般通过摄食食物或中间宿主而获得, 因此, 鱼类的食物组成对鱼类消化道寄生蠕虫的种类和数量有着重要的影响[1], 甚至可以决定群落结构特征[2]。鱼类消化道寄生蠕虫通常被认为是沿着鱼类食物网传播的, 在食物网的顶位种鱼类中, 其消化道寄生虫群落往往具有较高的的多样性[3], 也就是说, 肉食性鱼类消化道内寄生蠕虫的物种丰富度和多样性比滤食性、草食性和腐食性鱼类的更高[4, 5]。
在我国的长江中下游, 有丰富的鱼类资源, 鱼类寄生虫种类繁多[6]。然而, 迄今为止, 在该水系中仅见杂食性鱼类鲤()和肉食性鱼类黄颡鱼()[7, 8]体内寄生蠕虫群落的研究报道。鳜()是一种广泛分布于长江中下游平原的湖泊中[9, 10]的凶猛肉食性鱼类, 以捕食虾类和不同营养级的鱼类为生, 草食性、杂食性、肉食性鱼类都是它的食物来源[11, 12], 是淡水鱼类食物网中的顶级捕食者[13]。据报道, 目前发现的鳜体内寄生蠕虫有10种之多[6], 但是其体内蠕虫群落结构特征尚不明确。本研究调查了长江中下游3个湖泊中鳜消化道内寄生蠕虫群落的组成和多样性, 以期为深入研究宿主食物组成对消化道寄生蠕虫群落结构的影响奠定理论基础。
1 材料与方法
1.1 采样地点和方法
2012年11月在长江中下游的梁子湖、洞庭湖和鄱阳湖对鳜进行随机取样。鳜用刺网捕捞, 每个采样点的样本量都大于50尾。在48h内测量鱼的尾叉长, 解剖鱼体, 取出胃、幽门盲囊和肠道, 用解剖刀刮取胃和肠的内容物及黏液置于玻片, 盖另一玻片并轻压, 使内容物均匀展开, 在体式显微镜下观察, 幽门盲囊直接放在两片玻片中间挤压后, 置于体视显微镜下; 在显微镜下鉴定寄生虫的种类, 并统计数量, 无法在显微镜鉴定的种类, 收集、压片, 并用80%的酒精固定, 再经染色后鉴定。
1.2 群落特征分析与相关性检验
鳜消化道寄生虫的群落结构分析分别在组分群落(Component community)和内群落(Infracommunity)两个水平上进行。组分群落结构采用统计参数: 物种丰富度(Species richness), Shannon-Wienner多样性指数(SW)和Berger-Parker 优势度指数(BP)。内群落结构采用统计参数: 平均丰度和平均物种丰富度、最大物种数、Brillouin多样性指数(BI)(包含未被寄生虫感染的样本)。所有参数的计算和定义参考Magurran[14]和Bush等[15]。在内群落水平上, 用Jaccard相似性指数(定性统计)与百分数相似指数(定量统计)来评价湖泊间的相似度[14, 16]。
用Kolmogorov-Smirnov检验比较不同采样点鳜平均体长的差异性, 感染丰度与鳜体长的相关性用Spearman秩相关检验, 不同湖泊间的Brillouin多样性指数和物种丰富度采用检验统计差异。用SPSS软件和EXCEL软件在计算机上进行数据处理。
2 结果
在3个湖泊共调查鳜166尾, 梁子湖、洞庭湖和鄱阳湖中鳜的平均体长分别为28.8 cm (19.5— 39.0)、30.68 cm (15.8—39.5)和31.67 cm (24.1—44.3), 平均体长之间无显著差异(>0.05), 同时, 寄生虫的感染丰度与鱼体长无显著相关关系(>0.05)。
寄生蠕虫物种数的频率分布如图1, 梁子湖、洞庭湖、鄱阳湖中鳜感染蠕虫的最大物种数分别为5种、4种、6种。3个湖泊中鳜消化道寄生蠕虫的种类组成、每种寄生虫的感染率和平均丰度见表1, 共发现11种寄生蠕虫, 除了主要类群复殖吸虫5种外, 还包括绦虫1种, 棘头虫2种, 线虫3种, 其中有6种寄生虫在三个湖泊的鳜消化道内都有分布。范尼道弗吸虫()在三个湖泊中的平均丰度都是最高, 其感染率在梁子湖和洞庭湖也最高, 分别为98.44% 和84.31%, 在鄱阳湖也高达41.18%; 河鲈源吸虫()在鄱阳湖中感染率最高, 达到54.90%; 斜睾合肠吸虫()和鳜航尾吸虫()在洞庭湖和鄱阳湖中感染率均大于10%; 强壮粗体虫()、黄颡前驼形线虫()和鳜毛细线虫()在梁子湖中的感染率大于10%。
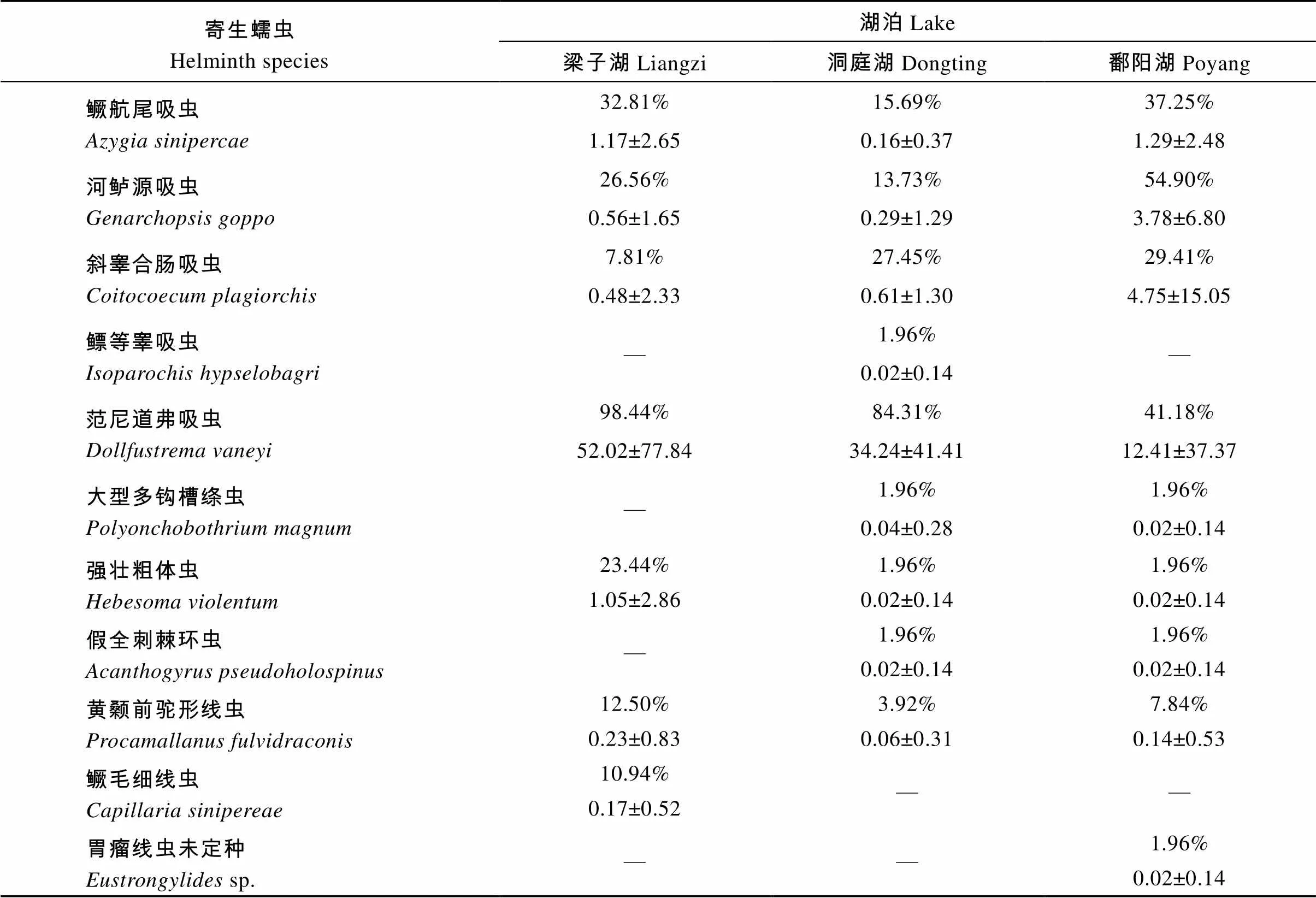
表1 三个湖泊中鳜消化道寄生蠕虫的感染率和平均丰度
在寄生虫群落结构方面, 这三个湖泊中的优势种均为范尼道佛吸虫(表2)。梁子湖中的平均物种丰富度(2.13)显著高于洞庭湖(1.53), 但与鄱阳湖(1.78)没有显著差异(> 0.05); 梁子湖中寄生蠕虫的平均个体数(55.69)显著高于洞庭湖(35.45)和鄱阳湖(22.45)。鄱阳湖的Shannon-Wiener多样性指数(0.41)和Brillouin多样性指数(0.33)最高, 且显著高于其他两个湖泊。梁子湖和洞庭湖中的Berger-Parker优势度指数都高于0.9, 而鄱阳湖中只有0.55。此外, 在湖泊内的相似性上, 梁子湖和洞庭湖的平均Jaccard相似性指数较高, 都大于0.4, 而鄱阳湖较低, 为0.23; 在湖泊间的相似性上, 梁子湖与洞庭湖间的Jaccard相似性指数与百分相似指数较高, 而与鄱阳湖比较都较低(表3)。
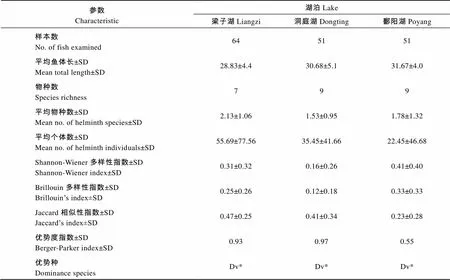
表2 三个湖泊中鳜消化道寄生蠕虫的内群落特征
注: *Dv. 范尼道弗吸虫

表3 三个湖泊间的Jaccard相似性指数与百分相似指数
3 讨论
本调查发现, 三个湖泊中鳜消化道寄生蠕虫群落的物种丰富度为1.53—2.13, Brillouin多样性指数为0.13—0.33。比欧洲鳗鲡()、虹鳟()、和[17—20]在调查中得到的相应数值高, 可见鳜物种丰富度和多样性水平较高, 这可能与鳜的食物组成和在鱼类食物网中的营养水平有关。
鱼类消化道寄生蠕虫一般通过摄食食物或中间宿主获得, 鱼类的食物组成决定着寄生虫的种类和数量[1, 2], 而且肉食性鱼类消化道内寄生蠕虫的多样性往往更高[3—5]。鳜作为肉食性鱼类, 尽管相对杂食性鱼类其摄食生态位宽度狭窄, 但是其食谱中的鱼类种类较多, 包括虾类和13种以上的鱼类, 包括植食性鱼类, 如兴凯()、大鳍(), 偏植食性的杂食性鱼类, 如鲫(), 偏动物性的杂食性鱼类, 如麦穗鱼()、(), 无脊椎动物食性鱼类, 如吻虎(), 以及鱼食性鱼类, 如红鳍鲌()、黄颡鱼()[6, 11, 12]等等, 它是鱼类食物网中顶位种, 根据稳定同位素方法测定的营养水平, 它也几乎是所有鱼类中最高的[17]。
鳜消化道中几乎所有的寄生蠕虫种类都与其食物组成有关, 即通过鳜捕食其他鱼类而感染。在本调查发现的11种寄生蠕虫中, 鳜航尾吸虫、范尼道佛吸虫、强壮粗体虫、鳜毛细线虫()和大型多沟槽绦虫()这5种寄生虫通常在鳜体内发现, 认为是宿主特异性种类(Host specialists), 而另外6种蠕虫在其他鱼类的消化道内经常被发现[6], 认为是宿主广谱种类(Host generalists)。其中, 河鲈源吸虫、斜睾合肠吸虫、鳔等睾吸虫()、黄颡前驼形线虫和假全刺棘环虫()这5种宿主广谱寄生虫的中间宿主是虾类或螺类, 常见的终末宿主是黄颡鱼、鲫和吻虎[21, 22]。而这几种鱼类都是鳜的食物组成[13], 可见, 鳜可通过摄食它们的中间宿主或终末宿主感染此类寄生虫。由于鳜是鱼类食物网中的顶位种, 食物中鱼类种类丰富, 因此, 鳜体内有较多的宿主广谱的寄生虫种类。
在几种宿主特异性种类中, 范尼道佛吸虫的生活史较复杂, 第一中间宿主是淡水壳菜(), 第二中间宿主是鲫、麦穗鱼、草鱼和黄颡鱼等鱼类, 鳜是终末宿主[21, 23]。它的第二中间宿主恰恰是鳜的最主要食物来源[11—13]。范尼道佛吸虫在三个湖泊中都是优势种, 可能是鳜可以通过摄食大量第二中间宿主而感染。大型多沟槽绦虫可能通过中间宿主螺类和桡足类等感染鳜, 但这两类动物并不是鳜的常见摄食类群, 因此它在三个湖泊中的感染水平并不高(表2), 但并不排除可通过第二中间宿主感染。
寄生虫生活史和鱼类间营养关系可为寄生虫在食物网中的传播提供丰富的信息。处在鱼类食物网顶位种的鳜, 摄食广泛的鱼类物种, 有更多机会感染更多种类和数量的寄生蠕虫。在本研究中, 鳜消化道寄生虫有11种, 频度分布中感染有1种或2种寄生虫的样本占大多数, 单个样本最大感染寄生虫的物种数为6种, 平均物种丰富度在1.53以上。同时, 鳜消化道内发现的寄生虫除胃瘤线虫未定种为幼虫外, 其他均为成虫。而作为鱼类食物网中位种的欧洲鳗鲡(), 消化道蠕虫有6种, 且大多数样本仅感染有优势种, 单个样本最多感染3种寄生虫, 物种丰富度较低[18]。同样是中位种的虹鳟(), 消化道寄生蠕虫只有4种, 其频度分布中感染有1种寄生虫的样本占大多数, 其次是未被感染的样本[19]。生活在热带的中位种和感染的寄生蠕虫分别为11种和9种, 平均物种丰富度为0.02和0.96[17, 20]。由此可见, 鳜体内寄生蠕虫较高的物种丰富度与其在食物网中的营养位置密切相关。
在包含有鱼类、鸟类和哺乳类的食物网中, 寄生虫在营养级处于中间位置的宿主中聚集最多, 因为这些宿主既是捕食者又是被捕食者[24]。George- Nascimento[3]提出寄生虫物种丰富度最高一定出现在中间营养级的宿主体内, 因为它们既可以是成虫的宿主, 又可以是幼虫的宿主, 而且成虫所占比例会随着宿主营养级升高而升高。而具有复杂生活史的寄生虫, 在感染阶段可能寄生于第一中间宿主或第二中间宿主, 但最后通过捕食作用到达终末宿主体内, 完成其进一步发育[24]。因此, 体内寄生虫通过捕食者与被捕食者相互作用在食物网顶位种中得到最大聚集。在鱼类食物网中, 鳜作为营养级最高的鱼类[17], 同时又是顶位种, 在本调查的三个湖泊中都表现出较高的物种丰富度。
消化道寄生蠕虫的群落多样性同样与宿主在鱼类食物网中的营养位置密切相关, 即营养水平高的宿主, 其体内寄生虫群落的多样性更高。在本调查中, 鳜体内蠕虫的Brillouin多样性指数(> 0.12)高于生活在淡水环境中的杂食性欧洲鳗鲡(< 0.09)[18, 25, 26]和虹鳟(= 0.085)[19]。但在Li等[8]2004年的调查中, 梁子湖、洞庭湖、鄱阳湖中黄颡鱼消化道寄生蠕虫的Brillouin多样性指数分别为0.44、0.12和0.45, 高于本研究中鳜的, 这可能与湖泊环境变化有关。水体理化因子和生物组成的改变会影响寄生虫的群落结构[27], 一个健康的生态系统具有较高的寄生虫物种丰富度和多样性[28]。近年来, 湖泊水体污染和富营养化加重[29], 水生植被覆盖率大幅度下降[30], 因此, 湖泊水体环境的恶化和生物群落组成下降可能是导致鳜体内寄生虫多样性降低的重要原因。
[1] Dogiel V A, Petrushevski G K, Polyanski Y I. Parasitology of Fishes [M]. Edinburgh & London: Oliver & Boyd Press, 1961, 384
[2] Knudsen R, Amundsen P A, Klemetsen A. Inter-and intra-morph patterns in helminth communities of sympatric whitefish morphs [J]., 2003, 62(4): 847—859
[3] George-Nascimento M. Ecological helminthology of wild life animal hosts from south America: a literature review and search for patterns in marine food webs [J]., 1987, 60: 181—202
[4] Choudhury A, Dick T A. Richness and diversity of helminth communities in tropical freshwater fishes: empirical evidence [J]., 2000, 27(4): 935—956
[5] Leóan G, Garcíaa‐Prieto L, Leóan‐Réggagnon V,. Helminth communities of native and introduced fishes in Lake Pátzcuaro, Michoacán, México [J]., 2000, 57(2): 303—325
[6] Chen Q L. An Illustrated Guide to the Fish Disease and Causative Pathogenic Fauna and Flora in the Hupei Province [M]. Beijing: Science Press. 1973 [陈启鎏. 湖北省鱼病病原区系图志.北京: 科学出版社. 1973]
[7] Nie P, Yao W J, Gao Q,. Diversity of intestinal helminth communities of carp from six lakes in the flood plain of the Yangtze River, China [J]., 1999, 54(1): 171—180
[8] Li W X, Nie P, Wang G T,. Communities of gastrointestinal helminths of fish in historically connected habitats: habitat fragmentation effect in a carnivorous catfishfrom seven lakes in flood plain of the Yangtze River, China [J]., 2009, 2(1): 22
[9] Chen Y Y, Xu Y K. Hydrobiology and Resources Exploitation in Honghu Lake [M]. Beijing: Science Press. 1995 [陈宜瑜, 许蕴开.洪湖水生生物及其资源开发.北京: 科学出版社. 1995]
[10] Wang S M, Dou H S. Lakes in China [M]. Beijing: Science Press. 1998 [王苏民, 窦鸿身.中国湖泊志.北京: 科学出版社. 1998]
[11] Chiang I K. On the biology of mandarin fish,of Liang-Tze Lake [J]., 1959, 3: 375—385 [蒋一珪.梁子湖鳜鱼的生物学.水生生物学报, 1959, 3: 375—385]
[12] Li D, Yang C, Xu G L,. Biology of Mandarin Fish (Basilesky) in Poyang Lake [J]., 1998, 10(4): 14—22 [李达, 杨春, 徐广龙, 等.鄱阳湖鳜鱼的生物学.江西农业学报, 1998, 10(4): 14—22]
[13] Zhang T L. Life-history strategies, trophic patterns and community structure in the fishes of Lake Biandantang [D]. Wuhan: Chinese Academy of Sciences, Institute of Hydrobiology. 2005 [张堂林. 扁担塘鱼类生活史策略, 营养特征及群落结构研究.武汉: 中国科学院水生生物研究所. 2005]
[14] Magurran A E. Ecological Diversity and Its Measurement [M]. Princeton: Princeton University Press. 1988, 66—86
[15] Bush A O, Lafferty K D, Lotz J M,. Parasitology meets ecology on its own terms: Margolis et al. revisited [J]., 1997, 575—583
[16] Hurlbert S H. The measurement of niche overlap and some relatives [J]., 1978, 59(1): 67—77
[17] Zhang H, Wu G, Zhang P,. Trophic fingerprint of fish communities in subtropical floodplain lakes [J]., 2013, 22(2): 246—256
[18] Sures B, Knopf K, Würtz J,. Richness and diversity of parasite communities in European eelsof the River Rhine, Germany, with special reference to helminth parasites [J]., 1999, 119(3): 323—330
[19] Molloy S, Holland C, Poole R. Metazoan parasite community structure in brown trout from two lakes in western Ireland [J]., 1995, 69(3): 237—242
[20] Bu S H, Seng L T. Fish parasite communities in tropical reservoirs along the Perak River, Malaysia [J]., 1997, 356(1—3): 175—181
[21] Zhang J Y. Parasites and Parasitic Diseases of Fishes [M]. Beijing: Science Press. 1999 [张剑英. 鱼类寄生虫与寄生虫病. 北京: 科学出版社. 1999]
[22] Li W X, Wang G T, Wu S G,. Population dynamics and frequency distribution of the nematodeand trematodein yellow-head catfishin Liangzi Lake of Hubei Province, China [J]., 2008, 32(2): 195—200 [李文祥, 王桂堂, 吴山功, 等. 黄颡鱼河鲈源吸虫和黄颡前驼形线虫的季节动态和频率分布.水生生物学报, 2008, 32(2): 195—200]
[23] Wang G T, Wang W J. The life cycle of[J]., 2000, 24(6): 644—647 [王桂堂, 王伟俊.范尼道佛吸虫的生活史研究. 水生生物学报, 2000, 24(6): 644—647]
[24] Marcogliese D J, Cone D K. Food webs: a plea for parasites [J]., 1997, 12(8): 320—325
[25] Kennedy C R. The dynamics of intestinal helminth communities in eelsin a small stream: long-term changes in richness and structure [J]., 1993, 107(1): 71—78
[26] Kristmundsson Á, Helgason S. Parasite communities of eclsin freshwater and marine habitats in Iceland in comparison with other parasite communities of eels in Europe [J]., 2007, 54(2): 141—153
[27] Landsberg J H, Blakesley B A, Reese R O,. Parasites of fish as indicators of environmental stress [J]., 1998, 51(1—2): 211—232
[28] Hudson P J, Dobson A P, Lafferty K D. Is a healthy ecosystem one that is rich in parasites [J]?, 2006, 21(7): 381—385
[29] Xie Y H, Wang K L, Ren B,. Evolution, problems and protection measures of ecological environments in Dongting Lake area [J]., 2008, 28(6): 677—681 [谢永宏, 王克林, 任勃, 等. 洞庭湖生态环境的演变, 问题及保护措施.农业现代化研究, 2008, 28(6): 677—681]
[30] Jian Y X, Wang J B. A comparative study on aquatic plant diversity and its long-term changes in the three lakes of Dongtinghu district in China [J]., 2002, 26(2): 160—167 [简永兴, 王建波. 洞庭湖区三个湖泊水生植物多样性的比较研究.水生生物学报, 2002, 26(2): 160—167]
COMPOSITION AND DIVERSITY OF HELMINTH COMMUNITIES IN ALIMENTARY TRACTS OF THE MANDARIN FISHFROM THREE LAKES IN THE FLOODPLAIN OF THE YANGTZE RIVER IN CHINA
LU Ming-Miao1, 2, LI Wen-Xiang1, WANG Wei-Wei1, 2, MA Xing-Rong1, 2, WU Shan-Gong1, ZOU Hong1and WANG Gui-Tang1
(1. The Key Laboratory of Aquatic Biodiversity and Conservation of Chinese Academy of Sciences,Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences,Beijing 100049,China)
To study the effects of the trophic position of fish in food web on the structure and to examine the composition, richness, diversity in infracommunities of helminth communities in the alimentary tracts, the mandarin fishwere collected from three lakes in the flood plain of the Yangtze River, China. Eleven species of helminths were recorded from the three localities. The dominant species of communities in these three lakes was the trematode. 65 percent of individuals were infected with 1 or 2 parasite species, and the highest infection rate of parasite species was 6. Mean species richness and the Brillouin’s index in the three lakes were 1.53—2.13 and 0.12—0.33, respectively, with the highest Brillouin’s index in the Poyang Lake. The values of percentage similarity index and Jaccard’s similarity index between the Liangzi and Dongting lakes were the highest. Compared with the fish in different positions in food web, the richness and diversity of helminth infracommunities in alimentary tracts, the predatory mandarin fishwere dramatically higher than those of the herbivores and omnivores. In addition, the effects of feeding habit on the structure of parasites communities were discussed.
; Parasite; Community; Diversity
10.7541/2015.40
Q145+.2
A
1000-3207(2015)02-0301-06
2014-03-28;
2014-06-28
国家自然科学基金面上项目(31172409); 现代农业产业技术体系建设专项资金(CARS-46-08)资助
卢明淼(1987—), 女, 北京人; 硕士研究生; 主要从事寄生虫学研究。E-mail: lumingmiao@126.com
王桂堂, E-mail: gtwang@ihb.ac.cn
猜你喜欢
杂志排行
水生生物学报的其它文章
- 达氏鲟生长激素基因cDNA克隆、表达及免疫荧光定位研究
- 杂交鲟对六种蛋白原料的表观消化率
- SUPPRESSION OF LIGASE4 OR XRCC6 ACTIVITIES ENHANCES THE DNA HOMOLOGOUS RECOMBINATION EFFICIENCY IN ZEBRAFISH PRIMORDIAL GERM CELLS
- 大兴安岭硅藻的中国新记录属、种
- 鲢快速逃逸游泳行为研究
- EFFECT OF FIBROUS ROOT OF COPTIS CHINENSIS FRANCH AND BERBERINE ON THE NON-SPECIFIC IMMUNITY AND RESISTANCE AGAINST AEROMONAS HYDROPHILAINFECTION IN GRASS CARP (CTENOPHARYNGODON IDELLA)
