光果甘草原生质体分离条件优化
2015-11-29王礼强杨瑞袁伯川刘春生刘颖
王礼强,杨瑞,袁伯川,刘春生,刘颖
北京中医药大学 中药学院,北京 100102
甘草是我国最常用的大宗药材之一,具有补脾益气、清热解毒、祛痰止咳、缓急止痛和调和诸药等作用[1]。根据《中华人民共和国药典》的规定[2],药材甘草有3 个基原,即乌拉尔甘草(Glycyrrhiza uralensisFisch)、光果甘草(G.glabraL.)和胀果甘草(G.inflataBat.)。目前,有关甘草的研究多集中于乌拉尔甘草,涉及功能基因克隆、异源表达、化学成分分析等诸多方面[3-6],对光果甘草的研究则相对较少。虽然乌拉尔甘草与光果甘草同为药材甘草的基原植物,其化学成分及相应的药理活性却具有较大的差异[7-8],因此对于光果甘草的研究也须提上日程。
目前野生甘草资源日趋匮乏,且存在药效成分不稳定及种子市场混乱等现象,因此栽培甘草已经成为主流商品。但栽培甘草普遍存在品质退化及甘草酸含量低等问题,难以达到我国药典和日本药典规定的合格标准。因此,通过现代生物技术对甘草进行遗传改良,提高栽培甘草的质量,对于甘草资源的可持续发展具有十分重要的意义。原生质体是遗传转化研究中十分理想的材料,一方面可以有目的地向原生质体中转入特定基因,改良植物的性状;另一方面,在原生质体再生植株的过程中较易发生无性系变异,对其进行人工理化诱导,则可选育出有利用价值的突变体植株[9];此外,通过原生质体融合还可以克服远缘杂交的不亲和障碍,获得有价值的杂种后代[10]。因此,甘草原生质体的分离可以为进一步的遗传转化及体细胞杂交奠定基础。目前,有关甘草原生质体分离的报道仅见乌拉尔甘草分离条件的相关研究[11],光果甘草尚未见同类报道。
我们以光果甘草为研究对象,从多个方面对其原生质体的分离进行探讨,并确定了最优分离条件,以期为光果甘草原生质体培养以及在此基础上的遗传转化研究提供大量优质的原生质体材料来源。
1 材料和方法
1.1 材料
生长7 d 的光果甘草无菌苗的叶片及胚轴部分由本实验制备。纤维素酶(Onozuka R-10)、果胶酶(Yakult Y-23)、离析酶(Yakult R-10)及KH2PO4、KNO3、MgSO4·7H2O、KI、无水CaCl2、CuSO4·5H2O、甘露醇等化学试剂(分析纯)购于北京拜尔迪生物技术有限公司;Olympus 普通复式光学显微镜;哈东联超净工作台;Anke TGL-16G 离心机;Eppendorf微量移液器。
1.2 不同酶液组合及供试材料对光果甘草原生质体分离的影响
用于原生质体分离的酶液组合见表1,各处理均用CPW-13%甘露醇溶液配制,经0.22 μm 微孔滤膜过滤除菌。
无菌条件下取生长7 d 的光果甘草无菌苗的子叶和胚轴,准确称取子叶及胚轴100 mg 至无菌1.5 mL 离心管中(各27 份,每种酶液组合3 个重复),按照10∶1 的比例加入表1 中各酶液,用Parafilm 封口;25℃黑暗恒温培养箱中静置酶解12 h,60 目细胞筛网过滤,用5 mL CPW-13%甘露醇溶液洗涤;将滤液收集于15 mL 离心管中,1200 r/min 离心10 min;弃上清,将沉淀用8 mL CPW-25%蔗糖溶液悬浮后,沿管壁缓慢在蔗糖层上加入2 mL CPW-13%甘露醇溶液,800 r/min 离心10 min;小心吸取界面上的原生质体悬浮液,置于另一离心管中,加入5 mL CPW-13%甘露醇溶液,1200 r/min 离心10 min;收集沉淀,溶于1 mL MS 液体培养基中;台盼蓝染色;用血球计数板分别计数死、活细胞;计算原生质体活力及产量。
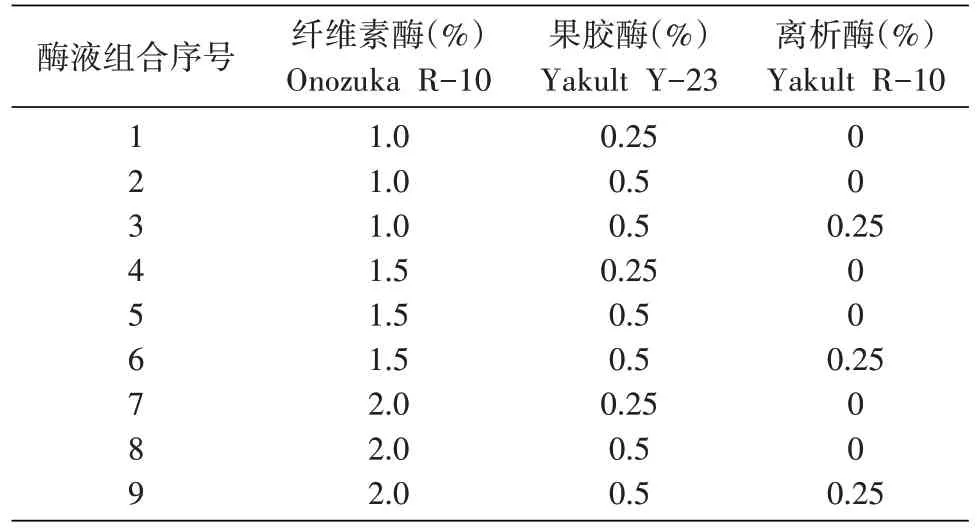
表1 光果甘草原生质体分离所用各酶液组合
1.3 不同酶解时间及酶解方式对光果甘草原生质体分离的影响
25℃条件下,采用表1中的5号酶液,对生长7 d的光果甘草无菌苗的子叶进行酶解,设置6、8、10、12、14、16 h 共6 种酶解时间,静置酶解及40 r/min振动2种酶解方式,各处理分别进行3个重复。其他实验步骤同1.2。
1.4 不同低温预处理方法对光果甘草原生质体分离的影响
25℃条件下,采用表1中的5号酶液,对生长7 d的光果甘草无菌苗的子叶进行酶解,设置5 种低温预处理条件,即4℃预培养4、8、12、18、24 h,以未进行低温预处理的甘草外植体作为对照组,每处理各进行3个重复,静置条件下酶解14 h,其他实验步骤同1.2。
1.5 不同渗透压对光果甘草原生质体分离的影响
以生长7 d 的光果甘草无菌苗的子叶作为实验材料,设置6 种渗透压条件,即甘露醇0.55、0.6、0.65、0.7、0.75、0.8 mol/L,分别用含有以上浓度甘露醇的CPW 溶液配制表1 中的5 号酶液,并作为实验用酶液,每种酶液各进行3 个重复,静置条件下酶解14 h,其他实验步骤同1.2。
1.6 光果甘草原生质体产量和活力的计算方法
采用台盼蓝染色方法鉴别原生质体的死活,死亡的原生质体着色,而生活的原生质体不着色。
原生质体活力=活的原生质体数/原生质体总数
原生质体密度(1 mL原生质体悬液中的原生质体个数)=4个大格中的原生质体数×104/4
因为本实验中每种不同的处理均称取了100 mg 实验材料,所以当以每鲜克重(gfw)的原生质体数目为单位表示原生质体产量时,计算方法如下:
原生质体产量(个/gfw)=原生质体密度×10
2 结果与讨论
2.1 不同酶液组合及供试材料对光果甘草原生质体分离的影响
如表2 所示,就原生质体产量而言,以子叶作为实验材料要显著高于以胚轴作为实验材料,其倍数从几倍至十几倍不等,因此子叶是分离光果甘草原生质体的最佳实验材料。就分离效果而言,3、5 及8号酶液的分离效果均较好,但3 号酶液原生质体活力仅为56.32%,8 号酶液原生质体产量仅为11.98×105个/gfw。综合考虑原生质体产量和活力两个方面的因素,确定了5 号酶液,即1.5%纤维素酶+0.5%果胶酶的组合为最佳酶液组合。
2.2 不同酶解时间及酶解方式对光果甘草原生质体分离的影响
如表3 所示,在静置条件下,原生质体产量随着酶解时间的延长呈先上升后下降的趋势,以6 h 酶解所获得的原生质体最少,为2.06×105个/gfw,14 h酶解所获得的原生质体达到顶峰,为30.77×105个/gfw,而酶解时间继续延长到16 h,原生质体产量则略有下降,为23.98×105个/gfw。就原生质体活力而言,除6 h样本外,也呈现出先升后降的趋势,以8 h酶解活力最低,为54.0%,14 h 时活力最高,为66.9%,继续延长酶解时间至16 h,原生质体活力会显著下降至只有38.9%,这也证明了太长的酶解时间可能会导致原生质体的破坏,从而降低其活力。
采用40 r/min 缓慢振荡的酶解方式,原生质体产量随着酶解时间的延长逐渐上升,当酶解时间为12 h时达到最高值,即45.10×105个/gfw,但当酶解时间继续延长时,原生质体产量不再升高,反而开始下降。就原生质体活力而言,除酶解6 h 之外,在其他酶解时间,原生质体活力均较为接近,但均较静置酶解方式原生质体活力低,仅为静置酶解原生质体活力的约2/3。
因此,综合考虑原生质体活力及产量两个方面的因素,认为静置酶解14 h的方式较为适宜。
2.3 不同低温预处理方法对光果甘草原生质体分离的影响
如表4 所示,随着4℃预培养时间的延长,光果甘草原生质体活力及产量均呈现先升后降的趋势,到12 h 时达到最高值,但继续延长低温预培养的时间,原生质体的活力和产量不再上升,反而开始下降,24 h 时活力已不足50%。而未进行低温预培养时,原生质体活力较低温预培养8、12 h 时的活力低,但在产量方面,未低温预培养实验组的原生质体产量较高,仅低于4℃预培养12 h 实验组。综上,4℃预培养12 h 有利于提高光果甘草原生质体的活力和产量。
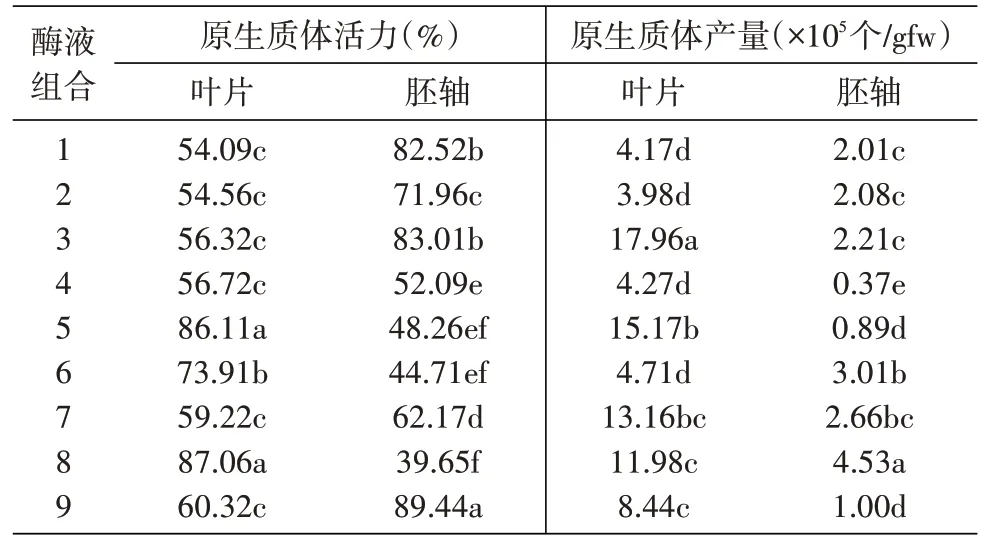
表2 酶液成分及供试材料对光果甘草原生质体分离效果的影响
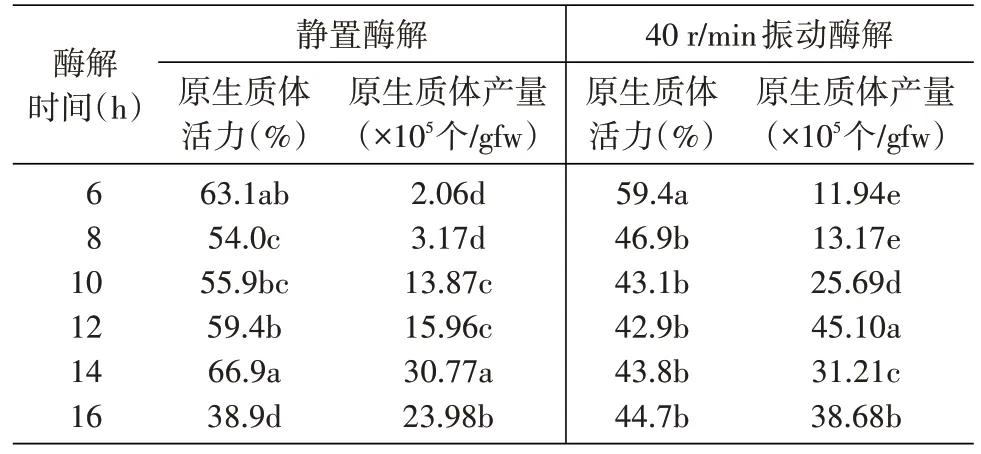
表3 不同酶解时间及酶解方式对光果甘草原生质体分离的影响
2.4 不同渗透压对光果甘草原生质体分离的影响
如表5 所示,随着甘露醇浓度的升高,光果甘草原生质体的活力呈现先上升后下降的趋势,当甘露醇浓度为0.7 mol/L 时达到最大值,即63.7%,此后,甘露醇浓度继续升高,光果甘草原生质体的活力开始下降。就原生质体产量而言,随着甘露醇浓度的升高,也基本呈现先升后降的趋势,产量最高值也出现在甘露醇浓度为0.7 mol/L 时,为28.37×105个/gfw。综上,在对光果甘草进行原生质体分离时,最佳甘露醇使用浓度为0.7 mol/L,太低及太高的甘露醇浓度均难以达到良好的渗透稳定作用。
2.5 小结
我们从材料来源、酶液组成、酶解方式、酶解时间、渗透压、预处理方式等6 个方面对光果甘草原生质体的分离进行了研究,并确定了最优化的分离条件,即:以生长7 d 的光果甘草无菌苗的叶片作为分离原生质体的外植体材料,在4℃条件下于MS 基本培养基上预培养12 h,以1.5%纤维素酶+0.5%果胶酶作为分离原生质体所用酶液,以含0.7 mol/L 甘露醇作为渗透保护剂的CPW 溶液配制酶液,25℃条件下静置酶解14 h。以此条件获得的光果甘草原生质体完整、透明,质量良好。本实验结果将为光果甘草原生质体融合及遗传转化奠定良好的基础。
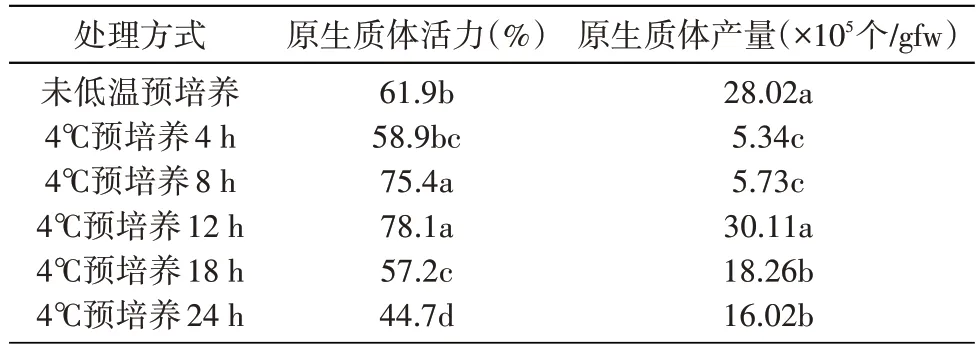
表4 低温预处理对甘草原生质体分离的影响
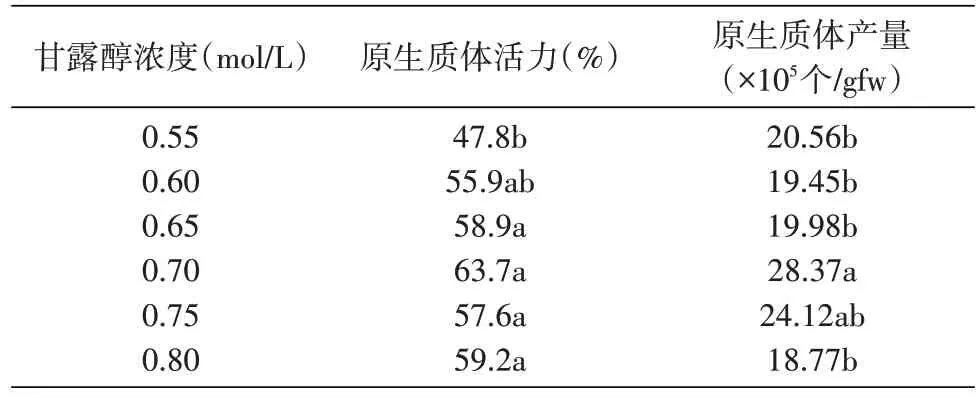
表5 不同渗透压对甘草原生质体分离的影响
[1]曾路,李胜华,楼之岑.国产甘草的生药形态组织学研究[J].药学学报,1988,23(3):200-208.
[2]中华人民共和国药典I部[M].北京:化工出版社,2010:80-81.
[3]荣齐仙,许巧仙,刘春生,等.乌拉尔甘草HMGR 基因cDNA 的克隆与序列分析[J].中国中药杂志,2011,36(10):1275-1279.
[4]Liu Y,Xu Q X,Xi P Y,et al.Cloning and characterization of a cDNA coding 3-hydroxy-3-methylglutary CoA reductase involved in glycyrrhizic acid biosynthesis in Glycyrrhiza uralensis[J].药学学报,2013,48(5):773-779.
[5]刘颖,徐巧仙,王学勇,等.甘草3-羟基-3-甲基戊二酰辅酶A还原酶基因多态性对其编码酶催化效率的影响[J].中国中药杂志,2012,37(24):3784-3788.
[6]牛小宇,刘春生.栽培甘草群体中不同单株甘草酸的含量差异研究[J].时珍国医国药,2009,20(9):2121-2122.
[7]向诚,乔雪,叶敏,等.利用数据库对甘草属植物化学成分的分类和分布分析[J].药学学报,2012,47(8):1023-1030.
[8]罗祖良,李倩,覃洁萍,等.光果甘草的研究进展[J].中草药,2011,42(10):2154-2158.
[9]张学英,葛会波,刘艳萌,等.草莓原生质体分离条件的研究[J].分子植物育种,2006,4(6S):147-152.
[10]周国海,陈雪香,雷勇,等.虎杖原生质体分离纯化及电融合初步研究[J].西北植物学报,2008,28(6):1145-1149.
[11]刘昕,余斌,陈晓燕,等.提高甘草原生质体游离产量及分裂频率的研究[J].草地学报,2011,19(2):294-298.
