人自噬相关基因5真核表达载体的构建及表达鉴定
2015-11-29纪贝贝赵晖徐小洁梁迎春黄蓉范忠义李玲郭靖洪甜冀全博叶棋浓杜楠
纪贝贝 ,赵晖,徐小洁,梁迎春,黄蓉,范忠义,李玲,郭靖,洪甜,冀全博,叶棋浓,杜楠
1.解放军总医院 第一附属医院,北京 100048;2.军事医学科学院 生物工程研究所,北京 100850
自噬是指胞浆内大分子物质和细胞器在膜包囊泡中大量降解的生物学过程,具有维持细胞自我稳态、促进细胞生存的作用,然而过度自噬则可引起细胞死亡,即“自噬性细胞死亡”,也称为Ⅱ型程序化细胞死亡[1]。迄今,已有31 个自噬相关基因(autophagy related gene,ATG)相继被发现[2],其中的自噬相关基因5(autophagy related gene 5,ATG5)是形成自噬体的重要基因[3]。自噬体的形成主要通过2 个泛素样连接系统介导,即ATG12-ATG5 和ATG8-PE,同时它们之间也互相影响[4],ATG5通过酶促级联,这一过程需要E1(ATG7)E2(ATG10)酶催化形成ATG5 和ATG12 结合复合物,而这一复合物对自噬的形成具有重要调控作用[5]。
有研究表明,敲除ATG5 基因后可明显抑制自噬的形成[6-7],由此可见ATG5 在自噬的形成及发生发展中起重要作用。本实验拟构建ATG5 的真核表达载体,并验证其与Myc-ATG12 的相互作用,为进一步探讨ATG5与自噬的关系奠定基础。
1 材料和方法
1.1 材料
人胚肾293T 细胞由本室传代培养;pcDNA3-Flag载体为本实验室保存;VigoFect为威格拉斯生物技术有限公司产品;限制性内切酶、DNA 连接酶、PCR 试剂均购自TaKaRa 公司;上、下游引物由北京赛百盛生物技术有限公司合成;质粒提取、胶回收、PCR 回收试剂盒购自Promega 公司;HRP 标记的抗Flag 标签鼠单克隆抗体(Flag-HRP)购自Sigma 公司;DMEM 及小牛血清均购自Gibco 公司;测序由北京奥科生物技术有限责任公司完成。
1.2 Flag-ATG5重组质粒的构建与测序
以人乳腺文库为模板,根据文献报道[8]的ATG5的编码序列合成上游引物(5'-CGGGATCCATGAC AGATGACAAAGATGTGC-3')和下游引物(5'-CCG CTCGAGTCAATCTGTTGGCTGTGGGATG-3'),PCR扩增人ATG5的编码序列(95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸1 min,30 个循环;72℃延长7 min),用胶回收试剂盒回收PCR产物。
将PCR 片段回收后用BamHⅠ/XhoⅠ双酶切,形成带有粘端的双链,用T4DNA连接酶与经同样双酶切的pcDNA3-Flag 载体连接,转化大肠杆菌DH5α,挑选克隆,振荡培养并提质粒,用BamHⅠ/XhoⅠ双酶切鉴定,酶切鉴定正确的克隆送北京奥科生物公司测序。
1.3 哺乳动物细胞转染和Western印迹检测
按常规方法进行转染。用不含双抗、含100 mL/L 胎牛血清的DMEM 培养基将人胚肾293T 细胞接种于6 cm 皿中,接种量以转染时细胞密度达到80%为宜,培养24 h 后进行转染,转染前1 h 换液。将4 μL VigoFect与200 μL NaCl混合,再将总量为10 μg 的重组质粒与200 μL NaCl 混合,然后将上述2 种溶液轻轻混合,室温放置15 min,加入6 cm皿中(以同样方法转染空pcDNA3-Flag 载体作为对照),37℃、50 mL/L CO2常规培养,4~6 h 换液,转染24 h 后收集细胞蛋白,加入2×SDS 加样缓冲液煮沸10 min,高速离心2 min,取上清液行SDS-PAGE后,电转移至硝酸纤维素膜上,用5%脱脂奶粉于4℃封闭过夜,加入用5%脱脂奶粉以1∶5000 稀释的用HRP 标记的抗Flag 标签鼠单克隆抗体,室温轻摇1 h,TBST 洗膜3 次,每次5 min,化学发光法显色5 min,压片显影。
1.4 细胞免疫共沉淀分析ATG5和ATG12的相互作用
将人胚肾293T 细胞接种于6 cm 皿中,用重组Flag-ATG5 与Myc-ATG12 共转染细胞,转染后4~6 h换液,常规培养24 h后收集细胞,加入IP裂解缓冲液[0.02 mol/L Tris(pH8.0),0.05 mol/L NaCl,0.005 mol/L NP-40,0.01 mol/L EDTA)]后与Flag-Beads在4℃结合4~6 h,3000 r/min离心5 min,经IP缓冲液再次漂洗后,加入与Flag-Beads 等量的2×SDS 加样缓冲液,煮沸10 min,12 000 r/min 离心2 min,取上清液行SDS-PAGE 后,电转移至硝酸纤维素膜上,用5%脱脂奶粉于4℃封闭1 h,加入用5%脱脂奶粉以1∶5000 稀释的用HRP 标记的抗Flag 标签鼠单克隆抗体,室温轻摇1 h,TBST 洗膜3 次,每次5 min,化学发光法显色,5 min后压片显影。
2 结果
2.1 Flag-ATG5重组质粒的构建与鉴定
以实验室保存的人乳腺文库为模板,PCR 扩增人ATG5 的编码序列,获得约820 bp 的DNA 片段,与预期片段一致(图1A);将PCR 产物用BamHⅠ/XhoⅠ双酶切后与经同样双酶切的pcDNA3-Flag 载体连接,转化大肠杆菌DH5α,挑选克隆,经菌液PCR鉴定得到阳性重组克隆;将所得阳性克隆提质粒,经酶切鉴定,可切出2 条长度分别约为5000 和820 bp的条带,而相应的空载体酶切只见大片段,符合预期结果(图1B);测序结果表明,插入片段的DNA 序列与人ATG5基因的编码序列完全一致(数据略)。
2.2 Western 印迹检测Flag-ATG5 在293T 细胞中的表达
将构建的Flag-ATG5重组质粒和空载体分别转染293T 细胞系,24 h 后提取蛋白进行SDS-PAGE,Western 印迹检测Flag-ATG5 蛋白的表达。结果显示,转染重组质粒后,用Flag-HRP 抗体能够在相对分子质量约33×103处检测到明显的特异性条带,空载体无条带(图2)。说明Flag-ATG5 重组蛋白在293T细胞中能够正确表达。
2.3 免疫共沉淀分析重组ATG5与ATG12在蛋白水平上的相互作用
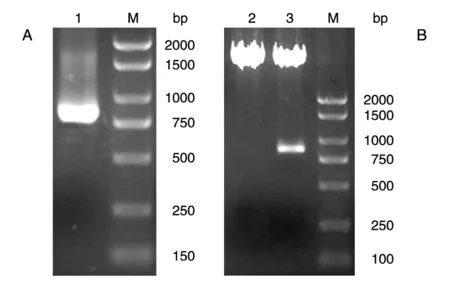
图1 PCR扩增人ATG5的编码序列(A)及重组质粒Flag-ATG5的BamHⅠ/XhoⅠ双酶切电泳图谱(B)
根据文献报道,ATG5 可与ATG12 相互作用。为进一步证实所构建的Flag-ATG5 重组质粒正确,且能够表达正确的融合蛋白,我们将重组Flag-ATG5 质粒与Myc-ATG12 质粒共转染293T 细胞,24 h 常规培养后收集蛋白,免疫共沉淀分析显示Flag-ATG5 融合蛋白与Myc-ATG12 蛋白具有相互作用,而Flag 空载体在同一位置无此条带,表明ATG5 与ATG12 蛋白能够在体内特异地相互作用,而Flag 标签不影响ATG5 的结构及其生物学功能(图3)。进一步证明构建的重组Flag-ATG5 质粒正确,且能够正常表达。

图2 Western印迹检测Flag-ATG5的表达
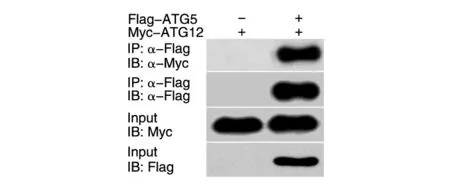
图3 免疫共沉淀分析验证重组ATG5与ATG12在蛋白水平上具有相互作用
3 讨论
自噬是真核生物所特有的生命现象,是细胞通过溶酶体降解细胞内受损的细胞器及大分子物质,并以此保持细胞代谢的平衡和细胞内环境的稳定。这一过程可以促进细胞生长、增殖,自噬的整个过程受自噬相关基因的调控[9]。细胞自噬既能在细胞应对不良环境刺激时作为一种防御机制实现自我保护,同时在肿瘤、神经退行性疾病、病原体感染、衰老等多种疾病的发生过程中起到重要作用[10]。近年来的相关研究发现自噬与肿瘤存在密切关联,针对二者关系的研究已受到肿瘤学者的广泛关注[11]。
细胞自噬大致分为3 个阶段[12-13]:第一阶段为起始阶段(细胞接受刺激信号);第二阶段为自噬体形成(ATG12-ATG5 和ATG8-PE 复合体2 种泛素样结合系统);第三阶段为自噬溶酶体的形成及内容物的降解,而自噬体膜脱落再循环利用。由此可知,ATG5在自噬体的形成中占有重要地位,同时研究发现ATG5 作为细胞自噬和凋亡的转换开关,在自噬的发生和发展中起重要的调控功能[14],在自噬泡形成的早期阶段有ATG12-ATG5-ATG16L复合物与其外膜结合[7,15],这种结合促进了自噬泡的伸展扩张,使之由开始的小囊泡发展为半环状结构。
Chen 等[16]发现,TECPR1 在ATG5-ATG12 复合体的形成中发挥重要作用,进而在很大程度上影响自噬体的形成。这也提示我们ATG5 在整个自噬过程中的重要作用。本实验构建的Flag-ATG5在真核细胞中获得了表达,表达的融合蛋白的功能得到初步验证。ATG5在真核细胞中的成功表达,是继续深入研究其在自噬中的作用机制,以及探讨其利用价值的基础。
[1]Mizushima N.Autophagy:process and function[J].Genes Dev,2007,21(22):2861-2873.
[2]Levine B,Yuan J.Autophagy in cell death:an innocent convict[J]? J Clin Invest,2005,115(10):2679-2688.
[3]Ravikumar B,Vacher C,Berger Z,et al.Inhibition of mTOR induces autophagy and reduces toxicity oF polyglutamine expansions in fly and mouse models of Huntington disease[J].Nat Genet,2004,36(6):585-595.
[4]Yang Y P,Liang Z Q,Gu Z L,et al.Molecular mechanism and regulation of autophagy[J].Acta Pharmacol Sin,2005,26(12):1421-1434.
[5]Hurley J H,Schulman B A.Atomistic autophagy:the structures of cellular selF-digestion[J].Cell,2014,157(2):300-311.
[6]Matsushita M,Suzuki N N,Obara K,et al.Structure of Atg5.Atg16,a complex essential for autophagy[J].J Biol Chem,2007,282(9):6763-6772.
[7]Williams R A,Smith T K,Cull B,et al.ATG5 is essential for ATG8-dependent autophagy and mitochondrial homeostasis in Leishmania major[J].PLoS Pathog,2012,8(5):e1002695.
[8]赵勇,栗文彬,师长宏,等.自噬相关基因Atg5 的原核表达及多克隆抗体制备[J].生物技术通讯,2009,20(4):482-484.
[9]Zou M,Lu N,Hu C,et al.Beclin 1-mediated autophagy in hepatocellular carcinoma cells:implication in anticancer efficiency of oroxylin A via inhibition of mTOR signaling[J].Cell Signal,2012,24(8):1722-1732.
[10]Mijaljica D,Prescott M,Devenish R J.Autophagy in disease[J].Methods Mol Biol,2010,648:79-92.
[11]Wirawan E,Vanden Berghe T,Lippens S,et al.Autophagy:for better or for worse[J].Cell Res,2012,22(1):43-61.
[12]Tooze S A.Current views on the source of the autophagosome membrane[J].Essays Biochem,2013,55:29-38.
[13]Hamacher-Brady A.Autophagy regulation and integration with cell signaling[J].Antioxid Redox Signal,2012,17(5):756-765.
[14]Yousefi S,Perozzo R,Schmid I,et al.Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis[J].Nat Cell Biol,2006,8(10):1124-1132.
[15]Noda N N,Fujioka Y,Hanada T,Structure of the Atg12-Atg5 conjugate reveals a platform for stimulating Atg8-PE conjugation[J].EMBO Rep,2013,14(2):206-211.
[16]Chen D,Fan W,Lu Y,et al.A mammalian autophagosome maturation mechanism mediated by TECPR1 and the Atg12-Atg5 conjugate[J].Mol Cell,2012,45(5):629-641.
