硒蛋白P基因多态性与结直肠癌遗传易感性的关联性分析
2015-11-28王晓春张峻烽呼如芯李宇菲李春波
张 龙,朱 燕,王晓春,张峻烽,呼如芯,李宇菲,李春波
(中南大学湘雅医学院医学检验系,湖南 长沙 410013)
硒蛋白P(selenoprotein P,Sepp1)为硒蛋白家族主要的成员,为双功能蛋白,主要由肝脏合成后分泌到外周血中,进而运输硒到肝外组织供其利用,用以合成其他硒蛋白;同时Sepp1还具有抗氧化酶的活性,与其他抗氧化酶一起构成机体氧化防御屏障,在保护机体免受氧化损伤、维持结构蛋白和基因组DNA的稳定方面起重要作用。rs7579位于Sepp13′UTR,该位点的基因变异可以影响Sepp1合成过程中硒代半胱氨酸的插入进而影响Sepp1的合成及其在血中的存在形式,进而影响其功能的发挥,而国内外研究[1-5]显示:Sepp1基因多态性与乳腺癌和前列腺癌等多种恶性肿瘤发生有密切关联,基于Sepp1基因的功能及其在恶性肿瘤中的异常表达模式,本文作者推测Sepp1基因的遗传变异与肿瘤易感性有关联。国内未见相关研究报道,本课题组就Sepp1基因rs7579位点单核苷酸多态性 (SNPs)在结直肠癌患者和健康人群中分布情况进行研究,探讨其对结直肠癌的患病风险的影响。
1 资料与方法
1.1 一般资料 采用病例对照研究。结直肠癌组为2013年9月—2014年7月在本院附属肿瘤医院住院的结直肠癌患者,共130例,结直肠癌组纳入标准:来自湖南省,中国南方汉族人,年龄25~85岁,病理组织学确诊为结直肠癌的新发患者,病理类型为腺癌。其中高分化腺癌74例,中分化腺癌46例,低分化腺癌10例;肿瘤位于近侧大肠(盲肠、升结肠和横结肠)39例,位于远侧大肠(降结肠、乙状结肠及直肠)91例;男性85例,女性45例;平均年龄 (56.2±10.6)岁。排除标准:并发其他胃肠道遗传病史,有放化疗史,受试者有血缘关系。健康组共153名,系中南大学湘雅三医院同期门诊健康体检者,其中男性85名,女性59名,平均年龄 (50.1±14.0)岁。健康组纳入标准:经结肠镜检查无结直肠息肉,无溃疡性结肠炎,无肿瘤史,常规体检结果均正常。排除标准:受试者有血缘关系,非湖南省汉族人,年龄小于25岁或大于85岁。本研究经受试者知情同意,研究方案经本院伦理委员会审查并认可。
1.2 主要试剂和仪器 血液基因组DNA提取试剂盒 (美国OMEGA生物技术有限责任公司),5×TBE (pH 8.3) (上海生工生物工程有限公司),100bp DNA MarkerⅠ和2×Taq PCR Master Mix(北京天根生化科技有限公司)。DYY-Ⅲ5稳压温流电泳仪 (北京六一仪器厂),Eppendorf Mastercycler个人型PCR仪 (德国Eppendorf公司),UV-160分光光度计 (日本岛津制作所),Universal HoodⅡ凝胶成像分析系统(美国Bio-Rad公司)。
1.3 基因组DNA提取 清晨抽取空腹静脉血2mL,EDTA抗凝,采用试剂盒抽提外周血基因组DNA,UV-160分光光度计测定DNA纯度和浓度,波长设定为260和280nm,-20℃保存备用。
1.4 引物设计和合成 在Pubmed-SNP数据库中查询Sepp1基因rs7579位点两侧的基因序列(Z11793),应用软件Primer premier 5.0设计引物(表1),特异性内引物F1和R1分别在3′端倒数第3位引入1个人为的错配碱基 (引物中划线部分)可增加分型的特异性,F1和R2组合检测G等位基因,其PCR产物大小为212bp。F2和R1组合检测A等位基因,其PCR产物大小为183bp,外引物F2和R2组合扩增出长度为338bp的PCR产物,作为阳性对照。引物由上海生工生物工程有限公司合成。

表1 rs7579位点的引物信息Tab.1 Primer information of rs7579site
1.5 四引物扩增阻碍突变体系聚合酶链反应(tetra-primer ARMS-PCR) PCR 反 应 体 系 为25μL,其中2×Taq PCR Master Mix 12.5μL,DNA 模板2μL (约 100ng),F2和 R2(10μmol·L-1)各0.4μL,F1和R1(10μmol·L-1)各0.8μL。灭菌双蒸水8.1μL。PCR反应条件:95℃预变性5min;94℃变性30s,59℃退火30s,72℃延伸30s,共35个循环;最后72℃延伸5min。PCR产物行2.5%琼脂糖凝胶电泳,在Universal HoodⅡ凝胶成像分析系统中判读并拍照记录。随机选取40个标本进行PCR扩增后将产物送上海生工生物工程有限公司测序,所用引物为表1中的F2和R2,PCR反应体系为50μL,其中2×Taq PCR Master Mix 25μL,DNA模板4μL,F2(10μmol · L-1) 0.8μL, R2(10μmol·L-1)0.8μL,灭菌双蒸水19.4μL;PCR反应条件同tetra-primer ARMS-PCR的反应条件。
1.6 统计学分析 采用SPSS 18.0统计软件进行数据分析。采用χ2检验分析研究对象的Sepp1基因rs7579位点的基因型和等位基因分布情况是否符合Hardy-Weinberg平衡,各组研究对象基因型频数和等位基因频数分布的差异比较采用χ2检验,采用Logistic回归分析计算基因型与结直肠癌危险性的优势比 (OR)及其95%可信区间 (95%CI)。
2 结 果
2.1 Sepp1基因rs7579位点多态性 PCR扩增产物中阳性对照片段长度为338bp,G等位基因特异性片段为212bp,A等位基因特异性片段为183bp;即GG基因型PCR扩增产物大小为338和212bp,AA基因型PCR扩增产物大小为338和183bp,GA基因型PCR扩增产物大小为338、212和183bp。见图1。
2.2 序列法验证tetra-primer ARMS-PCR结果的准确性 测序结果显示:Sepp1基因rs7579位点有3种基因型,分别为GG、GA和AA,见图2,测序结果与tetra-primer ARMS-PCR结果完全一致。

图1 Sepp1基因rs7579位点tetra-primer ARMS-PCR电泳图Fig.1 Electrophoregram of tetra-primer ARMS-PCR of polymorphism of rs7579site at Sepp1gene
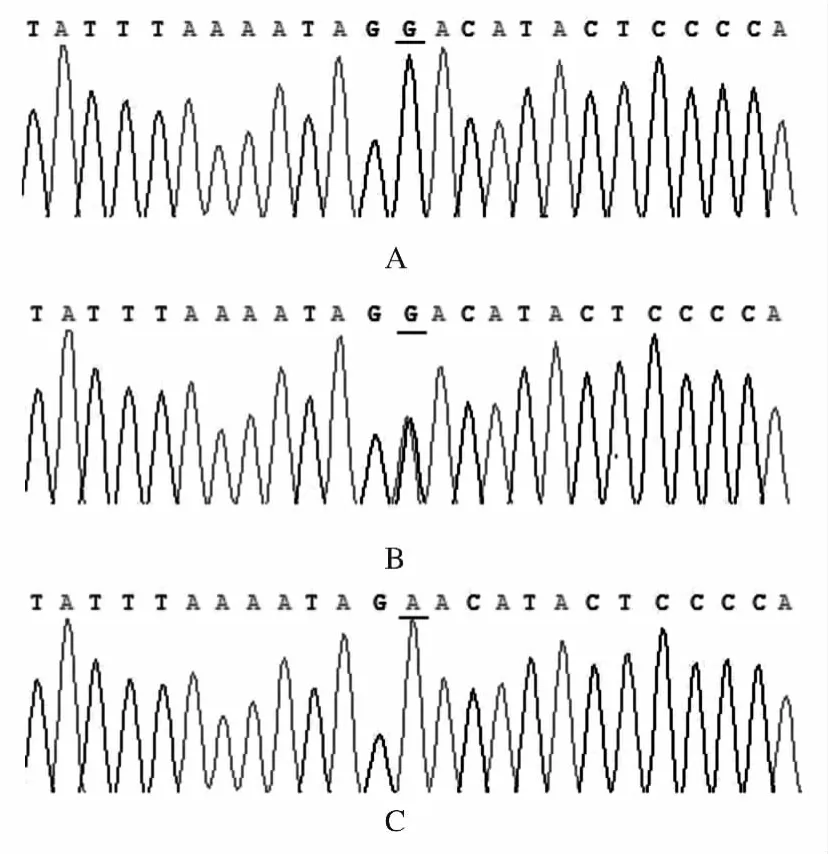
图2 Sepp1基因rs7579位点部分测序图Fig.2 Part of sequencing figure of rs7579site at Sepp1 gene
2.3 2组研究对象Sepp1基因rs7579位点基因型和等位基因频数分布 结直肠癌和健康对照组研究对象Sepp1基因rs7579位点多态性分布情况均符合Hardy-Weinberg平衡,所观察的样本具有群体代表性 (χ2=0.028,P>0.05)。经χ2检验及非条件Logistic回归分析:结直肠癌组患者和健康对照者的Sepp1基因rs7579位点GG、GA和AA基因型和G、A等位基因频数比较差异无统计学意义 (χ2=3.633,P >0.05;χ2=2.152,P >0.05)。提示Sepp1基因rs7579位点与结直肠癌发病无关联。见表2。

表2 健康对照组和结直肠癌组研究对象Sepp1基因rs7579位点基因型及等位基因频数分布Tab.2 Distribution of genotypic frequency and allelic frequency of rs7579site at Sepp1gene of objects in control group and case group [n(η/%)]
2.4 不同临床特征研究对象Sepp1基因rs7579位点基因型频数分布 根据临床资料将2组研究对象进行分层分析,在对年龄进行分组时,≥55岁组中,结直肠癌组和健康对照组研究对象的GG、GA和AA基因型频数比较差异有统计学意义(χ2=3.228,P=0.050),结直肠癌组患者 AA基因型频数明显低于健康对照组,即人群中AA基因型者患结直肠癌风险低于GA基因型者 (OR=0.566,P=0.050,95%CI:0.320~0.999),而在<55岁组、男性组、女性组、大肠近侧组、大肠远侧组、高分化腺癌组、中分化腺癌组、低分化腺癌组中,结直肠癌组和健康对照组研究对象GG、GA和AA基因型频数分布比较差异均无统计学意义 (χ2=1.154,P=0.684;χ2=2.787,P=0.261;χ2=1.084,P=0.464;χ2=4.171,P=0.083;χ2=1.766,P=0.544;χ2=2.790,P=0.281;χ2=0.273,P=0.747;χ2=7.629,P=0.119),提示Sepp1rs7579位点多态性对结直肠癌患病风险的影响与年龄有关联,但与性别、肿瘤部位和肿瘤分化程度无关联。见表3。

表3 不同临床特征研究对象Sepp1基因rs7579位点基因型频数分布Tab.3 Distribution of genotypic frequencies of rs7579site at Sepp1gene of objects with different characteristics
3 讨 论
Sepp1是硒蛋白家族中非常重要的成员之一,占血浆总含硒量的40%[6]。Sepp1含有2个结构域为双功能蛋白,由2个大小不同的片段构成,大片段为N端,含有244个氨基酸残基,仅含的1个Sec(硒代半胱氨酸)残基位于UxxC氧化还原模体中 (U为硒代半胱氨酸,x为任意氨基酸,C为半胱氨酸),具有抗氧化酶的活性;小片段为C端,含有122个氨基酸残基,从第245位残基到C-末端,含有9个硒代半胱氨酸残基,具有运送硒供外周组织利用的功能[7]。Sepp1由肝脏合成后分泌入血,进入外周组织C端片段分泌硒被组织细胞摄取,N端片段与细胞膜具有较强的亲和力,释放了硒的Sepp1结合到细胞膜上发挥抗氧化的作用[8];此外,Sepp1是机体硒储存库,对维持血浆含硒量稳定等方面具有重要作用[9]。总之,Sepp1在保护机体免受氧化损伤、运输硒到非肝脏组织、维持机体硒含量稳定等方面具有重要作用[8,10]。
本课题组发现:中国人群中,结直肠癌患者和健康对照者Sepp1基因rs7579位点GG、GA和AA基因型及G、A等位基因频数比较差异无统计学意义,Sepp1基因rs7579位点多态性与结直肠癌的患病风险无关联。根据临床资料将2组研究对象进行分层分析结果显示:年龄≥55岁组中,结直肠癌组和健康对照组研究对象GG、GA和AA基因型频数比较差异有统计学意义,结直肠癌组患者AA基因型频数明显低于健康对照组,即人群中AA基因型者患结直肠癌风险低于GA基因型者,A等位基因可能是55岁以上中国人群降低结直肠癌发病的保护性因素之一。rs7579位于Sepp13′UTR,该位点的基因变异可以影响Sepp1合成过程中硒代半胱氨酸的插入进而影响Sepp1的合成[11];人血浆中含有2种形式Sepp1,分别为50000和60000,60000形式Sepp1的硒水平比50000高,可以运输更多的硒供外周组织利用。而Meplan等[12]研究发现:rs7579多态性位点,AA基因型人群中60000形式Sepp1水平比GG基因型人群中60000形式Sepp1水平高。随着年龄不断增长,细胞代谢活性降低,机体运输硒的能力也会降低,rs7579多态性位点中,因AA基因型Sepp1含硒量高,其也许可以更好地满足机体对硒的需求,进而降低结直肠癌的患病风险。Sutherland等[13]研究发现:韩国人群中Sepp1基因rs7579位点多态性对结直肠癌的发病风险无影响,而Sutherland等并未对其进行亚层分析,故55岁以上韩国人群中未能确定Sepp1基因rs7579位点多态性对结直肠癌的发病风险产生的影响。
综上所述,Sepp1基因rs7579位点多态性对结直肠癌的影响在不同人群中具有不同的影响结果,人群研究结果的差异,反映出肿瘤遗传易感性研究的复杂性。此外,研究结果除了与样本的数量大小有关系,还与不同地区、种族和研究人群的遗传背景有关联,基因间相互作用及与环境危险因素的相互作用对肿瘤的患病风险亦有着较大的影响[14-15]。结直肠癌发生发展的每个步骤中涉及多个基因的改变,表现为多基因、多步骤的协同累积作用,同时突变基因型与环境危险因素之间有较强的交互作用,增加了结直肠癌的患病风险。结合本实验研究结果和国外研究动态可知:Sepp1基因rs7579位点多态性对结直肠癌遗传易感性的关联性尚需在不同种族人群中联合其他影响因素 (如饮食结构、有无烟酒史及肿瘤家族史等)进一步证实。
[1]Meplan C,Dragsted LO,Ravn-Haren G,et al.Association between polymorphisms in glutathione peroxidase and selenoprotein P genes,glutathione peroxidase activity,HRT use and breast cancer risk [J].PLoS One,2013,8 (9):e73316.
[2]Geybels MS,Hutter CM,Kwon EM,et al.Variation in selenoenzyme genes and prostate cancer risk and survival[J].Prostate,2013,73 (7):734-742.
[3]Geybels MS,van den Brandt PA,Schouten LJ,et al.Selenoprotein gene variants,toenail selenium levels,and risk for advanced prostate cancer[J].J Natl Cancer Inst,2014,106 (3):u3.
[4]张 龙,王晓春.硒蛋白家族基因变异与胃肠道肿瘤遗传易感性的关联性研究进展 [J].广东医学,2014,35 (7):1128-1131.
[5]张 龙,王晓春.硒蛋白P基因多态性研究进展 [J].生命科学研究,2014,18 (5):441-444.
[6]Krol MB,Gromadzinska J,Wasowicz W.SeP,ApoER2 and megalin as necessary factors to maintain Se homeostasis in mammals[J].J Trace Elem Med Biol,2012,26 (4):262-266.
[7]Saito Y,Sato N,Hirashima M,et al.Domain structure of bi-functional selenoprotein P [J]. Biochem J,2004,381 (Pt 3):841-846.
[8]Kurokawa S,Eriksson S,Rose KL,et al.Sepp1 (UF)forms are N-terminal selenoprotein P truncations that have peroxidase activity when coupled with thioredoxin reductase-1 [J].Free Radic Biol Med,2014,69:67-76.
[9]Hill KE,Zhou J, Mcmahan WJ,et al. Deletion of selenoprotein P alters distribution of selenium in the mouse [J].J Biol Chem,2003,278 (16):13640-13646.
[10]Shetty SP, Shah R, Copeland PR. Regulation of selenocysteine incorporation into the selenium transport protein,selenoprotein P [J]. J Biol Chem, 2014,289 (36):25317-25326.
[11]Meplan C, Crosley LK, Nicol F, et al. Genetic polymorphisms in the human selenoprotein P gene determine the response of selenoprotein markers to selenium supplementation in a gender-specific manner (the SELGEN study)[J].FASEB J,2007,21 (12):3063-3074.
[12]Meplan C,Nicol F,Burtle BT,et al.Relative abundance of selenoprotein P isoforms in human plasma depends on genotype,se intake,and cancer status [J].Antioxid Redox Signal,2009,11 (11):2631-2640.
[13]Sutherland A,Kim DH,Relton C,et al.Polymorphisms inthe selenoprotein S and 15-kDa selenoprotein genes are associated with altered susceptibility to colorectal cancer [J].Genes Nutr,2010,5 (3):215-223.
[14]张 龙,黄玉梅,李春波,等.硒蛋白S基因多态性与结直肠癌遗传易感性的相关性 [J].临床检验杂志,2014,32 (7):528-531.
[15]杨四宝,刘雪岩,李 冰,等.吉林汉族人群ERAP1基因3′UTR单核苷酸多态性与原发性高血压的关联性分析 [J].吉林大学学报:医学版,2015,41 (2):383-388.
