乙肝病毒X基因对肝癌Bel7402细胞ras基因表达的影响
2015-11-28朱明月张雪儿李孟森
鲁 琰 李 伟 朱明月 董 栩 陈 栘 张雪儿 李孟森,4
1.海南医学院海南省肿瘤发生和干预重点实验室,海南海口 571199;2.海南医学院分子生物学重点实验室,海南海口 571199;3.海南医学院13卓越创新班,海南海口 571199;4.海南医学院肿瘤研究所,海南海口 570102
乙肝病毒X基因对肝癌Bel7402细胞ras基因表达的影响
鲁 琰1,2李 伟1,2朱明月1,2董 栩1,2陈 栘1,2张雪儿3李孟森1,2,4
1.海南医学院海南省肿瘤发生和干预重点实验室,海南海口 571199;2.海南医学院分子生物学重点实验室,海南海口 571199;3.海南医学院13卓越创新班,海南海口 571199;4.海南医学院肿瘤研究所,海南海口 570102
目的探讨乙肝病毒X基因(HBx)对人肝癌细胞原癌基因ras表达水平的影响。方法将pcDNA3.1载体与HBx基因连接构建真核表达载体pcDNA3.1-HBx,采用脂质体介导转染人肝癌细胞Bel7402,以转染空载体pcDNA3.1的Bel7402细胞为对照,于转染后2、4、8、16 h收集细胞,提取细胞总蛋白并用Western blot技术检测肝癌细胞内n-Ras蛋白表达水平。结果与转染空载体pcDNA3.1的Bel7402对照组相比,转染重组表达载体pcDNA3.1-HBx的Bel7402细胞Ras蛋白表达水平在第2小时明显降低,第4小时Ras蛋白的表达水平仍有降低趋势,但比第2小时表达量有所增加;第8小时和第16小时,Ras蛋白的表达水平与对照组相比明显升高,差异有统计学意义 (P<0.05)。 结论HBx对人肝癌Bel7402细胞Ras蛋白表达有明显影响,HBx持续表达可能对Ras表达有促进作用。
肝癌;乙肝病毒X基因;Ras
肝癌(HCC)是世界范围内常见的恶性肿瘤之一,50%以上的肝癌患者分布在中国内地[1],肝癌已经成为我国严重的健康问题。HBV感染是促进肝癌形成的主要诱因,其相关性高达80%[2]。近年来研究显示,作为乙肝病毒X基因的表达产物(HBx)具有广泛的反式激活功能,其能通过直接或间接的蛋白质间相互作用参与感染肝细胞的信号转导、细胞凋亡和细胞周期调控等过程,在肝细胞癌发生和发展过程中发挥着重要作用[3-4]。
恶性肿瘤的形成、进展和转移与癌基因、抑癌基因不可逆的积累突变和失调有关,其中,ras基因与肿瘤发生发展的关系引起人们较高的关注。有研究表明,ras在肝癌早期已有表达,ras与其他基因如c-myc基因的协同作用在肝细胞癌变过程中发挥重要作用[5-6]。Ras蛋白所介导的转导途径是目前研究肝癌发生的热点问题。Ras蛋白在肝癌旁组织的表达显著高于HCC组织的表达,并认为Ras蛋白表达阳性的肝细胞具有癌变的潜能。
顾健人等[7]曾证实,n-Ras在肝癌中会过量表达,而蛋白的异常过量表达可能正是肿瘤发生的重要原因。但是,在HBV相关的肝癌中n-Ras表达是否异常,HBx对肝癌细胞中n-Ras的表达是否有影响以及其机制目前还未见相关报道,所以,本实验试图将HBx基因转入肝癌细胞中,在转染后的不同时间点连续检测n-Ras蛋白的表达量。通过不同时间点n-Ras蛋白表达量的变化来探讨HBx对Ras蛋白表达的影响。为进一步研究HBx对肝细胞增殖信号转导途径以及肝细胞癌的恶性侵袭和转移程度奠定基础。
1 材料与方法
1.1 材料
肝癌细胞系Bel7402购于中国科学院上海细胞库;特异性鼠抗人n-Ras抗体购于美国Calbiochem公司;HBx抗体购自美国Abcam公司;β-actin抗体和马抗小鼠的IgG抗体购于美国Santa Cruz公司。
1.2 方法
1.2.1 细胞培养 肝癌细胞Bel7402培养于10%胎牛血清的DMEM培养液,在37℃、5%CO2一定饱和湿度环境的条件下连续培养。在倒置显微镜下观察细胞形态。转染前24 h,用胰酶消化以便收获对数生长期细胞,以每孔4.0×105个细胞接种于6孔板,37℃5% CO2及一定饱和湿度下培养24 h后转染。
1.2.2 载体构建及瞬时转染 设计含有EcoRⅠ和XhoⅠ酶切位点的引物,扩增长度为482 bp的HBx基因片段,经酶切和连接反应将HBx片段插入pcDNA3.1载体中,构建重组载体pcDNA3.1-HBx;试剂盒提取质粒,双酶切后电泳鉴定并测序;用脂质体转染法将构建成功的pcDNA3.1-HBx瞬时转染Bel7402。
1.2.3 细胞总蛋白提取 分别用磷酸盐缓冲液漂洗并收集转染后培养2、4、8、16 h的细胞,3000 r/min离心5 min,弃上清,加入30 μL细胞裂解液及0.3 μL PMSF,冰上静置裂解30 min,12 000 r/min离心10 min收集上清,用改良的Bradford法进行蛋白定量,-80℃保存备用。
1.2.4 Western blot技术检测蛋白表达水平的变化
根据蛋白浓度每孔上样36 μg蛋白,加入上样缓冲液煮沸5 min。上样至15%的SDS-PAGE凝胶中,80 V电泳30 min后,120 V电泳60 min。取出凝胶,于转印液中平衡30 min。4℃40 V转印3 h至PVDF膜。取出PVDF膜,1×PBS漂洗5 min,室温封闭2 h。应用特异性抗体HBx(1∶1000稀释,Abcam,USA)、n-Ras(1∶1000稀释,Calbiochem,USA)和β-actin(1∶1000稀释,Santa Cruz,USA)为一抗4℃杂交过夜。用1×PBST漂洗3次,再加入马抗小鼠的IgG抗体(1∶2000稀释,Santa Cruz,USA)为二抗,杂交2 h。应用DAB显色法显色并扫描成像。以β-actin为内对照,比较转染HBx后培养不同时间的细胞中HBx和n-Ras蛋白表达水平的变化。
1.3 统计学方法
实验数据经软件Graph Pad Prism 5处理,采用SPSS Statistics 17.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,两组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 酶切鉴定结果
插入HBx基因的pcDNA3.1-HBx重组表达载体,如图1所示,设计含有EcoRⅠ和XhoⅠ酶切位点的引物,扩增长度为482 bp的HBx基因片段,经酶切和连接反应将HBx片段插入pcDNA3.1载体中,构建重组载体pcDNA3.1-HBx;双酶切后电泳鉴定,如图2所示,pcDNA3.1-HBx经EcoRⅠ和XhoⅠ双酶切后,电泳检测出现482 bp的HBx片段,说明构建成功。
2.2 转染pcDNA3.1-HBx载体后HBx在Bel7402细胞中的表达
Western blot检测结果显示,Bel7402细胞转染pcDNA3.1-HBx载体后从转染的第2小时开始有HBx蛋白表达,且蛋白表达量随时间递增(图3),而转染空载体的对照组中未见HBx表达。说明pcDNA3.1-HBx载体成功转染到Bel7402细胞中,并且目的基因HBx在细胞中成功表达。
2.3 Western blot检测Ras蛋白的表达水平变化
应用Western blot技术,以β-actin作为内参,检测转染HBx重组载体和对照空载体后,细胞中Ras蛋白表达水平的变化。结果如图4所示,在对照组中Ras蛋白的相对表达量在转染空载体后的第2、4、8、16小时分别为(3.9±0.2)、(4.9±0.2)、(4.6±0.3)和(4.9± 0.2),在转染空载体后的第2小时Ras蛋白的相对表达量有所下降,但是4 h后Ras蛋白的表达几乎无变化(P>0.05)。在肝癌细胞Bel7402中转染乙肝病毒HBx基因后Ras蛋白在不同时间点表达量明显不同。第2小时转染组Ras蛋白的相对表达量为(1.9±0.2),而对照组为(3.9±0.2);第4小时转染组Ras蛋白的相对表达量为(3.5±0.18),虽然与第2小时相比,表达量明显增加,但是仍然低于对照组,这说明转染HBx后Ras蛋白的表达量在初期是降低的;然而到了第8小时和第16小时,转染组Ras蛋白的相对表达量分别为(8.2±0.2)和(8.2±0.2),对照组的相对表达量分别为(4.6±0.3)和(4.9±0.2),所以从转染HBx的第8小时开始Ras蛋白表达量显著高于对照组(P<0.05),见图4,说明在第8、16小时HBx可能诱导Ras蛋白表达增加。
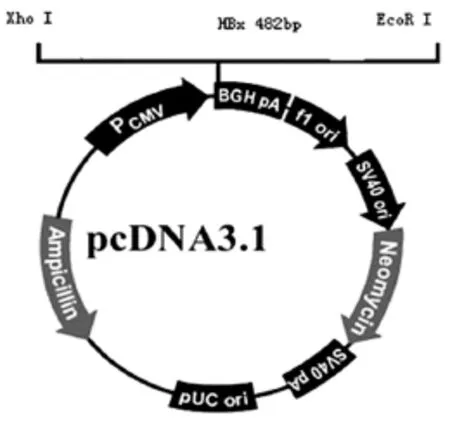
图1 表达载体结构模式图
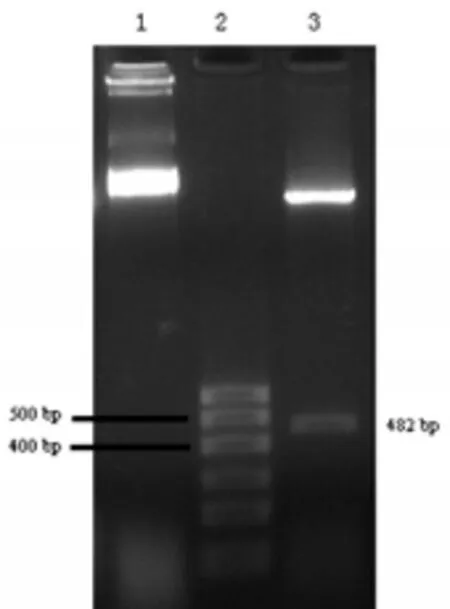
图2 构建的载体酶切鉴定图
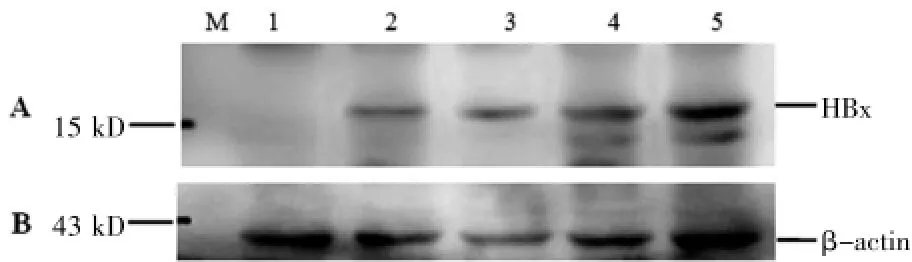
图3 HBx在Bel7402中的表达
3 讨论

图4 不同时间点Ras蛋白的表达水平
肝癌的发生发展是一个复杂的多阶段、多因素、多基因参与的过程[8-9]。HBVx基因转录产物X蛋白是病毒基因的转录调节因子,在体外细胞培养时能够控制和调节病毒基因的表达,干扰宿主细胞生长代谢,影响细胞基因的正常表达而诱发原发性肝癌[10-12]。因此,HBx基因可能在肝癌的发生和发展过程中起着重要作用。
ras基因是第一个被鉴定的人类原癌基因,其表达产物Ras蛋白是一类重要的功能蛋白,其能通过与GDP和GTP结合并水解GTP完成对正常细胞生长信号的传递和调节功能[13],介导生长因子、细胞因子和多种细胞外信号的信息通路,对细胞的增殖、分化和凋亡等多种生理过程发挥重要调节作用[14]。Ras蛋白能通过一系列途径将生长因子的信号带入细胞核,激活转录因子促进细胞增殖[15]。所以Ras蛋白表达量的异常升高,是肿瘤细胞恶性转化的标志[14]。有研究发现,ras基因活化后能使鼠NIH/3T3细胞转化为肿瘤细胞,Ras蛋白与肿瘤的侵袭转移以及恶性转化关系非常密切[16]。纪子钊等[17]研究发现,Ras蛋白在肝癌组织的表达显著高于癌旁组织的表达,且与VEGF、P53等协同表达,与肝细胞癌的恶性程度、侵袭和转移能力有关。最近Oishi等[18]研究发现,HBx能够通过与Ras的协同作用来抑制Ras蛋白诱导的衰老,但是具体机制还不明确。
为了研究HBx对肝细胞癌变过程中Ras蛋白表达水平的影响,本研究将重组的HBx载体pcDNA3.1-HBx转染肝癌细胞Bel7402,提取蛋白后应用Western blot技术来检测Ras蛋白的表达。结果显示,肝癌细胞Bel7402转入HBx基因后的不同时间点,Ras蛋白表达量明显不同。在转染后4 h,与对照相比,转染HBx的细胞Ras蛋白表达量有逐步上升的趋势;在刚转染的2 h内,Ras表达有下降现象,这可能是由于在转染时,pcDNA3.1-HBx载体以及转染的脂质体对细胞有一定损伤作用,这个作用可能诱导或促进细胞凋亡,导致Ras蛋白的表达量下降,而不是HBx本身的抑制作用。在转染8、16 h后,细胞稳定表达HBx,这时HBx开始发挥对Ras基因表达的调控作用。本研究结果显示,与对照组比较,转染HBx能促进人肝癌Bel7402细胞的Ras蛋白表达,提示在转染HBx第4小时Ras蛋白的表达量开始升高。
Ras在肝癌的发生过程中发挥重要作用,而肝癌的发生与感染HBV密切相关。近期研究发现,HBx诱导肝细胞恶性转化过程中也能诱导Ras和其他癌基因的表达从而促进肝细胞的恶性转化和行为[19-20]。本研究结果提示,HBx可能通过其反式作用因子的转录激活作用上调Ras蛋白表达,从而导致生长因子或其他信号传递异常,致使细胞恶性转化,这可能是乙肝病毒诱导肝癌的发病机制之一。由于Ras蛋白能激动生长信号的转递,是细胞生长和恶变的重要信息物质,所以实验结果提示HBx可能通过诱导Ras表达促进细胞恶性转化。HBx通过何种机制诱导Ras表达目前还不清楚,这是有待进一步研究的科学问题,也是探索HBx诱导肝细胞恶性转化的关键机制。
[1]Hu L,Wen JM,Sham JS.Establishment of cell lines from a primary hepatocellularcarcinoma and its metastasis[J]. Cancer Genet Cytogenet,2004,148(1):80-84.
[2]Jain S,Singhal S,Lee P,et al.Molecular genetics of hepatocellular neoplasia[J].Am J Transl Res,2010,2(1):105-123.
[3]Lee JH,Han KH,Lee JM.Impact of HBx mutations on hepatocellular carcinoma development in chronic HBV infection[J].Clin Vaccine Immunol,2011,18(6):914-921.
[4]Kew MC.Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma[J]. J Gastroenterol Hepatol,2011,26(1):144-152.
[5]冯德云,程瑞雪,颜亚晖.p21和C-myc蛋白在肝细胞癌与癌旁肝组织中表达的对比研究[J].湖南医科大学学报,1997,22(4):310-312.
[6]Chen J,Aleem S.Hepatitis B virus X protein stimu lates the mito chondrial translocation of Raf-1 viaoxidative stress[J].Virol,2007,81(12):5760.
[7]顾健人,陈渊卿,蒋惠秋,等.人原发性肝癌的癌基因谱[J].肿瘤,1988,(6):289.
[8]Deng GL,Zeng S,Shen H.Chemotherapy and target therapy for hepatocellular carcinoma:new advances and challenges[J].World J Hepatol,2015,7(5):787-798.
[9]Kimhofer T,Fye H,Thursz M.Proteomic and metabonomic biomarkers for hepatocellular carcinoma:a comprehensive review[J].Br J Cancer,2015,112(7):1141-1156.
[10]Zhang XD,Wang Y,Ye LH,et al.Hepatitis B virus X protein accelerates the development of hepatoma[J].Cancer Biol Med,2014,11(3):182-190.
[11]Moudgil V,Redhu D,Dhanda S.A review of molecular mechanisms in the development of hepatocellular carcinoma by aflatoxin and hepatitis B and C viruses[J].J Environ Pathol Toxicol Oncol,2013,32(2):165-175.
[12]Zhang Z,Toriin.Structural and functional characterization of interaction between hepatitis B Virous X protein and the proteasome complex [J].Biol Chen,2000,275(20):57-65.
[13]詹启敏.分子肿瘤学[M].北京:人民卫生出版社,2005:71-72.
[14]Hoorens A,Jouret-Mourin A,Sempoux C.Accurate KRAS mutation testing for EGFR-targeted therapy in colorectal cancer:emphasisonthekeyroleandresponsibilityofpathologists[J].Acta Gastroenterol Belg,2010,73(4):497-503.
[15]Matallanas D,Crespo P.New druggable targets in the Ras pathway[J].Curr Opin Mol Ther,2010,2(6):674-683.
[16]Raimondi F,Portella G,Orozco M.Nucleotide binding switchesthe informationflow inras GTPases[J].PLoSComput Biol,2011,7(3):98.
[17]纪子钊,刘峰.VEGF P53和p21 ras在原发性肝细胞癌中的表达及临床意义[J].中国现代医学杂志,1999,9(4):6-8.
[18]Oishi N,Shilagardi K,NakamotoY.Hepatitis Bvirus X protein overcomes oncogenic RAS-induced senescence in human immortalized cells[J].Cancer Sci,2007,98(10):1540-1548.
[19]Zhu M,Guo J,Li W,et al.Hepatitis B virus X protein induces expression of alpha-fetoprotein and activates PI3K/mTOR signaling pathway in liver cells[J].Oncotarget,2015,6(14):12196-12208.
[20]Li M,Zhu M,Li W,et al.Alpha-fetoprotein receptor as an early indicator of HBx-driven hepatocarcinogenesis and its applications in tracing cancer cell metastasis[J].Cancer Lett,2013,330(2):170-180.
The effect of hepatitis B virus X gene on the expression of ras in human hepatoma cells Bel7402
LU Yan1,2LI Wei1,2ZHU Mingyue1,2DONG Xu1,2CHEN Yi1,2ZHANG Xue'er3LI Mengsen1,2,4
1.Hainan Provincial Key Laboratory of Carcinnogenesis and Intervention,Hainan Medical College,Hainan Province, Haikou 571199,China;2.Key Laboratory of Molecular Biology,Hainan Medical College,Hainan Province,Haikou 571199,China;3.The Class 13 Innovation Excellence,Hainan Medical College,Hainan Province,Haikou 571199, China;4.Institution of Tumor,Hainan Medical College,Hainan Province,Haikou 570102,China
Objective To investigate the influence of HBx on proto-oncogene ras expression in human hepatoma cells. Methods HBx linked to pcDNA3.1 for constructing eukaryotic expression vector pcDNA3.1-HBx.pcDNA3.1-HBx vectors were transfected into Bel7402 cells to establish Bel7402/HBx cell model.Bel7402 cells transfected with pcDNA3.1 was used as control.Western blot was applied to evaluate the expression levels of n-Ras in Bel7402 cell while transfected with pcDNA3.1-HBx vectors for 2,4,8,16 h.Results The expression of Ras in Bel7402 was significantly lower while transfected with pcDNA3.1-HBx vectors for 2 h and 4 h contrast with control group (vehicle vector),however,the expression of Ras was significantly promoted while transfected with pcDNA3.1-HBx vectors for 8 h and 16 h(P<0.05).Conclusion HBx plays a role in influencing the expression of Ras in Bel7402 cells.Persistent expression of HBx maybe stimulate expression of Ras in hepatoma cells.
Hepatocellular carcinoma;HBx;Ras
R734
A
1673-7210(2015)11(b)-0009-04
2015-06-16本文编辑:程 铭)
国家自然科学基金(81360307、81260306、81160261、31060164);海南省社会发展科技专项(2015SF03);海南医学院科研培育基金(HY2013-19);海南医学院大学生创新创业训练计划项目(HYCX2014031)。
李孟森(1970-),男,研究员,主要从事肿瘤的发生发展的分子机制以及肿瘤耐药机制研究。
