Secukinumab治疗中重度斑块型银屑病效果及安全性的Meta分析
2015-11-28王丽丽白彦萍
王 英 王丽丽 白彦萍,2
1.北京协和医学院研究生院中日友好临床医学研究所,北京 100029;2.中日友好医院皮肤病与性病科,北京 100029
Secukinumab治疗中重度斑块型银屑病效果及安全性的Meta分析
王 英1王丽丽1白彦萍1,2
1.北京协和医学院研究生院中日友好临床医学研究所,北京 100029;2.中日友好医院皮肤病与性病科,北京 100029
目的系统评价Secukinumab治疗中重度斑块型银屑病的临床效果及安全性。方法计算机检索Medline、EMbase、Cochrane图书馆、中国生物医学文献数据库(CBM)、中文科技期刊全文数据库(VIP)、中国期刊全文数据库(CNKI)和万方数据库建库至2015年5月所有关于Secukinumab治疗中重度斑块型银屑病的随机对照试验,中文检索词为银屑病、Secukinumab和随机对照试验,英文检索词为psoriasis、Secukinumab和randomized clinical trial。由2名评价员按照纳入和排除标准独立筛选文献、提取资料及评价纳入研究质量。采用RevMan 5.3软件进行Meta分析。结果共纳入4个随机对照试验,包括2490例中重度斑块型银屑病例患者。在治疗12周时,Meta分析结果显示:①与安慰剂组比较,Secukinumab 150 mg治疗组中银屑病患者皮损面积和严重性指数(PASI)积分下降75%、90%和100%的患者例数(以PASI 75、PASI 90、PASI 100表示)明显增多,差异均有统计学意义(PASI 75:P<0.000 01,95%CI:10.47~20.89;PASI 90:P<0.000 01,95%CI:16.73~59.86;PASI 100:P<0.000 01,95%CI:9.08~66.62);Secukinumab 300 mg治疗组中银屑病患者PASI 75、PASI 90、PASI 100的例数与安慰剂组比较也显著增多 (PASI 75:P<0.000 01,95%CI:12.80~25.43;PASI 90:P<0.000 01,95%CI:22.85~81.34;PASI 100:P<0.000 01,95%CI:18.71~133.95);与Secukinumab 150 mg治疗组比较,Secukinumab 300 mg治疗组中PASI 75、PASI 90、PASI 100患者例数均明显增多,差异有统计学意义(PASI 75:P=0.001,95%CI:1.07~1.33;PASI 90:P<0.00001,95%CI:1.22~1.52;PASI 100:P<0.000 01,95%CI:1.67~2.60)。②Secukinumab 150 mg治疗组和Secukinumab 300 mg治疗组中不良反应发生率明显高于安慰剂组 (Secukinumab 150 mg:P=0.004,95%CI:1.05~1.33;Secukinumab 300 mg:P=0.02,95%CI:1.05~1.76),但Secukinumab 150 mg治疗组和Secukinumab 300 mg治疗组间不良反应发生率比较差异无统计学意义(P=0.44,95%CI:0.86~1.07)。结论 现有证据显示,在治疗12周时,Secukinumab能明显改善银屑病患者疾病严重程度,具有良好的临床疗效,但使用Secukinumab存在发生不良反应的风险;300 mg剂量临床疗效明显优于150 mg,且不良反应发生率无明显差异。由于纳入研究个数尚少,上述结论有待更多高质量的研究予以验证。
Secukinumab;斑块型银屑病;Meta分析;随机对照试验;疗效;安全性
银屑病是一种免疫细胞介导的慢性炎症性疾病,世界范围内的发病率约为2%[1]。目前该疾病发病机制尚不明确,且容易反复发作,严重影响患者的身心健康和生活质量[2]。白细胞介素(IL)-17A是Th17细胞的效应性细胞因子,但其也可来源于其他免疫细胞,如自然杀伤性T细胞、中性粒细胞和γδ T细胞等[3]。研究显示,银屑病患者外周血及皮损中IL-17A均明显增高,且与疾病严重程度呈正相关[4]。IL-17A可以刺激角质形成细胞分泌大量趋化因子和促炎介质介导其他炎症细胞的浸润[5]。因此,IL-17A在银屑病的发病机制中具有重要作用。Secukinumab是一种人源性单克隆抗体,可以选择性拮抗IL-17A[6],是目前应用于治疗银屑病的新型生物制剂,并于2015年初获得美国食品药品管理局(food and drug administration,FDA)批准治疗中重度斑块型银屑病患者。研究表明Secukinumab对银屑病患者具有良好的治疗作用,但缺乏相应的系统评价。为此,本研究对这些临床试验进行全面的分析,探讨Secukinumab的临床疗效及安全性,进一步为该种新型生物制剂治疗银屑病提供证据。
1 资料与方法
1.1 检索策略
计算机检索Medline、EMbase、Cochrane图书馆、中国生物医学文献数据库(CBM)、中文科技期刊全文数据库(VIP)、中国期刊全文数据库(CNKI)和万方数据库,检索时限均为建库至2015年5月。手工检索所获文献的参考文献及相关会议文献。文种限中、英文。纳入有关Secukinumab治疗中重度斑块型银屑病的相关文献。中文检索词为银屑病、Secukinumab和随机对照试验;英文检索词为psoriasis、Secukinumab和randomized clinical trial。
1.2 文献纳入标准
1.2.1 研究对象 中重度斑块型银屑病患者;银屑病皮损面积和严重性指数(psoriasis area and severity index,PASI)评分≥12分;病程≥6个月;年龄≥18岁;性别不限。
1.2.2 干预措施 治疗组给予Secukinumab治疗,对照组给予安慰剂治疗,前12周的治疗点为0、1、2、3、4、8周。
1.2.3 文献类型 随机对照试验的临床试验,无论是否采用分配隐匿或盲法。
1.2.4 结局指标 ①临床疗效指标:患者于治疗12周时PASI积分下降75%、90%、100%的患者例数(以PASI 75、PASI 90、PASI 100表示);②安全性指标:患者治疗12周时不良反应(adverse events,AEs)发生率。
1.3 文献排除标准
①非随机对照试验的临床研究;②不符合纳入标准的研究;③相关的文献综述或Meta分析;④重复发表;⑤缺乏全文。
1.4 资料提取与质量评价
由2位研究者根据纳入标准独立筛选文献、提取资料,如遇分歧讨论解决或由第三方裁决。资料用表格方式记录,提取主要内容包括第一作者、发表年份、文献题目、研究对象的随机对照方法、研究对象基本特征、研究样本量、干预措施、结局指标及其测定时间、不良反应、失访人数和失访处理等。纳入研究的方法学质量评价采用Cochrane系统评价员手册5.1.0针对随机对照试验的偏倚风险评估工具评价纳入研究的方法学质量[7]。
1.5 统计学方法
采用RevMan 5.2软件进行数据处理。资料以相对危险度(RR)表示,并给出95%可信区间(95%CI)。采用χ2检验对各纳入研究结果进行异质性检验。若P>0.1,I2<50%,说明各研究结果间不存在异质性,采用固定效应模型进行Meta分析;若P≤0.1,I2≥50%,说明各研究结果间存在异质性,采用随机效应模型进行Meta分析,分析异质性来源。若纳入文献异质性过大,则作描述性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果
经过筛选,最终纳入4个随机对照试验研究[8-11],均为英文文献,共2490例患者,治疗组1441例,对照组723例,依那普利组326例。
2.2 纳入研究的基本特征及方法学质量评价结果
纳入研究的基本特征见表1,方法学质量评价结果见表2。
2.3 临床疗效
2.3.1 PASI 75 4个研究[8-11],5个随机对照试验(Langley等[11]的研究中包含a、b两个随机对照试验)均报道了在第0、1、2、3、4、8周肌内注射Secukinumab 150 mg和300 mg与安慰剂,治疗12周时PASI 75的情况。Secukinumab 150 mg治疗组与安慰剂组间比较各研究无统计学异质性 (P=0.80,I2=0%);Secukinumab 300 mg治疗组与安慰剂组比较各研究间亦无统计学异质性(P=0.71,I2=0%),故均采用固定效应模型合并效应量。Secukinumab 150 mg治疗组与 Secukinumab 300 mg治疗组比较各研究间存在统计学异质性(P=0.06,I2=55%),采用随机效应模型合并效应量。Meta分析结果显示:Secukinumab 150 mg治疗组与安慰剂组间差异有统计学意义(RR=14.79,95%CI:10.47~20.89,P<0.000 01)(图1a);Secukinumab 300 mg治疗组与安慰剂组间差异亦有统计学意义(RR=18.04,95%CI:12.80~25.43,P<0.000 01)(图1b);Scukinumab 150 mg治疗组与Secukinumab 300 mg治疗组间比较差异有统计学意义(RR=1.20,95%CI:1.07~1.33,P= 0.001)(图1c)。
2.3.2 PASI 90和PASI 100 4个研究[8-11](包含5个随机对照试验)同样报道了在第0、1、2、3、4、8周肌内注射Secukinumab 150 mg和300 mg与安慰剂,治疗12周时PASI 90和PASI 100的情况。各研究间均无统计学异质性,故均采用固定效应模型合并效应量。Meta分析显示,各组间差异均有统计学意义(图2~3)。
2.3.3 安全性分析 在第0、1、2、3、4、8周肌内注射Secukinumab 150 mg和300 mg与安慰剂,4个研究报道了治疗12周时不良反应的发生率。Secukinumab300 mg治疗组与安慰剂组比较各研究间存在统计学异质性(P=0.06,I2=55%),采用随机效应模型合并效应量。其他各组间比较各研究间具有同质性,故采用固定效应模型合并效应量。Meta分析结果显示:Secukinumab 150 mg治疗组与安慰剂组间差异有统计学意义;Secukinumab 300 mg治疗组与安慰剂组间差异亦有统计学意义;但Secukinumab 150 mg治疗组与Secukinumab 300 mg治疗组间差异无统计学意义。见图4。
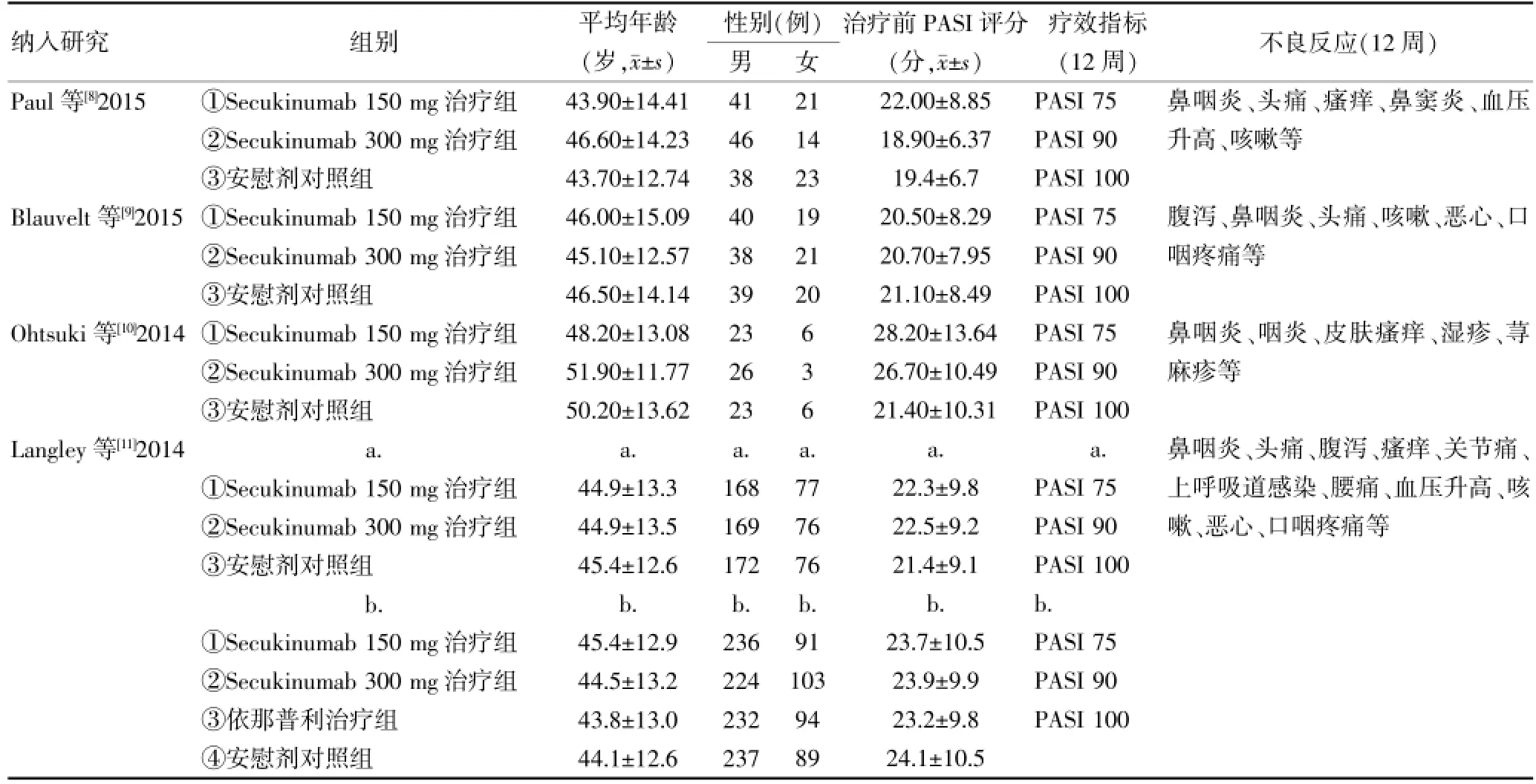
表1 纳入研究的基本特征

表2 纳入研究的方法学质量评价
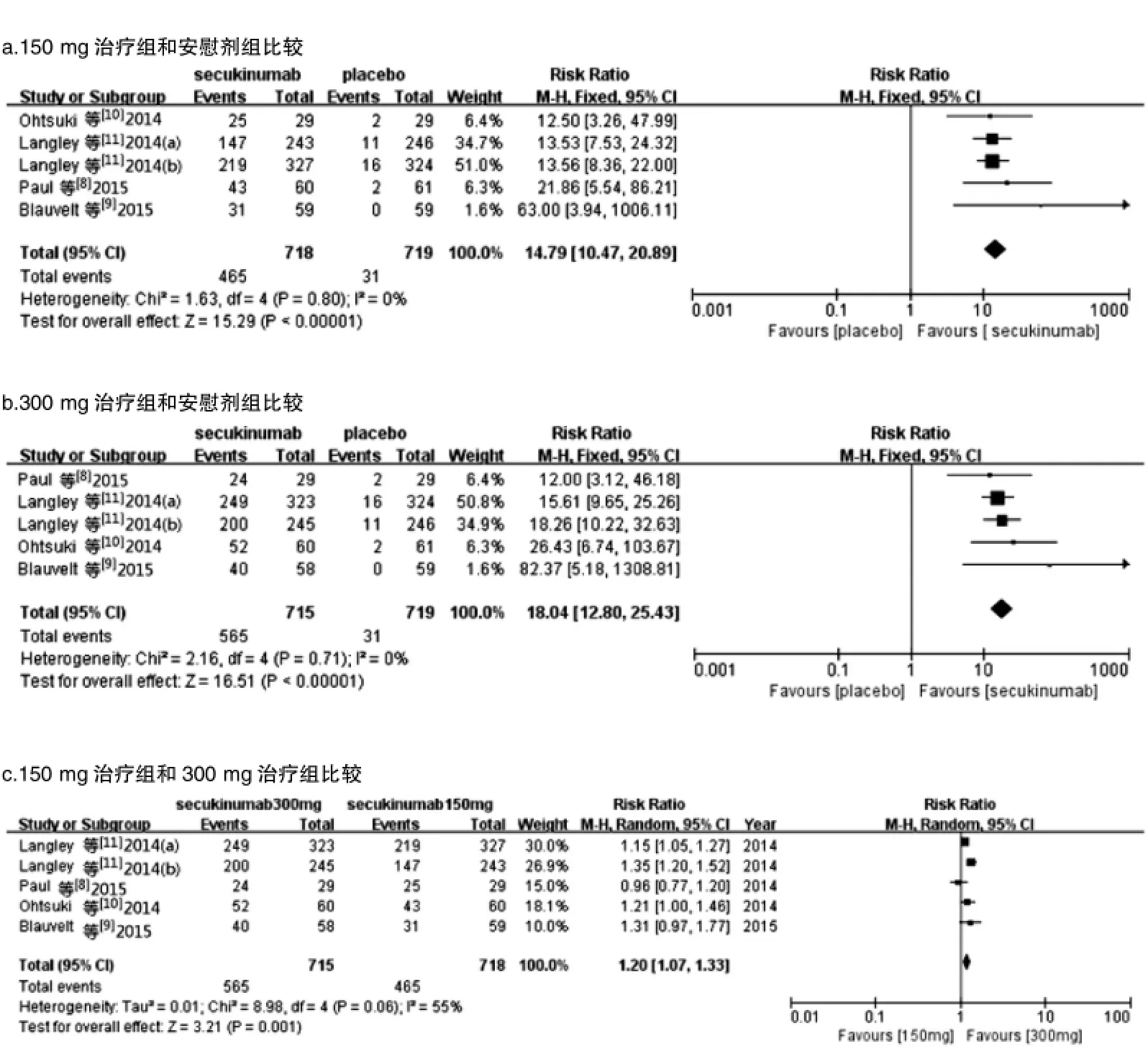
图1 Secukinumab 150 mg和300 mg治疗组与安慰剂组比较达到PASI 75改善例数的Meta分析

图2 Secukinumab 150 mg和300 mg治疗组与安慰剂组比较达到PASI 90改善例数的Meta分析

图3 Secukinumab 150 mg和300 mg治疗组与安慰剂组比较达到PASI 100改善例数的Meta分析
2.4 发表偏倚
基于Secukinumab 300 mg治疗组与安慰剂组间临床疗效指标PASI 75(图5a)、PASI 90(图5b)、PASI 100(图5c)进行漏斗图分析,结果显示所有漏斗图对称性较好,提示研究结果受发表偏倚影响较小。
3 讨论
银屑病免疫学领域近几年研究活跃,发展迅速,不仅加深了人们对银屑病发病机制的认识,也推动了银屑病靶向治疗的发展[12-13]。目前被FDA批准用于治疗银屑病的生物制剂有6种,包括阿法西普(Alefacept)、依法利珠单抗 (Efalizumab)、英夫利昔单抗(Infliximab)、阿达木单抗(Adalimumab)、依那西普(Etanercept)、乌斯奴单抗(Ustekinumab)[14-15],还有一些生物制剂正处于临床试验,如Brodalumab、Ixekizumab[16]。我国银屑病生物治疗起步较晚,目前正式批准用于治疗银屑病的生物制剂包括益赛普和英夫利昔单抗[17]。乌斯奴单抗在国内已完成注册临床试验,初步结果显示临床疗效与国外数据类似[18]。Secukinumab是一种新型生物制剂,疗效显著[19],但我国尚未引进此药。本文旨在系统评价Secukinumab的临床疗效和安全性,为其临床应用提供循证医学证据。
本研究纳入的研究均为多中心随机双盲对照试验,均有明确的纳入标准和排除标准,入组患者病情严重程度、平均年龄、性别比相似。4个研究中,仅1个研究随机方法未明确给出,存在较大偏倚,其他研究均为低度偏倚研究。本研究Meta分析结果显示:治疗12周时,Secukinumab 150 mg治疗组和Secukinumab 300 mg治疗组中PASI 75、PASI 90、PASI 100改善例数均明显高于安慰剂组,同时不良反应发生率也明显升高,提示Secukinumab对于银屑病患者具有良好的临床疗效,但也会导致患者发生某些不良反应。与Secukinumab 150 mg治疗组比较,Secukinumab 300 mg治疗组中PASI 75、PASI 90、PASI 100改善例数明显增多,但不良反应发生率差异却无统计学意义,提示300 mg剂量Secukinumab治疗银屑病效果优于150 mg剂量,且不良反应发生率无明显升高。本系统评价纳入的研究具有较高的方法学质量,但也存在一定的局限性:①符合纳入标准的研究数量较少(仅4个);②仅分析了治疗12周时的临床疗效及安全性,由于后续治疗方案不同,存在较大的方法学异质性,未进行更长时间的疗效和安全性分析,长期疗效和安全性问题、停药后安全性问题等需要更多临床试验来证实。
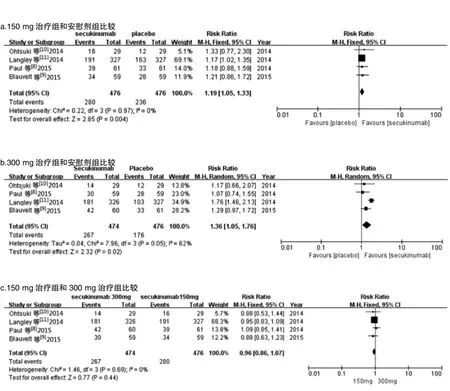
图4 Secukinumab 150 mg和300 mg治疗组与安慰剂组不良反应发生率的Meta分析
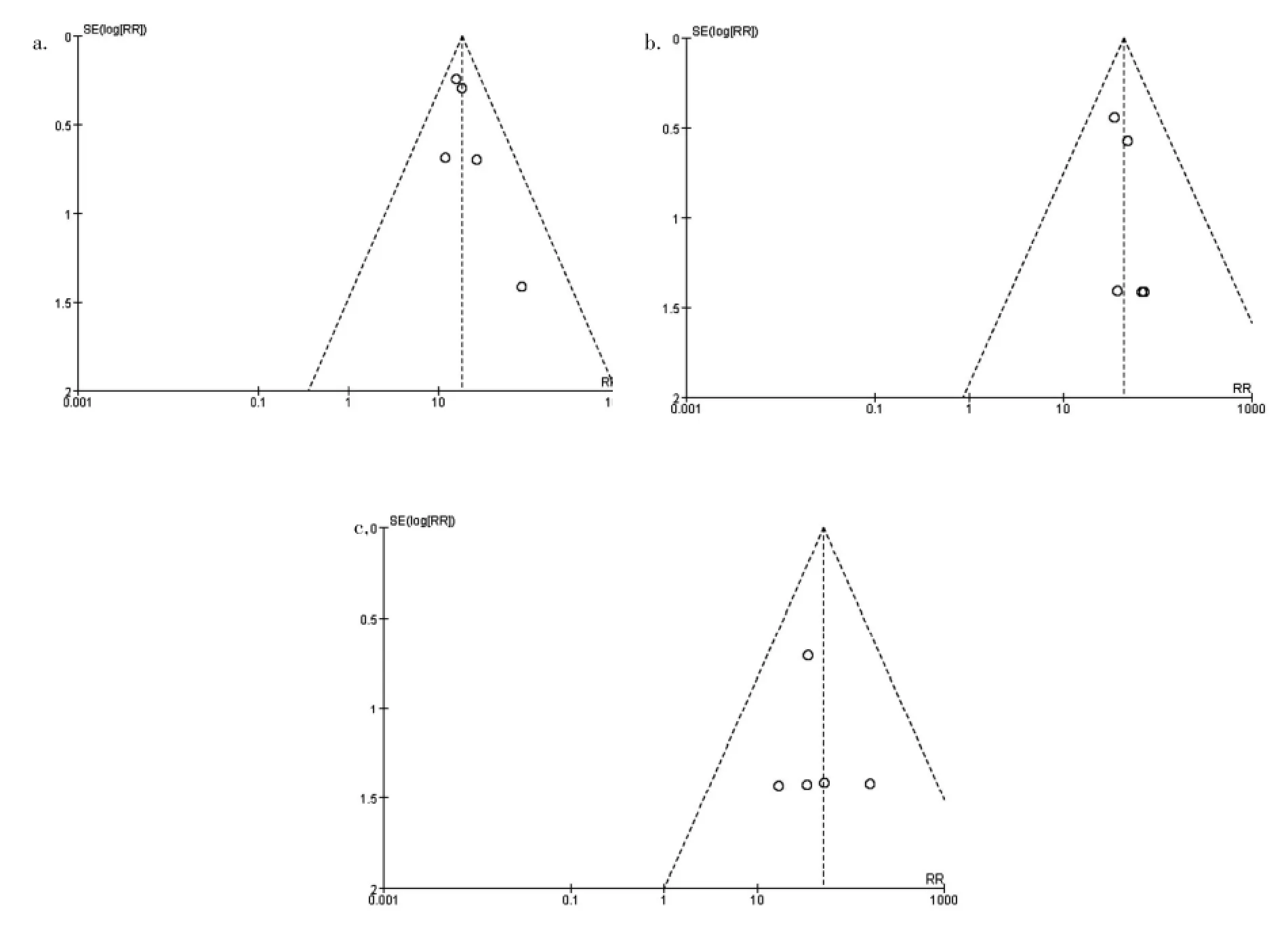
图5 Secukinumab 300 mg治疗组与安慰剂组间临床指标的漏斗图分析
综上所述,于0、1、2、3、4、8周注射Secukinumab 150 mg或300 mg治疗中重度斑块型银屑病患者的治疗方案具有良好的临床效果,但均存在不良反应问题;300 mg剂量临床疗效优于150 mg剂量,且不良反应发生率无明显差异。相比于其他生物制剂,Secukinumab已显示出强大的临床疗效[20],但对于我国银屑病患者是否具有同样临床疗效需要临床试验加以验证。希望Secukinumab可以为我国银屑病患者的治疗带来福音。此外,Secukinumab的长期疗效和停药后安全性问题也需要更多高质量的临床试验加以验证。
[1]Nestle FO,Kaplan DH,Barker J.Psoriasis[J].N Engl J Med,2009,361(5):496-509.
[2]Mattei PL,Corey KC,Kimball AB.Psoriasis area severity index(PASI)and the dermatology life quality index(DLQI):the correlation between disease severity and psychological burden in patients treated with biological therapies [J].J Eur Acad Dermatol Venereol,2014,28(3):333-337.
[3]Lynde CW,Poulin Y,Vender R,et al.Interleukin 17A:toward a new understanding of psoriasis pathogenesis[J].J Am Acad Dermatol,2014,71(1):141-150.
[4]Zhang L,Yang XQ,Cheng J,et al.Increased Th17 cells are accompanied by FoxP3(+)Treg cell accumulation and correlated with psoriasis disease severity[J].Clin Immunol,2010,135(1):108-117.
[5]Martin DA,Towne JE,Kricorian G,et al.The emerging role of IL-17 in the pathogenesis of psoriasis:preclinical and clinical findings[J].J Invest Dermatol,2013,133(1):17-26.
[6]Hueber W,Patel DD,Dryja T,et al.Effects of AIN457,a fully human antibody to interleukin-17A,on psoriasis,rheumatoid arthritis,and uveitis[J].Sci Transl Med,2010,2(52):52r-72r.
[7]Higgins JPT,Green S.Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0.[EB/OL]2011-03. Available at:http://www.handbook.cochrane.org/.
[8]Paul C,Lacour JP,Tedremets L,et al.Efficacy,safety and usability of secukinumab administration by autoinjector/ pen in psoriasis:a randomized,controlled trial(JUNCTURE)[J].J Eur Acad Dermatol Venereol,2015,29(6):1082-1090.
[9]Blauvelt A,Prinz JC,Gottlieb AB,et al.Secukinumab administration by pre-filled syringe:efficacy,safety and usability results from a randomized controlled trial in psoriasis(FEATURE)[J].Br J Dermatol,2015,172(2):484-493.
[10]OhtsukiM,MoritaA,AbeM,etal.Secukinumabefficacyand safety in Japanese patients with moderate-to-severe plaque psoriasis:subanalysisfromERASURE,arandomized,placebo-controlled,phase 3 study[J].J Dermatol,2014,41(12):1039-1046.
[11]Langley RG,Elewski BE,Lebwohl M,et al.Secukinumab in plaque psoriasis——results of two phase 3 trials[J].N Engl J Med,2014,371(4):326-338.
[12]王刚.银屑病免疫学研究新进展[J].中华皮肤科杂志,2015,48(4):223-226.
[13]Conrad C,Triboulet C,Gilliet M.Psoriasis:advances and challenges in 2015[J].Rev Med Suisse,2015,11(468):754,756-758.
[14]Lynch M,Kirby B,Warren RB.Treating moderate to severe psoriasis-best use of biologics[J].Expert Rev Clin Immunol,2014,10(2):269-279.
[15]Belge K,Bruck J,Ghoreschi K.Advances in treating psoriasis[J].F1000Prime Rep,2014,6:4.
[16]Spuls PI,Hooft L.Brodalumab and ixekizumab,anti-interleukin-17-receptor antibodies for psoriasis:a critical appraisal[J].Br J Dermatol,2012,167(4):710-715.
[17]中华医学会皮肤性病分会银屑病学组.中国银屑病治疗专家共识(2014版)[J].中华皮肤科杂志,2015,47(3):213-215.
[18]朱学骏,郑敏,Michael Song,等.乌司奴单抗改善中、重度斑块状银屑病患者健康相关生活质量和临床疗效观察[J].临床皮肤科杂志,2014,43(9):521-526.
[19]No authors listed.Secukinumab(Cosentyx)for psoriasis[J]. Med Lett Drugs Ther,2015,57(1465):45-47.
[20]Gisondi P,Dalle VC,Girolomoni G.Efficacy and safety of secukinumab in chronic plaque psoriasis and psoriatic arthritis therapy[J].Dermatol Ther(Heidelb),2014,4(1):1-9.
Meta analysis of efficacy and safety of Secukinumab for treating Plaque Psoriasis
WANG Ying1WANG Lili1BAI Yanping1,2
1.Clinical Institute of China-Japan Friendship Hospital,Graduate School of Peking Union Medical College,Beijing 100029,China;2.Department of Dermatology&Venerology,China-Japan Friendship Hospital,Beijing 100029,China
Objective To assess the efficacy and safety of Secukinumab on plaque psoriasis.Methods Randomized controlled trials (RCTs)of Secukinumab for plaque psoriasis were retrieved in Medline,EMbase,Cochrane Library, CBM,VIP,CNKI and Wanfang databases from their established date to May 2015.The searching words were psoriasis, Secukinumab and randomized clinical trial both in Chinese and in English.The retrieved studies were screened and evaluated by two people according to the predefined inclusion and exclusion criteria.The extracted data was analyzed by RevMan 5.3 software.Results Four RCTs involving 2490 patients with chronic moderate to severe plaque psoriasis were included and assessed.After treatment for 12 weeks,the Meta analysis showed that the cases whose psoriasis area and severity index (PASI)scores decreased 75%,90% and 100% (in form of PASI 75,PASI 90 and PASI 100) in patients receiving Secukinumab 150 mg were significantly higher than those in patients receiving placebo (PASI 75:P<0.000 01,95%CI:10.47-20.89;PASI 90: P<0.000 01,95%CI:16.73-59.86;PASI 100:P<0.000 01,95%CI:9.08-66.62).In comparison to placebo group,these indicators in Secukinumab 300 mg group increased significantly(PASI 75:P<0.000 01,95%CI:12.80-25.43;PASI 90:P<0.000 01,95%CI:22.85-81.34;PASI 100:P<0.000 01,95%CI:18.71-133.95).Compared with the patients receiving Secukinumab 150 mg,PASI 75,PASI 90 and PASI 100 in the patients receiving Secukinumab 300 mg increased significantly (PASI 75:P=0.001,95%CI: 1.07-1.33;PASI 90:P<0.000 01,95%CI:1.22-1.52;PASI 100:P<0.000 01,95%CI:1.67-2.60).The incidence of adverse events was higher in Secukinumab 150 mg group and Secukinumab 300 mg group than that in placebo group (Secukinumab 150 mg:P=0.004,95%CI:1.05-1.33;Secukinumab 300 mg:P=0.02,95%CI:1.05-1.76).However, the incidence of adverse events showed no significant difference between Secukinumab 150 mg group and Secukinumab 300 mg group (P=0.44,95%CI:0.86-1.07).Conclusion Clinical trial data indicates that injection of Secukinumab is efficient for patients with moderate to severe plaque psoriasis at week 12,but it can cause some adverse events.The clinical effect of 300 mg dose is significantly better than that of 150 mg dose,and the incidence of adverse events for patients in the two groups has no significant difference.But the number of enrolled studies is less,the conclusions above should be verified by more high quality studies.
Secukinumab;Plaque psoriasis;Meta analysis;Randomized controlled trials;Efficacy;Safety
R758.63
A
1673-7210(2015)11(a)-0070-07
2015-06-01本文编辑:张瑜杰)
国家自然科学基金资助项目(81173270)。
王英(1987-),女,北京协和医学院2014级皮肤病与性病学专业在读博士研究生;研究方向:银屑病免疫学。
白彦萍(1962-),女,博士,主任医师;研究方向:银屑病免疫学。
