冠醚固定相的制备及手性拆分
2015-11-27路振宇袁黎明
伍 鹏,汤 波,路振宇,孔 娇,袁黎明
(云南师范大学 化学化工学院,云南 昆明 650500)
近年来手性化合物的分离和拆分成为色谱分离研究的热点.色谱分离法由于具有极好的识别能力,目前已经成为应用最为广泛的手性拆分方法.高效液相色谱技术是色谱分离法中最常用的方法之一,在高效液相色谱中色谱柱是色谱的心脏部分[1-2].18-冠-6-醚是一类呈现王冠状结构的空腔大环聚醚,其环的外沿是亲脂性的乙撑基,环的内沿是富电子的杂原子如O、N、S等.自1967年冠醚被发现后[3],18-冠-6-醚就被用于高效液相色谱中分离化合物[4].18-冠-6-醚没有手性,需在其分子中引入手性中心后才能作为手性识别剂.18-冠-6-醚中引入一个1,1′-联萘单体能较好的用于液相色谱法拆分外消旋α-氨基酸[5-8].在众多的冠醚手性固定相中,R-(3,3′-二苯基-1,1′-二萘基)-20-冠-6表现出极好的拆分能力[9-10],但目前未见将R-(1,1′-二萘基)-20-冠-6涂敷到C18硅胶做成手性固定相的报道,因此,本文作者将R-(1,1′-二萘基)-20-冠-6涂敷于5μm的C18硅胶上制得了R-(1,1′-二萘基)-20-冠-6手性固定相,研究了其对9种α-氨基酸对映体的识别能力,取得了满意的效果.
1 实验部分
1.1 仪器与试剂
DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限公司);RE5298A旋转蒸发仪(上海亚荣生化仪器厂);ELGA-LC134去离子水净化系统(英国Elga公司);ELGA-LC186高纯水净化系统(英国Elga公司);Bruker-500核磁共振仪(德国Bruker公司);LC600高效液相色谱仪、紫外波长检测器、色谱工作站(美国Labtech公司),液相色谱装柱机、不锈钢空色谱柱:250mm×2.0mm i.d.(美国Alltech公司);Vario ELⅢ元素分析仪(德国Vario公司);球型硅胶YQG80(青岛美高化工有限公司,粒径5μm,比表面积300m2/g,平均孔径10nm),R-联萘酚(瑞士Adamas试剂有限公司);戊乙二醇(美国Alfa试剂公司);对甲基苯磺酰氯(上海泰坦科技股份有限公司);二氯甲烷(天津致远化学试剂有限公司);四氢呋喃(天津风船化学试剂科技有限公司);球型C 18硅胶(美国赛分科技有限公司,粒径5μm,孔径120nm).其余试剂均为国产分析纯试剂.
1.2 二对甲苯磺酸戊乙二醇的合成
参照文献[11]的方法合成二对甲苯磺酸戊乙二醇(图1):
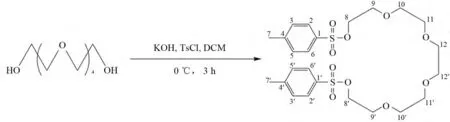
图1 二对甲苯磺酸戊乙二醇的合成路线图Fig.1 Synthetic route of pentaethylene glycol ditosylate
于100mL两颈烧瓶中依次加入4.2mL戊乙二醇,7.62g对甲基苯磺酰氯(TsCl),1.122 1g KOH和50mL二氯甲烷(DCM),0℃下反应3h,硅胶柱色谱纯化得淡黄色油状多甘醇10.31g,产率94.4%.1H NMR(500MHz,CDCl3)δ:7.82(4H,d,J=8.3Hz,H-2,2′,6,6′),7.37(4H,d,J=8.1Hz,H-3,3′,5,5′),4.22~4.14(4H,m,H-8,8′),3.78~3.67(4H,m,H-9,9′),3.62(12H,d,J=10.2Hz,H-10,10′,11,11′,12,12′),2.47(6H,s,H-7,7′).13C NMR(126MHz,CDCl3)δ:144.19(s,C-4,4′),132.36(s,C-1,1′),129.81(d,C-3,3′,5,5′),127.98(d,C-2,2′,6,6′),70.77(t,C-12,12′),70.62(t,C-11,11′),70.52(t,C-10,10′),69.23(t,C-9,9′),68.70(t,C-8,8′),21.61(q,C-7,7′).
1.3 R-(-1,1′-二萘基)-20-冠-6的合成
参照文献[11]的方法合成R-(-1,1′-二萘基)-20-冠-6(图2):
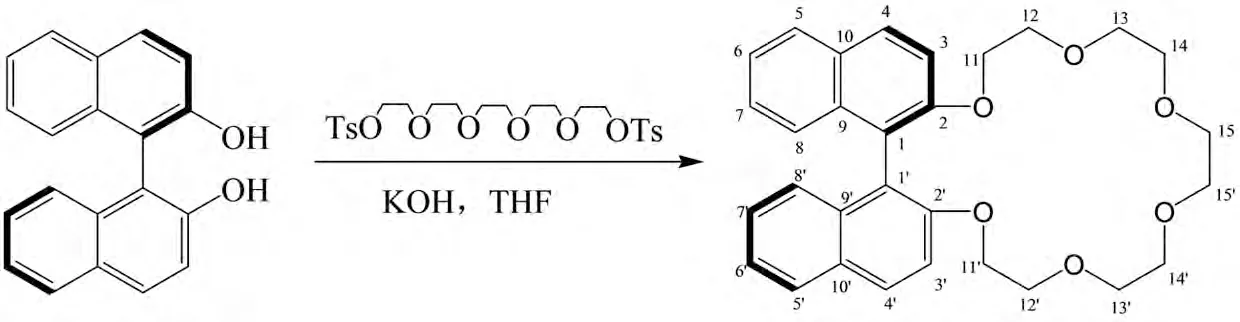
图2 R-(-1,1′-二萘基)-20-冠-6的合成路线图Fig.2 Synthetic route of R-(1,1′-binaphthyl)-20-crown-6
在N2保护下,将1.6g R-联萘酚和2.8g二对甲苯磺酸戊乙二醇加入到180mL无水THF溶液中,再加入0.5g KOH,在65℃条件下回流72h.减压浓缩溶剂,混合物溶于CH2Cl2,水洗(200mL×3),干燥有机层、浓缩溶剂.硅胶柱纯化[洗脱剂:V(乙酸乙酯)∶V(环己烷)=1∶2]得淡黄色油状固体1.18g,产 率47.2%.1H NMR(500MHz,CDCl3)δ:7.95(2H,dd,J=17.6,7.3Hz,H-5,5′),7.89(2H,d,J=8.1Hz,H-8,8′),7.50(2H,d,J=9.0Hz,H-4,4′),7.35(2H,ddd,J=8.1,6.6,1.2Hz,H-3,3′),7.27~7 .21(2H,m,H-7,7′),7.21~7.15(2H,m,H-6,6′),4.24(2H,ddd,J=10.9,7.1,4.1Hz,H-11),4.07(2H,dt,J=10.5,4.5Hz,H-11′),3.72~3.62(4H,m,H-12,12′),3.62~3.55(4H,m,H-13,13′),3.55~3.49(4H,m,H-14,14′),3.46~3.37(4H,m,H-15,15′).13C NMR(126MHz,CDCl3)δ:154.51(s,C-2,2′),134.15(s,C-9,9′),129.44(s,C-10,10′),129.23(d,C-4,4′),127.85(d,C-5,5′),126.24(d,C-8,8′),125.49(d,C-7,7′),123.64(d,C-6,6′),120.56(s,C-1,1′),116.10(d,C-3,3′),70.89(t,C-11,11′),70.68(t,C-12,12′),70.58(t,C-13,13′),69.84(t,C-14,14′),69.82(t,C-15,15′).
1.4 固定相的涂敷
取0.2g上述步骤制得的R-(1,1′-二萘基)-20-冠-6加入10mL二氯甲烷中,振摇使其溶解.按文献[12]的方法将其涂敷在1.8g的5μm的C18硅胶上.方法如下:取冠醚溶液5~8滴加到装有C18硅胶的25mL圆底烧瓶中,剧烈震荡使冠醚溶液均匀分散到C18硅胶上,旋转蒸发除去溶剂,数次重复上述操作直至将冠醚全部均匀涂覆在C18表面上。
1.5 柱子的装填
采用湿法装柱,取1.5g上述制备的手性固定相,加入24mL甲醇-水(体积比为1∶9)溶液中,搅拌使成为匀浆液.用甲醇-水(体积比为1∶9)做顶替液[13],在40MPa压力下进行装柱.
1.6 色谱条件
流动相为pH=2的高氯酸溶液,流速为0.1 mL·min-1,柱温为25℃.流动相使用前均经过0.45μm滤膜过滤,超声脱气后备用.检测波长为210nm.
2 结果与讨论
2.1 R-(1,1-二萘基)-20-冠-6手性固定相的元素分析
对R-(1,1′-二萘基)-20-冠-6手性固定相(CSP)和C18硅胶进行元素分析,结果见表1.
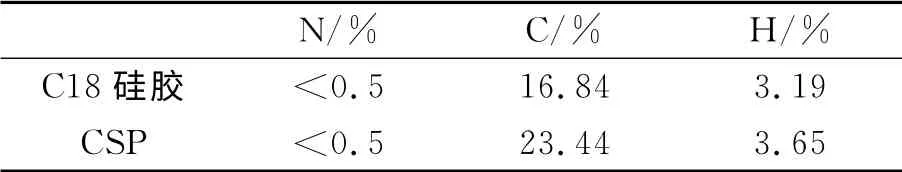
表1 元素分析结果Table 1 The results of elemental analysis
根据元素分析的结果可以算出R-(1,1′-二萘基)-20-冠-6的涂敷质量为C18硅胶质量的9.23%,与实际添加值10%基本一致.
2.2 理论塔板数
以L-对羟基苯甘氨酸测柱效,计算塔板数为:
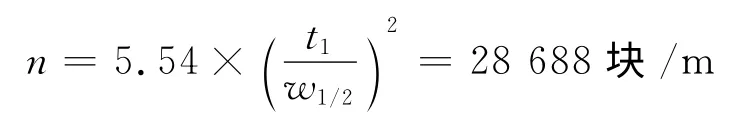
式中:t1出峰时间,w1/2为半峰高.
不对称因子:
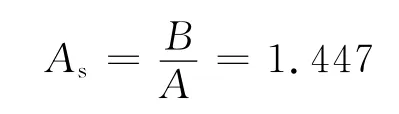
式中:A为10%峰高处前半峰的宽度,B为同高度处后半峰的宽度
实际塔板数为28 688块/m,说明柱效还是比较好的.不对称因子As为1.447,说明峰形还是比较好的.
2.3 R-(1,1-二萘基)-20-冠-6手性色谱柱对手性化合物的拆分
得到的R-(1,1-二萘基)-20-冠-6手性色谱柱,以pH=2的高氯酸溶液作流动相,流速为0.1mL·min-1,柱温为25℃的条件下对9种常见的α-氨基酸对映体进行拆分,其结构如图3所示.
R-(1,1-二萘基)-20-冠-6手性色谱柱对各氨基酸的拆分结果见表2.
从表2可以看出,所拆分的9种α-氨基酸对映体中缬氨酸、对羟基苯甘氨酸、苯甘氨酸、谷氨酸、色氨酸这5种能得到分离,分离谱图如图4所示.
α-氨基酸对映体在冠醚手性固定相上保留时间的不同可以解释为[10]:氨基酸上的氨基在流动相高氯酸溶液中会被质子化转变成氨基酸阳离子,该阳离子会分布于流动相中并和固定相手性冠醚环中的氧原子产生作用.由于冠醚中的手性联萘酚造成的空间位阻,氨基酸的D-及L-构型与冠醚环的作用力不同,使得氨基酸外消旋体在手性柱中的移动速度不同,因此氨基酸的外消旋体在手性冠醚柱中得到手性拆分.
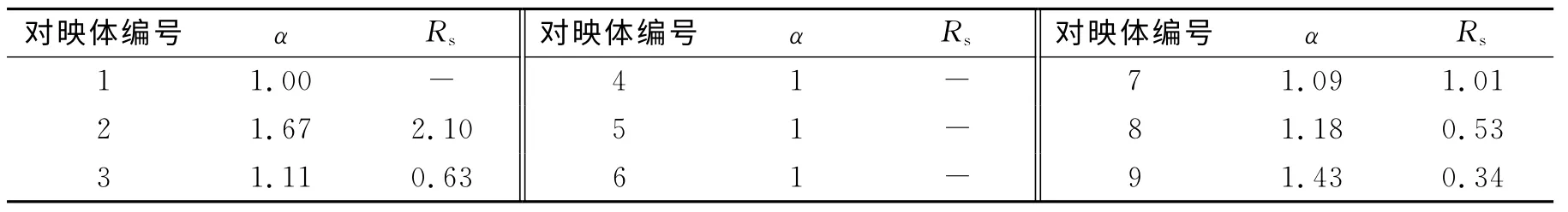
表2 手性柱对α-氨基酸对映体的拆分结果Table 2 The separation results ofα-amino acid enantiomers on chiral columns
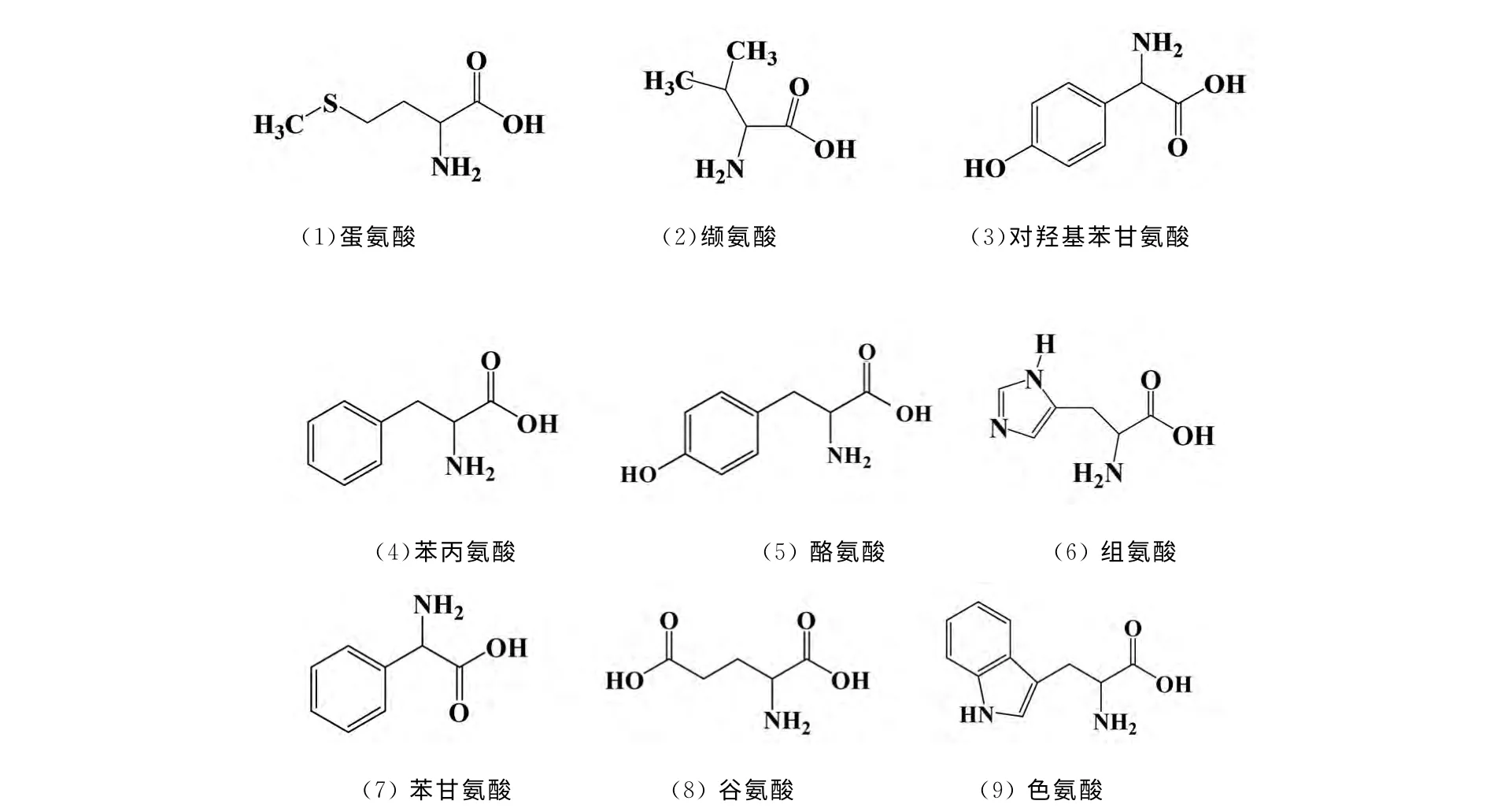
图3 α-氨基酸的结构式Fig.3 Molecular structures ofα-amino acid

图4 α-氨基酸对映体的拆分谱图Fig.4 Enantioseparation chromatograms ofα-amino acid
2.4 R-(1,1′-二萘基)-20-冠-6手性固定相的稳定性
得到的R-(1,1′-二萘基)-20-冠-6手性固定相在pH=2的高氯酸溶液为流动相的条件下使用240h后,各α-氨基酸的容量因子基本保持不变,并且测定该手性固定相的含碳量也几乎没有改变,表明R-(1,1′-二萘基)-20-冠-6手性固定相化学稳定性良好,可以在pH=2的酸性条件下长时间使用.
3 结论
本文作者以R-联萘酚和二对甲苯磺酸戊乙二醇为原料合成了R-(1,1′-二萘基)-20-冠-6,并将其涂敷在5μm的C18硅胶上制成了高效液相色谱冠醚手性固定相.在流动相为pH=2的高氯酸,柱温为25℃的条件下,其对9种常见的α-氨基酸对映体进行了拆分,结果表明,该手性固定相对5种α-氨基酸对映体(缬氨酸、苯甘氨酸、对羟基苯甘氨酸、谷氨酸、色氨酸)有不同程度的拆分效果,说明R-(1,1′-二萘基)-20-冠-6冠醚手性固定相(CSP)能对手性氨基酸进行较好的拆分.
[1]袁黎明.制备色谱技术及应用[M].北京:化学工业出版社,2005.
[2]MAIER N M,FRANCO P,LINDNER W J.Separation of enantiomers:needs,challenges,perspectives[J].J Chromatogr A,2001,906:3-33.
[3]PEDERSON C J.Cyclic polyethers and their complexes with metal salts[J].J Am Chem Soc,1967,89:2495-2496.
[4]KIBA M P,TIMBO J M,KAPLAN L J,et al.Hostguest complexation.11.Survey of chiral recognition of amine and amino ester salts by dilocular bisdinaphthyl hosts[J].J Am Chem Soc,1978,100:4555-4568.
[5]KYBA E P,SIEGEL M G,SOUSA L R,et al.Chiral,hinged,and functionalized multiheteromacrocycles[J].J Am Chem Soc,1973,95:2691-2692.
[6]袁黎明.手性识别材料[M].北京:科学出版社,2010.
[7]SOUSA L R,SOGAH G D Y,HOFFMAN D H,et al.Host-guest complexation.12.Total optical resolution of amine and amino ester salts by chromatography[J].J Am Chem Soc,1978,100:4569-4576.
[8]SOGAH G D Y,CRAM D J.Host-guest complexation.14.Host covalently bound to polystyrene resin for chromatographic resolution of enantiomers of amino acid and ester salts[J].J Am Chem Soc,1979,101:3035-3042.
[9]SHINBO T,YAMAGUCHI T,NISHIMURA K,et al.Chromatographic separation of racemic amino acids by use of chiral crown ether-coated reversed-phase packings[J].J Chromatogr,1987,405:145-153.
[10]SHINBO T,YAMAGUCHI T,YANAGISHITA H,et al.Improved crown ether-based chiral stationary phase[J].J Chromatogr,1992,625:101-108.
[11]BONGER K M,BERG V B,RICHARD J,et al.Synthesis and evaluation of homo-bivalent GnRHR ligands[J].Bioorg Med Chem,2007,15:4841-4856.
[12]候士聪,王敏,周志强,等.涂敷型手性固定相的制备及氯氟草醚乙酯对映体的高效液相色谱分离[J].色谱,2002,20:537-539.
[13]江运东,张美,谢生明,等.硝酸纤维素手性固定相的制备及其在手性化合物拆分中的应用[J].化学研究,2010,21(2):77-79.
