“肝病实脾”法对ACLF大鼠内毒素血症的影响
2015-11-27徐嘉蔚王国栋
何 琬,陈 斌*,徐嘉蔚,王国栋,刘 璇
(1.湖南中医药大学第一附属医院,湖南 长沙410007;2.湖南中医药大学研究生院,湖南 长沙410208)
研究发现[1],肝衰竭大鼠存在胃肠蠕动功能障碍,促进了肠源性内毒素血症的发生,由此引起多种细胞因子的分泌与释放,造成肝脏的二次损伤, 加重病情的进展。 肝衰竭患者常伴有不同程度的腹胀、食欲不振、恶心、便秘或腹泻等胃肠运动功能异常, 属中医脾虚证范畴。 我院在肝衰竭传统治疗方法解毒化瘀基础上加用健脾益气或健脾温阳药物[2-3],临床疗效显著,但其机制不明确。 本研究拟从胃肠动力学变化及门脉内毒素水平,探讨“肝病实脾”之解毒化瘀、益气健脾法治疗慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)的可能作用机制。
1 材料与方法
1.1 实验动物
健康Wistar 大鼠70 只,雌雄各半,体质量120~140 g,由中国人民解放军军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2012-0004。 动物饲养于湖南中医药大学实验动物中心, 饲养温度24~26 ℃,相对湿度55%~65%,喂普通饲料,饮冷开水。
1.2 药物与试剂
解毒化瘀方由茵陈30 g、 虎杖30 g、 大黄10 g、丹参30 g、赤芍50 g 组成,健脾方组由黄芪30 g、白术20 g 组成,药物均采用单味中药配方颗粒(广东一方制药有限公司),谷丙转氨酶测定试剂盒(长春汇力生物技术有限公司);谷草转氨酶测定试剂盒(长春汇力生物技术有限公司);显色基质鲎试剂盒 (厦门市鲎试剂实验厂有限公司, 批号:140325);牛血清白蛋白(北京Solarbio 公司,批号:628C053);弗氏不完全佐剂(美国Sigma-Aldrich,批号:1001646388);D-氨基半乳糖(美国Sigma);羧甲基纤维素(美国Sigma);水合氯醛(天津市科密欧化学试剂有限公司),大鼠胃动素(motilin,MTL)ELISA试剂盒(美国RD 公司,批号:20140919)。
1.3 主要仪器
JY92-Ⅱ型超声波细胞粉碎机 (宁波新芝技术公司),SK3003 半自动生化分析仪(深圳市盛信康科技有限公司),722 s 可见光分光度计 (上海精密科学仪器有限公司制造);电子天平ME2001E/02[梅特勒-托利多仪器(上海)有限公司]。
1.4 溶液的制备
1.4.1 营养性半固体糊[4]取羧甲基纤维素5 g,溶于125 mL 蒸馏水中,然后依次加入奶粉8 g、白糖4 g、淀粉4 g,且每加1 次搅拌1 次,搅拌均匀后,再加入活性炭1.5 g, 搅拌均匀, 最后配制成约150 mL 含150 g 的营养半固体糊。 置4 ℃冰箱冷藏,用前2 h 取出,恢复至室温。
1.4.2 牛血清白蛋白乳化液[5]牛血清白蛋白液:取牛血清白蛋白5 g,加生理盐水5 mL,混匀配为1000 mg/mL。 取0.5 mL (500 mg) 加入生理盐水30.75 mL,配成31.25 mL。乳化:取上述牛血清白蛋白液20 mL(320 mg)与弗氏不完全佐剂20 mL 置烧杯内,在超声波细胞粉碎机上乳化,至液滴入水不散开,成乳化液(含牛血清白蛋白8 mg/mL)。
1.5 动物造模与给药
参照文献方法[5-7],并加以改进。 70 只Wistar 大鼠,雌雄各半,分为4 组:正常组10 只,其余60 只随机分成3 组制作免疫性肝纤维化模型。 (1)牛血清白蛋白致敏:除正常组外,每次取0.5 mL 乳化液大鼠皮下多点注射, 第1-2 次间隔14 d, 第2-3 次、3-4次间隔10 d。 (2)牛血清白蛋白攻击:每周2 次尾静脉注射牛血清白蛋白,剂量每次0.4 mL/只,牛血清白蛋白含量自2 mg/次渐加0.5 mg/次至4 mg/次,维持此剂量,共6 周(12 次),成模35 只,分别是模型组10 只,对照组12 只,实验组13 只。 (3)急性攻击:6周末, 除正常组外, 均予以D-氨基半乳糖1.2 g/kg一次性腹腔注射,建立慢加急性肝衰竭模型。
采取灌胃给药方法,按照人与大鼠体表面积的换算关系,计算出大鼠健脾方的日用量4.5 g/kg,实验组(解毒化瘀+健脾)的日用量18 g/kg、对照组(解毒化瘀)的日用量13.5 g/kg。实验组在尾静脉牛血清白蛋白攻击的同时开始健脾药物灌胃给药,至处死前7 d 加用解毒化瘀颗粒,用药时间为6 周;对照组于动物处死前7 d 开始灌胃解毒化瘀颗粒;正常组与模型组大鼠给予等剂量生理盐水, 于处死前7 d 开始灌胃给药; 以上各组均每天灌胃1 次,3 mL/次。
1.7 观察指标
1.7.1 内毒素检测 抽取门静脉血1 mL 装入无热原抗凝管,3 000 r/min,离心2 min,取上清血浆标本,参照显色基质鲎试剂盒说明书,行内毒素检测。
1.7.2 血清MTL 浓度检测 抽取右心房血2 mL,注入促凝管中,3 000 r/min,离心4 min,取血清,行酶联免疫吸附检测。
1.7.3 胃排空率、小肠推进率的测定[4,8]大鼠末次给药后禁食不禁水16 h, 予营养性半固体糊灌胃2 mL/只,30 min 后, 用4%水合氯醛以 0.3 mL/100 g 腹腔注射麻醉。 迅速打开腹腔,分离肠胃。 结扎胃贲门和幽门,取胃,用滤纸吸干后称全质量,然后沿胃大弯剪开胃体, 用蒸馏水洗去胃内容物后,拭干,称净质量。 以胃全质量和胃净质量之差为胃内残留物质量,计算胃内残留物占所灌半固体米糊的质量百分比为胃内残留率。 同时迅速取出小肠,轻轻剥离后直铺于试验台白纸上,不牵拉,用直尺测量幽门至回盲肠部全长及幽门至黑色半固体糊前沿的距离,并计算小肠推进率。
1.8 数据处理
所有数据处理采用SPSS 17.0 统计软件进行统计分析,各组实验数据以“±s”表示。 多组间计数资料比较采用方差分析, 两组间比较采用LSD 检验。P<0.05 为差异有统计学意义,P<0.01 为差异有显著统计学意义。
2 结果
2.1 各组大鼠门静脉内毒素水平的比较
与正常组相比,模型组大鼠门静脉内毒素水平显著升高,有显著统计学差异(P<0.01);实验组大鼠门静脉内毒素水平与模型组、对照组比较,差异有显著统计学意义(P<0.01)。 见表1。
2.2 各组大鼠血浆胃动素水平的比较
模型组MTL 降低,与正常组相比有显著性差异(P<0.01)。实验组大鼠MTL 水平与模型组、对照组比较,差异均有显著统计学意义(P<0.01)。 见表1。
表1 各组大鼠内毒素、胃动素水平比较 (±s)

表1 各组大鼠内毒素、胃动素水平比较 (±s)
注:与正常组比较△△P<0.01;与模型组比较**P<0.01;与对照组比较##P<0.01。 下表同。
组 别正常组模型组对照组实验组n 10 10 12 13内毒素(EU/mL)0.572±0.189 5.774±1.636△△5.463±0.688 3.972±0.834**##胃动素(ng/L)140.15±11.02 45.42±3.70△△47.23±5.05 61.85±6.5**##
2.3 各组大鼠胃内残留率和小肠推进率的比较
与正常组相比,模型组大鼠的胃内残留率显著升高,小肠推进率显著下降(P<0.01);说明造模后各组大鼠胃排空时间延长,小肠推进功能缓慢;实验组与模型组、对照组比较,大鼠胃内残留率下降,小肠推进率显著升高(P<0.01)。 见表2。
表2 各组大鼠胃残留率、小肠推进率比较 (±s)
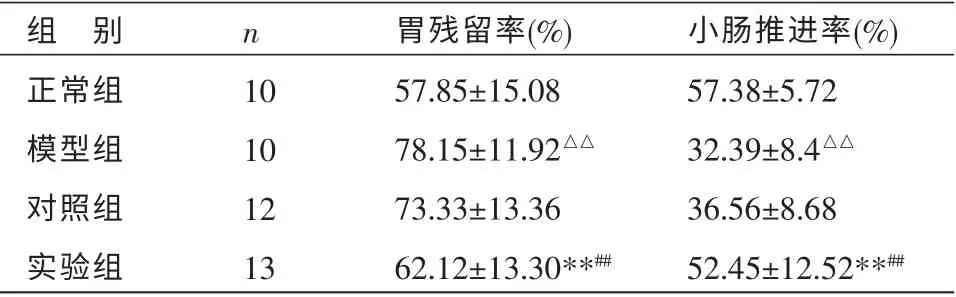
表2 各组大鼠胃残留率、小肠推进率比较 (±s)
组 别正常组模型组对照组实验组n 10 10 12 13胃残留率(%)57.85±15.08 78.15±11.92△△73.33±13.36 62.12±13.30**##小肠推进率(%)57.38±5.72 32.39±8.4△△36.56±8.68 52.45±12.52**##
3 讨论
生理上肝依五行关系而克脾土,病理上肝郁可横逆犯脾,土虚也可导致木侮,脾脏易虚,脾虚失运,土壅木郁,肝气失于条达,血行不畅,同时易致湿、热、疫毒等外邪内侵,留滞不去,导致了疾病的发生,正如李东垣在《脾胃论·脾胃盛衰论》中说“百病皆由脾胃衰而生也。 ”陈复正《幼幼集成》中曰:“益脾土强者,足以捍御湿热,必不生黄,惟其脾虚不运,所以湿热乘之。 ”因此,在治疗肝病的时候,就应当先实其脾气,以免肝邪犯脾,导致疾病进一步发展。 所谓 “正气存内,邪不可干”,从胃肠着眼,“正气存内”则主要体现在胃气健旺、小肠分清别浊和大肠通降正常,亦即现代医学所说的胃肠正常结构与功能[9]。 因此治疗肝衰竭时在传统治疗方法解毒化瘀基础上加用健脾益气或健脾温阳药物,可使临床疗效显著提高。
肝衰竭时,由于肠道菌群紊乱,细菌异常增殖,内毒素产生增多,肝脏发生大面积坏死,Kuffer 细胞功能严重受损, 对内毒素的清除和解毒能力减弱,易致内毒素血症,激活细胞内信号转导系统,释放大量的炎性介质(如TNF-α 等)和氧自由基,导致胃肠黏膜的缺血、缺氧和血管通透性增加,造成血液循环障碍、肠黏膜水肿,蠕动减慢、消化吸收功能障碍,加重肠源性内毒素血症的产生,反过来又加重肝衰竭的进展。 本研究结果也证实了ACLF 大鼠存在胃肠功能障碍,胃动素水平下降和肠源性内毒素血症(intestinal endotoxemia,IETM)。
本实验结果证实,解毒化瘀法经早期加用健脾药物黄芪、白术干预后,能使ACLF 大鼠胃动素含量增多,胃内残留率显著下降、小肠推进率显著升高,结果表明“肝病实脾”能促使胃排空和小肠推进,增加肠道的推进式蠕动可以防止肠腔内容物的瘀滞和细菌的过度生长,减少致病菌及内毒素对肠黏膜屏障的损伤,加快肠道内毒素的排出,从而改善IETM,及减轻内毒素对肝脏的损伤。本实验结果证实了“肝病传脾”,致脾运化功能失常(胃排空、小肠推进率降低),湿毒内蕴(包括血中内毒素增加),损及于肝。 因此,选择用中药来维持和恢复胃肠正常结构与功能可以从健脾益气、“肝病实脾”的角度着手治疗。 本研究结果将为“肝病实脾”早期干预ACLF 提供理论与实验依据, 也为中医治疗ACLF 提供一种全新的研究思路。
[1]潘巧玲,刘小静,叶 峰,等. TAA 致大鼠急性肝衰竭的胃肠功能及病理改变[J].西安交通大学学报(医学版),2008,29(1):66-69.
[2]伍玉南,孙克伟,彭建平,等.解毒化瘀温阳健脾与解毒化瘀益气健脾法治疗慢性重型肝炎的临床观察[J]. 中西医结合肝病杂志,2011,21(1):4-7.
[3]孙克伟,陈 斌,黄裕红,等.凉血解毒、清热化湿和凉血解毒、健脾温阳法治疗慢性重型肝炎的临床观察[J]. 中国中西医结合杂志,2006,26(11):981-983.
[4]刘未艾,何亚敏.隔药饼灸对肝郁脾虚型功能性胃肠病大鼠胃排空、小肠推进功能影响等效性随机平行对照研究[J].实用中医内科杂志,2013,27(1):79-82.
[5]曹承楼. Ax1 调控树突状细胞凋亡在茵陈蒿汤治疗慢加急性肝衰竭大鼠中的作用[D].长沙:湖南中医药大学,2014.
[6]刘旭华.大鼠慢加急性肝衰竭实验模型的建立及其病理机制初步研究[D].北京:首都医科大学,2007.
[7]Wang LK,Wang LW,Li X,et al. Ethyl pyruvate prevents inflammatory factors release and decreases intestinal permeability in rats with D-galactosamine-induced acute liver failure [J].Hepatobiliary & Pancreatic Diseases International,2013,12 (2):180-188.
[8]邢建峰,封卫毅,侯家玉.小鼠胃排空及小肠推进实验方法的探讨[J].北京中医药大学学报,2003,26(4):50-52.
[9]张振字,杨大国.中西医结合治疗慢性肝病并肠道菌群失调与内毒素血症的研究近况. 中华中医药学会第11 届肝胆病学术会议论文集[C].宜昌:中华中医药学会,2004:191.
