轮作与连作对烤烟不同生育期根际土壤细菌群落结构的影响
2015-11-24齐虹凌贺国强李恒全刘德育孙宏宇元野
齐虹凌,贺国强,李恒全,刘德育 ,孙宏宇,元野
1牡丹江师范学院,生命科学学院,黑龙江牡丹江文化街191号 157011;2 牡丹江烟草科学研究所,黑龙江牡丹江 157011
轮作与连作对烤烟不同生育期根际土壤细菌群落结构的影响
齐虹凌1,贺国强2,李恒全2,刘德育2,孙宏宇2,元野2
1牡丹江师范学院,生命科学学院,黑龙江牡丹江文化街191号 157011;2 牡丹江烟草科学研究所,黑龙江牡丹江 157011
为明晰烤烟连作是否对根际细菌群落结构产生影响,采集不同生育时期的轮作和连作烤烟根际土壤,运用454焦磷酸测序技术,对根际土壤细菌16S rDNA V1-V3片段序列结构组成进行分析。结果表明,与轮作处理相比,连作处理烤烟根际酸杆菌门丰度在生育前期低而在后期高,但α-变形菌门和放线菌门表现出相反的变化趋势;烤烟连作降低了表征菌群丰度的Chao指数和物种丰富度的Shannon指数,表明烤烟连作降低了根际土壤细菌多样性。主成分分析和NMDS(non-metric multidimensional scaling)的聚类分析结果显示不同处理烤烟根际细菌群落结构随生育期而迁移,轮作与连作烤烟根际土壤细菌群落结构差异在生育前期体现明显,生育后期不明显,表明生育期是影响烤烟根际细菌群落结构变化的主要因素,而连作与轮作是次要因素。
454焦磷酸测序;多样性指数;β-多样性;细菌群落;烤烟连作
烟草连作导致其生长速度缓慢、烟株瘦小、烟叶产量和质量明显下降,连作障碍制约了烟草生产的可持续发展[1-2]。土壤理化性质的恶化、养分失调、微生物区系发生变化和植物化感自毒被认为是引起连作障碍产生的主要原因[3-6]。有研究表明不同栽培方式能够改变土壤的理化性状,引起土壤微生物群落结构的变化,而合理的轮作方式可以均衡地利用土壤养分,改善土壤环境、调节土壤肥力,进而增加作物的产量和改善品质[7]。
土壤微生物是土壤肥力状况的重要指标,因此对土壤微生物群落结构和功能的研究一直是土壤生态学研究的一个热点。传统的菌群结构分析方法基于纯培养技术,由于受限于培养条件,只能对土壤中1%可培养的微生物进行解析[8],而常用的分子生物学技术,如DGGE/TGGE、克隆文库等分析存在耗时耗力、通量低、分辨率差等不足[9-11]。近几年,新的测序技术发展迅速,如454 焦磷酸测序,已能实现单次反应获取100万个平均长度在400 bp 的序列片段,该技术已被广泛应用于人体和动物肠道菌群、土壤和海洋微生物菌群组成的比较分析中[12-14]。然而利用该技术研究烟草连作对土壤细菌群落变化的影响目前还鲜有报道。为此,本研究采用454高通量测序技术,以不同轮作方式种植的烟草为对照,研究烤烟连作下根际土壤细菌群落结构变化,探讨烟草不同种植制度对土壤细菌群落结构的影响,揭示烟草连作条件下土壤细菌群落的变化特征,从而为烟草连作障碍机理研究提供理论依据。
1 材料与方法
1.1 试验地概况
试验样地定于牡丹江烟草科学研究所实验站内(129°6’E,44°58.5’N)。试验地点属中温带大陆性季风气候,年平均气温4.0℃,平均降雨量427.5 mm,蒸发量为1635 mm。土壤类型为河淤土,土壤质地为壤土,中等肥力,土壤的养分状况为:碱解氮 98.00 mg·kg-1,速效磷 100.37 mg·kg-1,速效钾278.64 mg·kg-1,有机质2.10%,秋翻秋起垄。
1.2 试验设计
供试烤烟品种龙江911。本研究选3个不同轮作处理和1个烟草连作处理,分别是大豆-烟草(R3,轮作3年)、玉米-烟草(R4,轮作3年)、大豆-玉米-烟草(R6,轮作3年)和烟草连作处理(R8,连续3年种植)。试验小区为随机区组设计,4次重复,8行小区,行长6m,小区面积52.8m2。2012年5月10日覆膜移栽,于6月29日(旺长期)、7月17日(现蕾期)、8月24日(采收中期)和9月10日(采收末期)采集上述处理的烤烟根际土壤,每处理采集2株,采用抖根法搜集根际土,每处理4次重复收集的土样混合,放入带冰盒的保温箱中,带回实验室备用。其中部分样品放入-80℃冰箱中用于后期DNA提取。
1.3 试验方法
1.3.1 土壤DNA提取
采用E.Z.N.A Soil DNA(OMEGA,USA)试剂盒提取土壤微生物总DNA。具体方法为:称取 0.5 g保存在-80℃条件下的烟草根际鲜土,加入到试剂盒中的离心管内,采用 Min-Beadbeater 珠打法破碎微生物细胞,提取微生物DNA,提取的DNA 经70% 乙醇洗涤后,在15000 r/min、4 ℃条件下离心15 min,DNA沉淀于室温风干后,溶于100 μL TE缓冲液中,放在-20 ℃冰箱中保存。
1.3.2 细菌16S rDNA 454测序
以提取的土壤微生物总DNA为模板,针对细菌16S rDNA的V1-V3区,采用正向引物(B-27F)5′-CCT ATC CCC TGT GTG CCT TGG CAG TCC GACTAGA GTT TGA TCC TGG CTC AG-3′ 和反向引物(A-533R)5′-CCA TCT CAT CCC TGC GTG TCT CCG ACG ACTNNN NNN NNN NN TTA CCG CGG CTG CTG GCAC-3′进行PCR扩增[15]。上述核酸序列中斜体和下划线处为加在特异引物(用于扩增目标片段)前面的接头引物,Ns代表11个特异的 barcode 序列。PCR反应体系为:25 μL体系含0.5 μL (30 μ mol L−1),1.5 μL DNA模板,22.5 μL PCR Super Mix(Invitrogen,上海)。PCR反应条件为 94 ℃ 3 min;94℃ 30 s,55℃ 30 s,72 ℃ 30 s(35个循环);72 ℃ 10 min。每个样品做3次PCR扩增,扩增产物混合后利用胶纯化试剂盒(Agarose Gel DNA puri fi cation kit,TaKaRa)进行回收。PCR产物等摩尔混合后送到上海美吉生物公司利用Roche FLX 454测序仪进行测序分析。
考虑到454测序过程中会出现一些错误序列[16],在本研究中序列长度小于200 bp,质控数据小于25且与 RDP(Ribosomal Database Project)数据库相似性对比小于80%(http://pyro.cme.msu.edu/)的序列信息被删除掉。然后将得到的高质量序列利用 Mothur 软件(http://www.mothur.org)进行分类,本研究在97%的相似度水平上利用 Mothur 中 dist.Seqs 和 cluster 命令,采用基于序列相似度的方法将序列分为不同的可操作分类单元(OTU)。此外,α-多样性利用Mothur软件对 Chao 指数 Shannon和Simpson 指数进行分析。其中Chao指数是用chao1算法估计群落中含OTU数目的指数,chao1在生态学中常用来估计物种总数。Shannon和Simpson指数是用来估算群落中OTU多样性高低的群落多样性指数。Simpson指数值越大,说明群落多样性越低,而Shannon值越大,则说明群落多样性越高。由于不同处理间的测序量差异较大,本研究在进行β-多样性分析前,按照含有最少序列数目的处理随机抽取7000条序列后进行群落结构分析。
1.3.3 数据分析
基于97%的相似度水平上划分OTU后,各处理间的β-多样性分析通过R软件的“picante”和 “vegan” 包 实 现(R Development Core Team,2008),其中包括主成分PCA(Principal Component Analysis)和基于NMDS(non-metric multidimensional scaling)的聚类分析。细菌群落结构组成与PCA分析图谱分别采用Origin 8.1和Sigma-plot 2000绘图。
2 结果与分析
2.1 细菌群落结构分析
2.1.1 主要菌门群落结构分析
本研究共测得178603条有效序列,序列片段在474 bp 左右,平均每个样品的测序深度为11162条有效序列(7710-13317)。包括酸杆菌门(Acidobacteria)、 放 线 菌 门(Actinobacteria)、α-变形菌门(Alphaproteobacteria)、β-变形菌门(Betaproteobacteria)、拟杆菌门(Bacteroidetes)、绿湾菌门(Chloro fl exi)、芽单胞菌门(Gemmatimonadetes)和浮霉菌门(Planctomycetes)在内的8个菌门为烤烟根际的主要细菌类群(平均丰度>5%以上),其中α-变形菌门(Alphaproteobacteria)在各样本中所占比例为11.37%-22.09%,放线菌门(Actinobacteria)为6.87%-30.49%, 酸 杆 菌 门(Acidobacteria) 为7.64%-21.18%。可见,这3个门的细菌在烤烟根际细菌群落结构组成中占主要地位(图1)。对比不同处理3个菌门变化关系发现,连作处理酸杆菌门丰度在前两个生育期内分别比轮作处理平均值低35.38%和45.15%,而在采样后期比轮作处理平均值高13.83%。连作处理下的α-变形菌门和放线菌门与轮作处理相比在采样初期出现高丰度,随生育期的延长,这两个门细菌丰度出现下降的趋势。

图1 不同种植制度和生育期下烤烟根际土壤细菌群落结构组成Fig.1 Bacterial community compositions in the rhizosphere of fl ue-cured tobacco in different cropping systems and growth stages
2.1.2 痕量菌群落结构变化
除上述主要菌门外,在不同处理的烤烟根际共检测到28个丰度较低的其它菌门细菌类群,其中包括Armatimonadetes等在内的15个细菌门数量分别占到总菌量的1%左右(表1,图2)。对这15个细菌门相对丰度对比发现,不同种植制度下烤烟根际细菌数量的相对丰度有所波动,如在6月29号采集的样品,大豆-烟草轮作、玉米-烟草轮作和烟草连作下的Firmicutes菌门数量明显降低,而大豆-玉米-烟草轮作下该菌门数量呈上升趋势,除Firmicutes菌门外,不同处理下其它菌门在各生育期内也存在一定的变化关系,说明不同的种植制度改变了烟草根际细菌群落结构。对比不同采样期处理间菌群丰度变化发现,不同细菌菌门相对丰度在烟草生长的早期变化较明显,而随着生育期的推进菌门相对丰度变化趋于稳定,变化不大。该结果说明不同种植制度烤烟根际细菌群落结构的差异主要体现在烤烟生长的前期。

表1 烤烟根际细菌群落结构基于门水平上的分布比例Tab.1.Proportion (%) of different bacterial phyla in the rhizosphere of fl ue-cured tobacco %

续表1
2.2 多样性分析
不同的多样性指数可反映土壤微生物群落多样性的不同方面,其中Chao是计算菌群丰度的多样性指数,Shannon和Simpson指数能够对群落物种组成的均匀度和丰富度进行综合评价。不同种植制度下烟草根际细菌群落结构的多样性指数关系如表2所示。代表群落丰度的Chao指数和群落多样性的Shannon指数表现出相同的变化规律,即R3> R4> R6> R8,但处理间差异不显著,而与其它三种轮作方式相比,R8处理下的Simpson指数处于最大值,说明连作处理降低了细菌群落多样性。

图2 不同种植制度和生育期下烤烟根际土壤痕量菌相对丰度变化关系Fig.2 Changes of relative abundance of rare bacterial phyla in the rhizosphere of fl ue-cured tobacco in different cropping systems and growth stages

表2 烤烟根际细菌多样性指数分析Tab.2 Analysis of bacterial diversity indexes in the rhizosphere of fl ue-cured tobacco
2.3 根际细菌群落结构分析
不同样品烟草根际土壤细菌群落结构主成分分析结果如图3所示。主成分1和主成分2分别解释群落结构变异率为58.84%和8.57%。由图可知,供试样品在PCA图中按采样时期可以划分为三个集团,6月29日和7月17日采集的样品各为一个集团,而8月24日和9月10日采集的样品归为一个集团。在前两个集团中,不同种植制度处理较分散,而在后一个集团中,不同处理间分布相对集中,表明不同种植制度下烤烟根际细菌群落结构的差异主要体现为生育前期。由于主成分1与采样时期有关,且三个集团样品细菌群落结构随采样时间的变化在图3中以箭头的形式表示出来,所以相对于不同种植制度而言,烤烟生育期对烟草根际细菌群落结构影响更大。

图3 不同种植制度和生育期下烤烟根际土壤细菌群落结构的主成份分析图Fig.3 Principal component analysis of bacterial community in the rhizosphere of fl ue-cured tobacco in different cropping systems and growth stages
将各处理随机抽取7000条序列,基于97%相似水平下的非度量多维尺度NMDS(non-metric multidimensional scaling)距离矩阵的聚类分析结果与主成分分析结果相似,除第一采样期的R3处理外,各处理在聚类图谱中按不同采样时期分别聚为一类,且8月24日和9月10日样品相似度高。该结果进一步说明生育期是制约烤烟根际土壤细菌群落结构变化的主要因素(图4)。而相同采样期内R3与R4、R6与R8分别聚为一亚类,说明不同种植制度下细菌群落结构存在差异性,但这种差异性相对于生育期而言较小。
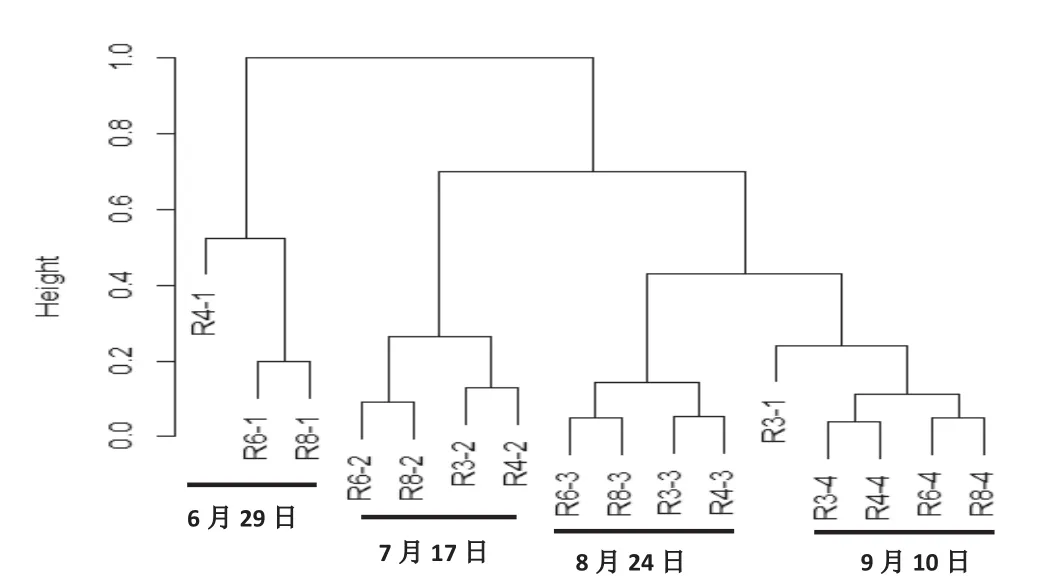
图4 不同种植制度和生育期下烤烟根际土壤细菌群落结构的聚类分析Fig.4 Cluster analysis of bacterial community in the rhizosphere of fl ue-cured tobacco in different cropping systems and growth stages
3 讨论与结论
454焦磷酸目前被认为是土壤微生物多样性研究中较好的方法[14]。本试验通过454高通量测序技术,对轮作和连作烤烟生长不同时期根际土壤细菌群落结构进行研究,共获得178603条有效序列,平均测序深度达到11162条有效序列,各处理Coverage指数均达到80%以上(表1),表明此次测序结果可以反应样本的真实情况。
已有研究结果表明连作后会导致土壤理化性质的恶化、养分失调、微生物区系发生变化和植物化感自毒作用[3]。关于微生物群落结构变化,岳冰冰、陈冬梅等对烟田土壤细菌群落多样性研究结果证实,连作可使土壤中鞘氨醇单胞菌属(Sphingomonas paucimobilis)、芽孢杆菌属(Bacillus subtilis)等有益菌数量减少,从而破坏微生物群落平衡,导致土壤连作障碍的发生[17-18]。本试验研究发现占细菌总量46.65%的α-变形菌门、放线菌门和酸杆菌门,为烟草根际的主要细菌类群。对比这三个主要菌门群落变化关系发现,除采样后期的酸杆菌门和采样初期α-变形菌门和放线菌门外,连作处理下的这三个主要菌门与轮作处理相比均呈明显下降趋势,而包括Armatimonadetes和BD1-5在内的11个痕量菌门(占总群落的1%左右)在连作处理下菌群数量与轮作处理相比也呈下降趋势。此外,代表菌群丰度的Chao指数和群落物种丰富度的Shannon指数在连作处理下均处于最低值,进一步说明连作处理降低了烟草根际细菌群落多样性。
连作作物在生长发育的过程中根系会不断的向环境释放大量的次生代谢产物,这些根系分泌物会导致土壤微生物区系发生变化[19]。有研究表明根系分泌物也受植物发育阶段的影响[20]。本研究对不同菌群相对丰度变化研究发现,细菌群落在烤烟生长的早期数量变化较大,而随着生育期的推进细菌群落相对丰度变化体现的不明显。此外,细菌群落结构变化的主成份分析图谱也显示不同处理间在采样初期差异较大,这一结论与养分胁迫下微生物群落结构变化在作物生长初期体现明显的结果一致[21]。根据这一结果,我们推测烤烟细菌群落结构变化在早期较明显可能与根系分泌物的差异有关。胡元森等采用培养和分子生物学技术对黄瓜不同生长发育期的根系微生物区系进行研究发现,黄瓜在生长前期根际微生物多样性最高,而随生育期的延长呈下降趋势,而这种变化特征与黄瓜生长发育过程中根系分泌物含量变化是一致,表明黄瓜根际微生物种群变化与根系分泌物有很大的关系[22]。此外,高欣欣对不同品种烤烟根系分泌物成分鉴定分析发现烤烟根系分泌物的主要成分是大分子有机酸类物质,其中酚类和酚酸类化合物是引起连作障碍的主要化学物质[23]。
主成分分析和基于NMDS的聚类分析结果显示,不同种植制度下细菌群落结构存在差异性,而生育期是影响群落结构变化的主要因素。其原因主要包括以下两个方面。第一随着作物生育期的延长,土壤温度、土壤湿度等环境条件的变化,导致微生物数量和群落结构发生变化[24]。其次不同生育期烤烟根系分泌物数量和种类变化导致根际土壤细菌群落结构变化[25]。虽然本试验对不同生育期根系分泌物的成分没有分析,已有研究证明随着生育期的延长根系分泌物的变化会导致微生物群落结构的改变[26-27]。此外,Maren等通过人工模拟根系环境并加入不同成分和数量的糖类和有机酸,结果直接证明了不同根系分泌物会导致微生物群落结构的改变[28]。
总之,本研究通过高通量测序技术解析了轮作和连作烤烟根际土壤细菌群落结构变化,发现烤烟连作降低了根际细菌群落多样性,连作与轮作导致的细菌群落结构差异以生育前期最明显,随着生育期推进,不同种植制度下烤烟根际细菌群落结构趋同。故此相对与不同的种植制度而言,烤烟生育期是影响根际细菌群落结构的主要因素,而连作与轮作是次要因素。
[1]石秋环,焦枫,耿伟,等.烤烟连作土壤环境中的障碍因子研究综述[J].中国烟草学报,2009,15(6):81-84.
[2]吴凤芝,赵凤艳,刘元英.设施蔬菜连作障碍原因综合分析与防治措施[J].东北农业大学学报,2000, 31(3):241-247.
[3]杨宇虹,陈冬梅,晋艳,等.连作烟草对土壤微生物区系影响的T-RFLP分析[J].中国烟草学报,2012,18(1):40-45.
[4]Aleman F.Common bean response to tillage intensity and weed control strategies [J].Agron J, 2001, 93: 556-563.
[5]张淑香,高子勤.连作障碍与根际微生态研究II.根系分泌物与酚酸物质[J].应用生态学报,2000,11(1):152-156.
[6]丁海兵.连作烤烟生长及不同粒级土壤酶活性的影响[D].重庆.西南大学2006.
[7]张心昱,陈利顶,傅伯杰,等.农田生态系统不同土地利用方式与管理措施对土壤质量的影响[J].应用生态学报,2007,18(2):303-309.
[8]Rappe M S, Giovannoni S J.The uncultured microbial majority [J].Rev Microbiol, 2003, 57: 369-394.
[9]Ward D M, Weller R, Bateson M M.16S rRNA sequences reveal numerous uncultured microorganisms in a nature community [J].Nature, 1990, 344: 63-65.
[10]Ferris M J, Muyzer G, Ward D M.Denaturing gradient gel electrophoresis profiles of 16SrRNA defined populations inhabiting a hotspring microbial mat community [J].Appl Environ Microbiol, 1996, 62(2): 340-346.
[11]Muyzer G, de-Waal E C, Uitterlinden A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reactionamplified genes coding for 16S rRNA [J].Appl Environ Microbiol, 1993, 59(3): 695-700.
[12]Sun Y J, Cai Y P, Liu L.ESPRIT: estimating species richness using large collections of 16S rRNA pyrosequences[J].Nucleic Acids Res, 2009, 37(10): e76.
[13]薛超,黄启为,凌宁,等.连作土壤微生物区系分析、调控及高通量研究方法[J].土壤学报,2011,48(3):612-616.
[14]Rafael S, Thomas B, Alexander G, et al.Insight into the plasmid metagenome of wastewater treatment plant bacteria showing reduced susceptibility to antimicrobial drugs analysed by the 454-pyrosequencing technology [J].J Biotechnol, 2008, 136: 54-64.
[15]Baker G, Smith JJ, Cowan DA, et al.Review and reanalysis of domain-specific 16S primers [J].J Microbiol Meth, 2003, 55: 541-555.
[16]Dohm J C, Lottaz C, Borodina T, et al.Substantial biases in ultra-short read data sets from high-throughput DNA sequencing [J].Nucleic Acids Res, 2008, 36: 1-10.
[17]陈冬梅,杨宇虹,晋艳,等.连作烤烟根际土壤自毒物质成分分析[J].草业科学,2011, 28(10):1766-1769.
[18]岳冰冰.烤烟连作改变了根际土壤微生物的多样性[D].东北林业大学,2012.
[19]齐泽民,卿东红.根系分泌物及其生态效应[J].内江师范学院学报.2005,20(2):68-73.
[20]罗睿,何刚.根系分泌物的研究现状及其在农业和环境中的应用[J].贵州农业科学,2011,39(4):48-51.
[21]刘俊杰,王光华,金 剑,等.磷浓度处理对大豆根际土壤微生物群落结构的影响[J].大豆科学,2008,27(5):801-805.
[22]胡元森,吴坤,刘娜,等.黄瓜不同生育期根际微生物区系变化研究[J].中国农业科学,2004,37(10):1521-1526.
[23]高欣欣,于会泳,张继光,等.烤烟根系分泌物的分离鉴定及对种子萌发的影响[J].中国烟草科学,2012,33(3):87-91.
[24]Nazih N, Finlay-Moore O, Hartel P G, et al.Whole soil fatty acid methyl ester (FAME) profiles of early soybean rhizosphere as affected by temperature and matric water potential [J].Soil Biol Biochem, 2001, 33: 693-696.
[25]Marschner P, Neumann G, Kania A, et al.Spatial and temporal dynamics of the microbial community structure in the rhizosphere of cluster roots of white lupin (Lupinus albusL.) [J].Plant Soil, 2002, 246: 167-174.
[26]Yang C H, Crowley D E.Rhizosphere microbial community structure in relation to root location and plant iron nutritional status [J].Appl Environ Microbiol, 2000, 66:345-351.
[27]Garbeva P, Veen J A V, Elsas J D V.Microbial diversity in soil: selection of microbial populations by plant and soil type and implications for disease suppressiveness [J].Annu Rev Phytopathol, 2004, 42: 243-270.
[28]Maren Z, Marion E, Gerhard W, et al.Development of a simple root model to study the effects of single exudates on the development of bacterial community structure [J].J Microbiol Meth, 2013, 94: 30-36.
Effects of rotational and continuous cropping on bacterial community structures in rhizospheric soil at different growth stages of fl ue-cured tobacco
QI Hongling1,HE Guoqiang2,LI Hengquan2, LIU Deyu2,SUN Hongyu2, YUAN Ye2
College of Life Science and Technology, Mudanjiang Normal University, Mudanjiang 157011, Heilongjiang, China;Mudanjang Tobacco Science Research Institute, Mudanjang 157011, Heilongjiang, China
In order to study effects of continuous cropping of flue-cured tobacco on rhizosphere bacterial community structures.Rhizosphere soils of rotation and continuous cropping of tobacco at different growth stages were collected.V1-V3 partial sequences of bacterial 16S rDNA were analyzed by 454 pyrosequencing method.Results showed that, compared with rotation treatments, the relative abundance of Acidobacteria was higher in earlier growth stages and lower in later stages in continuous cropping of fl ue-cured tobacco,while the relative abundances of α-proteobacteria and Actinobacteria showed the opposite.The community richness (Chao) and diversity(Shannon) in continuous cropping were lower than those in rotation, suggesting that continuous cropping reduced bacterial community diversity.Principal component analysis and cluster analysis based on non-metric multidimensional scaling showed that bacterial communities changed with tobacco growth stages, and difference of community between continuous cropping and rotation was detected in earlier growth stages, not in later stages, suggesting that growth stage was the primary factor and continuous cropping or rotation was the second factor in determining tobacco rhizosphere bacterial community.
454 pyrosequencing; diversity index; β-diversity; bacterial community; continuous cropping, fl ue-cured tobacco
齐虹凌,贺国强,李恒全,等.轮作与连作对烤烟不同生育期根际土壤细菌群落结构的影响[J].中国烟草学报,2015,21(5)
中国烟草总公司科技重大专项资助项目(110201101006(ts-06));公益性行业(农业)科研专项资助项目(201203091);黑龙江省烟草行业科技开发资助项目(HN201001,HN201303)
齐虹凌(1980—),硕士研究生,副教授,主要从事园林教学与研究,Email:swxqhl9@126.com
元野(1979—),硕士研究生,高级农艺师,主要从事烟草栽培学研究与技术推广,Tel:0453-6580216,Email: yuanye934@126.com
2015-03-09
:QI Hongling,HE Guoqiang, LI Hengquan, et al.Effects of rotational and continuous cropping on bacterial community structures in rhizospheric soil at different growth stages of fl ue-cured tobacco [J].Acta Tabacaria Sinica, 2015,21(5)
