绵羊MHCⅡ类基因遗传多态性研究进展
2015-11-24惠文巧侯宏艳汤继顺朱德建
惠文巧,侯宏艳,汤继顺,朱德建,班 谦,陈 胜
(1.安徽省农业科学院畜牧兽医研究所,合肥230031;2.安徽大学生命科学学院干细胞及转化医学研究中心)
绵羊MHCⅡ类基因遗传多态性研究进展
惠文巧1,侯宏艳1,汤继顺1,朱德建1,班谦2,陈胜1
(1.安徽省农业科学院畜牧兽医研究所,合肥230031;2.安徽大学生命科学学院干细胞及转化医学研究中心)
主要组织相容性复合体(major histocompatibility complex,MHC)是广泛存在于脊椎动物体内的一类高度紧密连锁的基因群,绵羊MHC又称为绵羊淋巴细胞表面抗原(ovine lymphocyte antigen,OLA),位于绵羊20号染色体上,分为Ⅰ类、Ⅱ类和Ⅲ类区域,其中MHCⅡ类基因具有高度的基因多态性。文章综述了绵羊MHCⅡ类基因的分子结构及遗传多态性,重点总结了近十年来国内外不同绵羊品种MHCⅡ类基因遗传多态性的研究进展,并对绵羊MHCⅡ类基因未来的研究重点进行了展望。
绵羊;MHCⅡ类基因;遗传多态性
1 绵羊MHCⅡ类基因的结构和特点
绵羊MHC又称为绵羊淋巴细胞表面抗原(ovine lymphocyte antigen,OLA),位于绵羊20号染色体上,分为Ⅰ类、Ⅱ类和Ⅲ类区域,目前,已证实Ⅰ类区域上有4个基因座;其编码产物分布于所有有核细胞表面,结合和递呈内源性抗原肽供CD8+T细胞,识别激活细胞毒性T淋巴细胞,杀死转化细胞或病毒感染细胞。OLAⅡ类区域基因座较多,OLAⅡ类区域基因成为研究热点,分别为:DRA、DRB(DRB1、DRB2、DRB3和DRB4)、DQA(DQA1和DQA2)、DQB(DQB1和DQB2)、DNA、DOB、DYA、DYB、 DMA和DMB,对应编码的MHCⅡ类分子主要分布于抗原递呈细胞表面,递呈经过处理的外源性抗原肽供CD4+T细胞,识别通过辅助性T细胞激活抗体免疫应答。尽管MHCⅡ类区域有很多基因结构,但是只有OLA-DR及OLA-DQ基因能够在蛋白质水平上被检测到。OLAⅡ类分子上DR和DQ亚区的DRB和DQB两个基因位点所编码的MHC抗原在其免疫系统中发挥着最主要的作用,其第2外显子编码抗原的功能区(抗原结合区),具有丰富的多态性,它组成OLAⅡ类抗原分子功能最重要的部分。OLAⅢ类区域基因由于其编码产物不参与抗原递呈,因此研究较少。
2 绵羊MHCⅡ类基因多态性研究进展
在绵羊MHC的3个区域中,Ⅱ类基因分类最为详细、研究最多。因染色体倒置,绵羊MHCⅡ类区域而被分为Ⅱa和Ⅱb两个亚区,其中Ⅱa亚区包含DRA、DRB1、DRB2、DRB3、DRB4、DQA1、DQA2、DQB1、DQB2等基因座,Ⅱb则包含DYA、DYB、DNA、DOB、DMA、DMB和TAPASIN基因座。其中,DR和DQ亚区的DRB和DQB两个基因位点所编码的MHC抗原在其免疫系统中发挥着最主要的作用,其第2外显子编码抗原的功能区(抗原结合区),具有丰富的多态性,它组成OLAⅡ类抗原分子功能最重要的部分。
2.1绵羊MHC-DR基因研究进展
MHCⅡ类区域上,OLA-DR基因座高度多态,这些基因在巨噬细胞和B细胞表面膜上编码的DR分子比DQ编码的分子含量高。MHC-DR基因座上,DRA基因仅有一个,相对研究较少,而DRB基因的研究较多,多集中于多态性上。DRB基因多见于DRB1和DRB3的研究。
2.1.1绵羊MHC-DRB1基因及其多态性研究进展近年来,绵羊MHC-DRB1基因多态性的研究备受国内外学者关注。彭林泽等[1]采用PCR-RFLP方法,对211只中国美利奴(新疆军垦型)羊的MHC-DRB1外显子2的遗传多态性进行检测,发现该基因在SacⅠ、Hin1Ⅰ和HaeⅢ的酶切位点存在多态性,这些酶切位点分别受2、2和6个等位基因控制,综合3种酶切结果,在中国美利奴(新疆军垦型)羊中共发现24种等位基因。温青娜等[2]采用PCR-SSCP方法对200只哈萨克绵羊MHC-DRB1外显子2进行多态性分析,共检测出15个等位基因和37种基因型。Li等[3]采用PCR-RFLP方法对702只哈萨克羊MHC-DRB1外显子2进行多态性分析,共检测出14种等位基因和28个基因型。徐飞等[4]采用PCR-SSCP方法分析了藏绵羊MHC-DRB1基因第3外显子多态性,结果检测出8个等位基因,其中等位基因B为优势等位基因,且高度多态,研究认为藏绵羊DRB1基因第3外显子具有丰富的多态性。肖娜等[5]采用PCR-RFLP方法分析了洼地绵羊MHC-DRB1基因外显子2多态性,经HaeⅢ酶切发现受5个等位基因控制,并发现了新的等位基因MHC-DRB1.D(225 bp/71 bp)。李洁[6]采用PCR-SSCP方法对甘肃高山细毛羊MHC-DRB1外显子2的多态性进行检测,检测到了6个等位基因。陈月娥等[7]采用PCR-SSCP方法对211只中国美利奴羊MHC-DRB1外显子2的多态性进行检测,共检测到41个SNPs位点。
Konnai等[8]检测3个绵羊品种(Suffolk,Cheviot,Corriedale)97只个体的DRB1基因座的遗传多样性,发现了18个已报道的等位基因和17个新的等位基因。Gruszczynska等[9]检测了101只波兰Heath羊和99只波兰洼地羊,分别发现了65个单倍型和68个单倍型。Nikbakht等[10]采用PCR-RFLP方法对伊朗3个品种的大尾羊(Lori-Bakhtiari,Shaul and Zandi)MHC-DRB1外显子2进行了检测,发现了24种不同基因型,直接测序发现了7个a、b、c、d、f、g、h等位基因。关于不同品种绵羊MHC-DRB1基因多态性的研究详见表1。
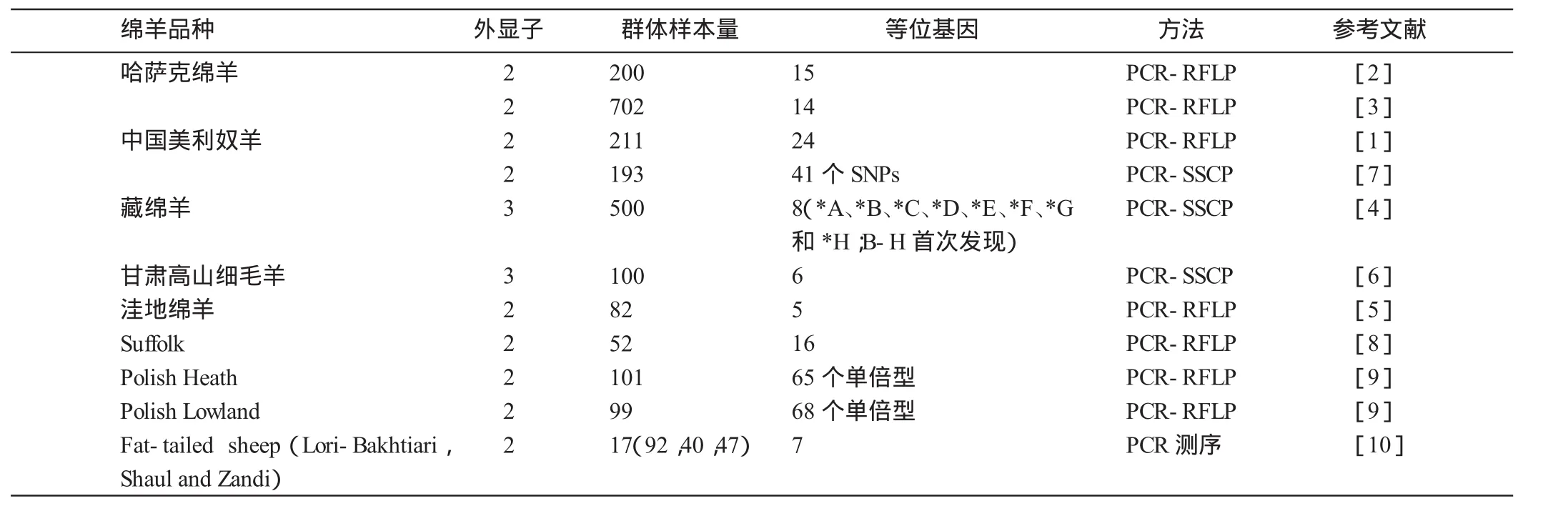
表1 国内外不同绵羊品种DRB1基因多态性研究进展
2.1.2绵羊MHC-DRB3基因及其多态性研究进展近年来,关于MHC-DRB3基因多态性的报道国内研究较多,孙东晓等[11]采用PCR-RFLP方法对蒙古羊和哈萨克羊MHC-DRB3基因第2外显子进行多态性分析,共检测到17种基因型,由A、B、C、D、E、F和H 7个复等位基因控制。刘云芳等[12]对新疆多浪羊OLA-DRB3基因通过TaqⅠ、PstⅠ和HaeⅢ酶切检测到了24种等位基因。尚友国等[13]采用PCR-RFLP方法对小尾寒羊MHC-DRB3基因第2外显子285 bp的扩增产物进行多态性分析,共检测到内切酶PstⅠ的3种基因型,由2个等位基因控制,通过酶切图谱分析结果表明,小尾寒羊的MHC-DRB3基因第2外显子的第241位的碱基表现出多态性,等位基因B的基因频率0.818 79。成述儒等[14]采用PCR-RFLP方法分析了藏绵羊MHC-DRB3基因第2外显子多态性,结果发现了37个等位基因,37个单倍型序列分析发现82个核苷酸多态位点;37个单倍型序列与GenBank下载序列对比分析,结果表明35个DRB3的等位基因属首次发现;37个DRB3基因外显子2的单倍型序列NJ系统发育树呈2支分化趋势。研究认为,藏绵羊DRB3基因第2外显子具有丰富的遗传多态性;藏绵羊DRB3基因最初是由2个等位基因突变分化成两大类等位基因的。买热帕提等[15]采用PCR测序方法首次对卡拉库尔羊的MHC-DRB3基因的第2外显子进行分子遗传多态性检测与分析,总共检测出35种单倍型,表明卡拉库尔羊具有很高的遗传多样性。关于不同品种绵羊MHC-DRB3基因多态性的研究详见表2。

表2 国内不同绵羊品种DRB3基因多态性研究进展
2.2绵羊MHC-DQ基因
2.2.1绵羊MHC-DQA基因及其多态性研究进展 绵羊MHCⅡ类区域内的DQ和DR两个基因家族表现丰富的多态性[16],MHC-DQ基因家族有2个DQA基因座位,即DQA1和DQA2基因,具有丰富的多态性[17]。由于对绵羊MHC的基因数目和分型研究还不完全,所以该基因座位上的新等位基因数也在不断增加。Snibson等[18]和Zhou等[19]揭示了9个DQA1和10个DQA2序列。
DQA1:成述儒等[20]采用PCR-SSCP方法检测了900只藏绵羊DQA1基因第2外显子多态性,发现了17个DQA1的等位基因,包括缺失的1种基因,其中5个为发现的新等位基因。见表3。Hickford等[16]对502只绵羊的DQA1基因座和40 000只绵羊的DQA2基因座进行研究,分别鉴定出12个DQA1和22个DQA2序列;在22个DQA2序列中发现一些序列与牛的DQA3和DQA4序列聚在一起,因此被称为DQA2-like序列;作者最终在这些绵羊中共检测出37个单倍型,其中23个是DQA1和DQA2的单倍型,另外还发现DQA2-like序列位于绵羊DQA1基因座中。
DQA2:Hickford等[21]利用PCR-SSCP方法检测了近2 000只绵羊的DQA2基因第2外显子的遗传多态性,把DQA2等位基因的数量从10个增加到23个。刘秀等[22]采用PCR-SSCP检测216只藏绵羊OLA-DQA2基因第2外显子的多态性,发现藏绵羊DQA2基因2外显子表现出15个基因型,受8个新等位基因控制,命名为OLA-DQA2*H、*I、*J、*K、*L、*M、*N和*O,使绵羊基因库中DQA2等位基因数量从23个增加到31个。详见表3。

表3 国内外不同绵羊品种DQA基因多态性研究进展
2.2.2绵羊MHC-DQB基因及其多态性研究进展 关于绵羊MHC-DQB基因的研究进展近年来多见于国内报道。申红等[23]采用PCR-RFLP方法研究了多浪羊MHCDQB1基因外显子2多态性,发现该基因在MroxⅠ、ScaⅠ、Sac1I、TaqⅠ、HaeⅡI和MvaⅠ酶切位点存在丰富的多态性,分别在其对应酶切位点检测出2、2、3、2、3、6种等位基因,3、3、5、2、5、14种基因型。Hui等[24]采用PCR-RFLP方法研究了中国美利奴羊MHC-DQB1基因多态性,发现了22个等位基因和42个基因型。相关绵羊MHC-DQB1基因多态性的研究详见表4。

表4 国内外不同绵羊品种DQB1基因多态性研究进展
3 绵羊MHC基因多态性研究的意义
3.1对品种进行遗传多样性分析
不同物种对环境的适应能力和进化潜力取决于遗传多样性水平的高低,同一物种不同种亦是如此,MHC基因的变异则可以反映物种或同一物种不同品种基因组水平的变异。因此,通过对绵羊MHC基因变异分析,可以很好地评估种群遗传多样性水平。
3.2MHC基因在绵羊育种方面的应用
3.2.1生产性能方面的应用由于MHC具有高度的多态性,使其与生产性能上的一些经济性状紧密联系,成为动物育种领域的前沿部分。Geldermann等[25]研究了MHC-DRB内含子2微卫星多态位点可以影响绵羊繁殖和生长性能。李建平[26]发现,MHC与绵羊管围性状有关。
3.2.2抗病力方面的应用研究表明,MHC在宿主的免疫反应中对外源微生物控制和清除有重要作用。近年来,越来越多的研究揭示了绵羊MHCⅡ类基因多态性在抗病毒、细菌、寄生虫病免疫中的作用。
4 展望
综上,我国拥有丰富的地方绵羊品种资源,很多品种拥有优良的种质特性,可以作为我国乃至世界上宝贵的育种素材。绵羊MHCⅡ类基因具有丰富的遗传多态性,目前作为一个良好的候选基因被广泛研究应用。因此,开展绵羊MHC基因多态性的研究,发现与优质生产性状、抗病性状相关的等位基因或单倍型,为改善绵羊品种、提高生产性能和抗病能力提供一定的理论基础。随着现代分子生物学技术的发展,SNPs的开发已经不局限于以往的RFLP、SSCP等,基因芯片、第2代测序等技术为寻找新的SNPs提供了先进的方法,有望在绵羊MHC基因的研究领域取得新的突破。
[1] 彭林泽,申红,贾斌,等.中国美利奴羊MHC-DRB1基因PCR-RFLP多态性分析[J].畜牧兽医学报,2007,38(10):1115-1119.
[2] 温青娜,贾斌,申红,等.哈萨克绵羊MHC-DRB1基因SSCP多态性与细粒棘球蚴病遗传抗性关联分析[J].中国人兽共患病学报,2010,26(9):805-809.
[3]Li R Y,Jia B,Zhang W J,et al.Analysis of the relationship between MHC-DRB1 gene polymorphism and hydatidosis in Kazakh sheep[J]. Asian-Austral J AnimSci,2010,23:1145-1151.
[4] 徐飞,成述儒,刘秀,等.藏绵羊MHC-DRB1基因第3外显子的PCR-SSCP检测及其序列分析[J].农业生物技术学报,2011,19(5):873-880.
[5] 肖娜,任艳玲,李敏,等.洼地绵羊MHC-DRB1基因PCR-RFLP多态性分析[J].动物医学进展,2011,32(5):63-68.
[6] 李洁.甘肃高山细毛羊微卫星亲子鉴定及DRB1基因第3外显子多态性研究[D].兰州:甘肃农业大学,2013.
[7] 陈月娥,苟亚峰,周路,等.中国美利奴羊MHC-DRB1基因exon2 SNPs及其与布鲁氏菌病易感性相关性[J].中国畜牧杂志,2014,50(1):15-20.
[8]Konnai S,Nagaoka Y,Takeshima S,et al.Sequences and diversity of 17 newOvar-DRB1 alleles from three breeds of sheep[J].European Journal ofImmunogenetics,2003,30(4):275-282.
[9] Gruszczyñska J,Brokowska K,Charon KM,et al.Restriction fragment length polymorphismofexon 2 Ovar-DRB1 gene in Polish Heath Sheep andPolishLowlandSheep[J].JApplGenet,2005,46(3):311-314.
[10]Nikbakht G,Rezaii H,Stear M J,et al.Allelic polymorphism in the second exon of Ovar-DRB1 in fat-tailed sheep[J].The Veterinary Journal,2012,192(3):547-549.
[11]孙东晓,张沅,李宁.蒙古绵羊和哈萨克绵羊MHC-DRB3基因外显子2的多态性[J].遗传学报,2003,30(8):761-765.
[12]刘云芳,剡根强,王新峰.多浪羊MHC-DRB3基因座的PCR-RFLP多态性分析[J].遗传,2004,26(1):59-62.
[13]尚友国,宋美玲,李建平,等.小尾寒羊MHC-DRB3基因外显子2的多态性分析[J].中国畜牧兽医,2006,33(2):36-38.
[14]成述儒,罗玉柱,胡江.藏绵羊DRB3基因第2外显子多态性分析[J].农业生物技术学报,2010,18(5):925-930.
[15]买热帕提·帕拉提,马合木提·哈力克.卡拉库尔羊MHC-DRB3基因的遗传多样性研究[J].生物技术,2011,21(2):35-39.
[16]Hickford J G,Zhou H,FangQ.Haplotype analysis ofthe DQA genes in sheep:evidencesupportingrecombinationbetweentheloci[J].American SocietyofAnimal Science,2007,85(3):577-582.
[17]Scott P C,Gogolin-Ewens KJ,Adams TE,et al.Nucleotide sequence,polymorphism,and evolution of ovine MHC classⅡDQA genes[J]. Immunogenetics,1991,34(2):69-79.
[18]Snibson K J,Maddox J F,Fabb S A,et al.Allelic variation of ovine MHC classⅡDQA1 and DQA2 genes[J].Animal Genetics,1998,29(5):356-362.
[19]Zhou H,Hickford J G.Allelic polymorphism in the ovine DQA1 gene[J].American SocietyofAnimal Science,2004,82(1):8-16.
[20]成述儒,罗玉柱,胡江,等.藏绵羊DQA1基因多态性分析[J].中国农业科学,2011,44(10):2146-2153.
[21]Hickford J GH,SlowS.Diversityofthe ovine DQA2 gene[J].American SocietyofAnimal Science,2004,82(6):1553-1563.
[22]刘秀,胡江,罗玉柱.藏绵羊基因OLA-DQA2第2外显子多态性分析[J].中国农业科学,2009,42(8):2930-2936.
[23]申红,杜迎春,贾斌,等.多浪羊MHC-DQB1基因多态性与包虫病的抗性分析[J].中国人兽共患病学报,2009,25(1):17-20.
[24]Hui W,Shen H,JiangS,et al.MHC-DQB1 variation and its association with resistance or susceptibility to cystic echinococcosis in Chinese Merino Sheep[J].Asian-Australasian Journal of Animal Sciences, 2012,25(12):1660-1666.
[25]Geldermann H,Mir M R,Kuss A W,et al.OLA-DRB1 microsatellite variants are associated with ovine growth and reproduction traits[J]. Genetics Selection Evolution,2006,38(4):431-444.
[26]李建平.绵羊MHC基因微卫星多态性及其与生产性状关系的研究[D].泰安:山东农业大学,2006.
Progress in the Polymorphism of Ovine MHC Class II Gene
Hui Wenqiao,Hou Hongyan,Chen Sheng,et al
(Institute ofAnimal Husbandryand VeterinaryMedicine,Anhui AcademyofAgricultural Sciences,Hefei 230031,China)
Major histocompatibilitycomplex(MHC),is an organized cluster oftightly-linked genes widelydistributed in the vertebrates.In sheep,it is alsocalled ovine lymphocyte antigen(OLA).OLA is located on chromosome 20,comprising class I,II and III regions.Among the three regions,genes in the MHC class II are highly polymorphic.The present study reviewed the MHC class II gene structure and genetic polymorphism.In this review,the recent advances of MHC Class II gene polymorphism both in domestic and foreign sheep breeds were summarized,and its research field in the future were prospected.
sheep;MHC class II;genetic polymorphism
S826.2
A
2095-3887(2015)01-0047-04
10.3969/j.issn.2095-3887.2015.01.015
2014-11-03
国家自然科学基金项目(31402048);安徽省农业科学院院长杰出青年基金项目(14B0403);安徽省农业科学院博士启动基金项目
惠文巧(1986-),女,助理研究员,博士。
陈胜,副研究员,主要从事动物遗传育种与繁殖研究。
