恩施烟区烟田生态系统CO2通量变化特征分析
2015-11-23戴衍晨王瑞张继光高林申国明张继旭查婷于海容李志刚向必坤孟贵星
戴衍晨,王瑞,张继光,高林,申国明,张继旭,查婷,于海容,李志刚,向必坤,孟贵星
1中国农业科学院烟草研究所,农业部烟草生物学与加工重点实验室,青岛市科苑经四路11号 266101;2中国农业科学院研究生院,北京市中关村南大街12号 10081;3湖北省烟草公司恩施州分公司,恩施市施州大道119号 445000
恩施烟区烟田生态系统CO2通量变化特征分析
戴衍晨1,2,王瑞3,张继光1,高林1,申国明1,张继旭1,查婷1,于海容1,李志刚1,2,向必坤3,孟贵星3
1中国农业科学院烟草研究所,农业部烟草生物学与加工重点实验室,青岛市科苑经四路11号 266101;2中国农业科学院研究生院,北京市中关村南大街12号 10081;3湖北省烟草公司恩施州分公司,恩施市施州大道119号 445000
为深入了解烟田生态系统CO2通量的时空变化规律,采用静态箱-红外CO2分析法研究了烟草团棵期、旺长期、平顶期、采收期及采收结束后共5个时期的垄体-烟株系统、垄间土壤及烟田生态系统CO2通量日变化特征。结果表明:垄体-烟株系统CO2通量具有明显的日变化特征(采收结束后除外),通量变化呈“U”型分布,日间以吸收CO2为主,吸收高峰出现在12:00左右,夜间以排放为主,其呼吸通量与温度呈显著的正相关;采收结束后系统全天表现为CO2的净排放。垄间土壤CO2通量日变化呈单峰型,峰值出现在14:00左右,通量变化与土壤温湿度间存在显著的相关关系。整个烟田生态系统的CO2通量日变化规律与垄体-烟株系统趋于一致,通量日变化幅度及CO2日净吸收量随生育期表现不同,平顶期CO2通量日变化幅度最大,吸收峰值最高,为-2419.48 mg·m-2·h-1,CO2日净吸收量大小为平顶期>采收期>旺长期>团棵期,表现为碳汇,而采收结束后则表现为碳源。
烟田生态系统;CO2通量;特征分析;静态箱法;日变化
目前以气候变暖为主要特征的全球变化已成为国际公认的事实,人类活动引起的温室气体排放已成为导致气候变暖的重要原因,其中农业生产是温室气体的主要排放源[1-2],因此农田生态系统的固碳减排是减少农业温室气体排放的重要途径[3]。农田生态系统碳循环已成为目前关注的热点问题[4-5],国内外关于农田生态系统CO2通量变化及源/汇关系的报道已有很多,主要集中在玉米、水稻、小麦等农田生态系统中[6-10]。烟草作为我国重要的经济作物之一,其种植面积和总产量位居世界第一位[11],烟田生态系统作为农田生态系统的重要组成,而关于烟田生态系统CO2通量变化报道较少,王树键等[12]曾研究了平顶期烟田生态系统日间CO2通量变化。24 h的日通量及季节动态变化研究未见报道。因此,深入开展烟田生态系统CO2通量的时空变化规律研究,对评价烟田生态系统CO2收支能力与碳源/汇关系具有重要意义。本文利用静态箱-红外CO2分析法观测了恩施烟区烟草主要生育期烟田生态系统CO2通量的日变化,并分析了其对气温及土壤温湿度的响应,以期为烟田生态系统CO2通量的源/汇状况及其对未来气候变化的响应提供科学依据。
1 材料与方法
1.1 试验地点概况
试验地位于湖北省恩施州“清江源”现代烟草农业科技园区望城坡村(30°19′N,109°25′E)海拔1203.0 m,属于亚热带季风和季风性湿润气候,多年平均气温13.3oC,降雨量1435.0 mm。区域土壤为黄棕壤,pH值6.9,有机质11.1 g·kg-1,碱解氮 85.6 mg·kg-1,速效钾 118.7 mg·kg-1,速效磷 22.7 mg·kg-1。
烟苗于2013年4月28日进行“井窖式”移栽,品种为云烟87,株距×行距为0.55 m×1.2 m,垄高为0.25 m,垄宽为0.6 m。施肥情况为纯氮用量为120 kg·hm-2,m(N):m(P2O5):m(K2O)=1:1.5:3,70%的氮、钾肥和100%磷肥施于底肥,30%氮、钾肥用于移栽后30 d左右结合培土施用。
1.2 CO2通量的测定
采用静态箱-红外CO2分析法,测定仪器为便携式红外CO2分析仪(型号为ST-303,广州市盈翔嘉仪器仪表有限公司)。本研究中的静态箱分为透明箱与暗箱两种,透明箱用于测定垄体-烟株系统CO2通量,暗箱用于测定垄间土壤CO2通量。透明箱的设计参考了朱咏莉等[13]设计的静态箱,并根据垄作作物特征进行了改进,将透明箱体基座设计为马鞍形,可跨埋在垄体上,基座上有回形水槽,水槽内贮水以隔绝箱内外气体交换(图1)。透明箱及暗箱均为自制,箱体框架为不锈钢,透明箱四周及顶部为透明有机玻璃,暗箱采用不透明塑料板制成,均用硅胶垫密封并通过水压测试。透明箱与暗箱的尺寸分别为55 cm×60 cm×165 cm和55 cm×60 cm×30 cm,箱体一侧上部有一连接口与CO2分析仪连接,箱顶都装有一个直径15 cm的风扇(12 V电池供电)用来混匀气体。于2013年的烟草团棵期(6月12日)、旺长期(6月28日)、平顶期(7月16日)、采收期(8月21日)和采收结束后(9月15日)共计5个时期,分别测定垄体-烟株系统及垄间土壤CO2的浓度变化量,以计算CO2通量,每个生育期间隔2 h测定一次,观测12次。
在测定的前一天,选出试验田中生长势均匀具有田间代表性的3棵烟株,在尽量不扰动土壤的前提下,去除垄体及垄间待测区域表面杂草。次日测定时将透明箱与暗箱分别罩在选定的垄体(含1棵烟株)及垄间土壤上,并将箱体基座插入地下不少于5 cm深度,然后用土填满箱体与土壤的接触缝隙并压实,以保证密封性。测定前开动箱顶风扇,使箱内气体混匀。再连接红外CO2分析仪,测定箱内0 min、5 min、10 min CO2浓度值,重复测定2次。测定CO2浓度的同时,使用JM624数字温度计(天津今明有限公司)测量箱体内及10 cm和20 cm的土层温度,0~10 cm和10~20 cm的土壤含水量使用TSZ-1水分速测仪(武汉天联科教仪器发展有限公司)测量。

图1 透明箱示意图与田间装置图Fig.1 Schematic diagram of transparent chamber and fi eld device
1.3 CO2通量的计算

式中F为CO2通量,单位为mg·m-2·h-1;ρ为标准状态下CO2密度,即1.963 g·L-1;H为箱体有效高度(m);P0为标准状态下的大气压(1.01×105Pa);P和T为测定时箱内的实际气压和气温;dCt/dt为单位时间(h)箱内气体浓度(µL·L-1)的变化量。
1.4 统计分析
数据的整理与分析使用Excel 2010和SAS 9.2。
CO2通量与气温、土壤温度间关系,采用回归分析法,回归模型如下:

式中y为CO2通量(mg·m-2·h-1),t为温度(℃),k为温度反应系数。
2 结果与分析
2.1 垄体-烟株系统CO2通量日变化特征及对温度的响应
2.1.1 垄体-烟株系统CO2通量日变化特征
由图2可以看出,不同生育期(采收结束后除外)垄体-烟株系统CO2通量变化规律基本一致,日间通量值主要为负,夜间为正,通量变化呈“U”型分布。早上7:00左右通量值出现负值,表明系统开始从大气中净吸收CO2,随着太阳角度的升高,光辐射的增强,烟株光合能力迅速增加,中午12:00左右通量值达到最小,说明此时系统净吸收CO2速率最大。下午则随着光照强度的不断降低,光合作用也逐步减弱,通量值逐渐增大。19:00左右通量值为0,说明此时光合作用与呼吸作用达到动态平衡状态。19:00~7:00(次日)通量值为正,通量变化幅度较稳定。采收结束后CO2通量值昼夜均为正,说明此时CO2通量主要来源于土壤的呼吸作用。

图2 不同生育期垄体-烟株系统CO2通量日变化Fig.2 Diurnal variation of CO2 fl uxes in the ridge-tobacco system at different growing stages
2.1.2 夜间垄体-烟株系统呼吸对温度的响应
本试验采用简单的指数方程(式2)对不同生育期夜间垄体-烟株系统呼吸通量与气温(Ta)、10 cm土层温度(T10)及20 cm土层温度(T20)分别进行拟合,结果表明系统呼吸通量与各温度因子间均呈显著的正相关(p<0.01)(表1)。团棵期夜间系统呼吸通量与Ta的决定系数R2较与T10、T20间高,而其他4个时期,则与T10间表现出较高的相关性。从呼吸通量与温度间敏感性Q10值(Q10=e10×k)来看,在各生育期中,夜间系统呼吸通量与T20的Q10值最大,说明夜间系统呼吸对T20变化更敏感。考虑到T20变化范围较Ta和T10小以及呼吸通量与温度因子间相关性大小,综合以上分析,团棵期时的气温和另外4个时期的10 cm土层温度能分别较好的反映夜间垄体-烟株系统呼吸。
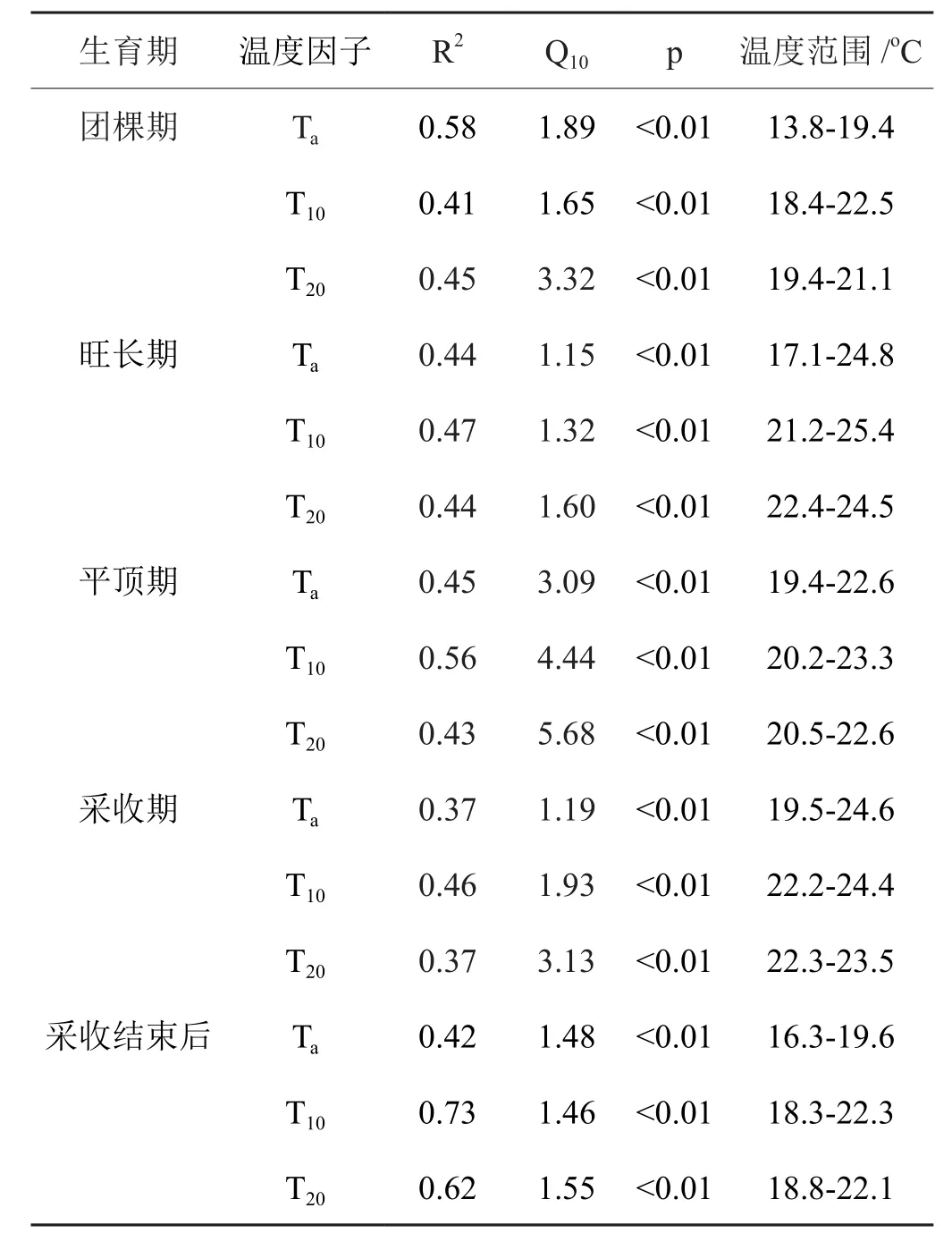
表1 不同生育期夜间垄体-烟株系统CO2通量与温度的拟合关系Tab.1 Relationship between CO2 fl uxes in the ridge-tobacco system and temperature at different growing stages
2.2 垄间土壤CO2通量日变化特征及对土壤温湿度的响应
由图3可以看出,各生育期垄间土壤CO2通量日变化规律较为一致,总体变化呈单峰型,夜间土壤呼吸通量基本维持在较低水平,早上6:00左右,开始随着气温与土壤温度的变化,土壤CO2通量呈先增后缓慢降低的趋势,各个生育期时的土壤CO2通量高峰一般出现在14:00左右,这与当地最高温出现的时间一致。关于垄间土壤CO2通量与不同土层温湿度间关系分别如图4、图5所示。

图3 垄间土壤CO2通量日变化Fig.3 Diurnal variation of CO2 fl uxes in the soil between ridges
随着土壤10 cm、20 cm土层温度的增加,土壤CO2通量呈增加趋势,通量变化与10 cm和20 cm土层温度均呈显著的正相关(p<0.01)(图4),决定系数R2分别为0.75与0.42,Q10值分别为2.75与2.67,差异不大,因此,两种不同土层温度中,10 cm土层温度能较好的解释土壤CO2通量变化。由图5可以看出,土壤CO2通量与0~10 cm及10~20 cm土壤含水量呈显著的负相关(p<0.01),说明随着土壤湿度的增加,土壤CO2通量降低,且通量变化与两层土壤湿度的决定系数R2分别达到了0.47与0.53,说明0~20 cm土壤湿度也是影响土壤CO2通量的重要因素。
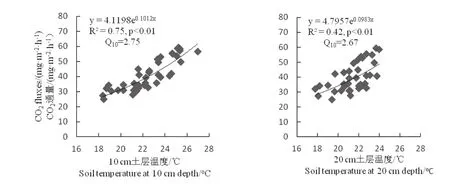
图4 土壤CO2通量与土壤10 cm及20 cm土层温度的关系Fig.4 Relationship between soil CO2 fl uxes and soil temperature at 10 cm and 20 cm depth

图5 土壤CO2通量与0~10 cm及10~20 cm土壤含水量的关系Fig.5 Relationship between soil CO2 fl uxes and soil moisture at 0-10 cm and 10-20 cm depth
2.3 不同生育期烟田生态系统CO2通量动态变化
综合以上分析,整个烟田生态系统CO2通量可以用垄体-烟株系统CO2通量与垄间土壤CO2通量观测值之和来表示。由图6可以看出,不同生育期烟田生态系统CO2通量的日变化特征与垄体-烟株系统(图2)趋于一致。烟田生态系统CO2通量日变化幅度在不同生育期中存在一定差异,其中烟草团棵期时叶面积指数较小,光合与呼吸作用都较弱,CO2通量日变化幅度较小,仅为 -583.15~281.31 mg·m-2·h-1。随着烟草进入旺长期,此时CO2通量日变化幅度较团棵期时有所增大,为 -904.55~354.71 mg·m-2·h-1,其中CO2吸收峰值是团棵期的1.55倍。平顶期时CO2通量日变化幅度最大,达到-2419.48~594.82 mg·m-2·h-1。采收期时(平均剩余9.3片叶)CO2通量日变化幅度为 -983.34~350.28 mg·m-2·h-1,吸收峰值明显小于平顶期而与略大于旺长期。烟叶采收结束后,生态系统全天表现为CO2的净排放,排放速率变化幅度较为平稳。

图6 不同生育期烟田生态系统CO2通量日变化Fig.6 Diurnal variation of CO2 fl uxes in the whole tobacco fi eld ecosystem at different growing stages
通过估算烟田生态系统在不同生育期与大气CO2的日净交换量,可以分析该系统的CO2日收支能力。图7表明了烟田生态系统CO2日收支能力在不同生育期的差异,团棵期、旺长期、平顶期、采收期CO2日净交换量分别为 -1.87 g·m-2·d-1、-3.19 g·m-2·d-1、-15.71 g·m-2·d-1、-4.98 g·m-2·d-1,大小为平顶期 > 采收期 >旺长期>团棵期,表现为碳汇,采收结束后,CO2日净交换量为 2.75 g·m-2·d-1,则表现为碳源。

图7 不同生育期烟田生态系统CO2日净交换量Fig.7 Daily net ecosystem exchange of CO2 fl uxes in the whole tobacco fi eld ecosystem at different growing stages
3 讨论
3.1 烟田生态系统CO2通量对温湿度的响应
通常认为生态系统呼吸对温度的响应呈指数增长趋势,一般主要以温度与呼吸的相关性或决定系数来评价选取合适的温度指标[15]。不同生育期反映夜间垄体-烟株系统呼的合适温度指标略有不同,可能的原因是,夜间呼吸强度直接受控于热量条件,气温和土壤温度升高都会促进植物和土壤微生物的新陈代谢,从而加强系统CO2排放的强度[16]。一般认为,土壤呼吸作用主要来源于植物根系呼吸及土壤微生物呼吸两大部分[17],而烟田垄间土壤中一般无烟株根系,因此垄间土壤呼吸相对较弱。有研究表明土壤温度与水分影响土壤微生物活性,是影响土壤CO2通量动态变化最为密切的因子[18-19]。通常认为土壤呼吸与土壤温度之间呈显著的正相关[20],本试验结果亦表明烟田垄间土壤CO2通量与10cm及20cm土层温度呈显著的正相关,土壤Q10值为2.67~2.75,介于Raich等[21]研究发现全球土壤Q10值范围(1.3~3.3)内。垄间土壤CO2通量与0~10 cm及10~20 cm土壤含水量呈显著负相关,可能原因是垄间土壤较为贫瘠,缺乏外界能源的输入,而0~20 cm土壤含水量在16%以上,从而导致随着土壤湿度的增加,土壤微生物呼吸减弱。也有研究结果显示土壤CO2通量对土壤水分的响应结果不一致[22],这是由于土壤呼吸是温度、降水、土壤特性等环境因素综合作用的结果,而且这些因素在时空尺度上存在较大的异质性。
3.2 烟田生态系统CO2通量变化规律
本试验结果表明垄体-烟株系统CO2通量是整个烟田生态系统CO2通量的主要贡献者。烟田生态系统CO2通量日变化总体呈“U”型分布,峰值出现在中午12:00左右,与玉米、晚稻、小麦农田生态系统[6,8-9]表现基本一致。平顶期为烟株生长的最旺盛时期,叶片已完全开片,而且气温较6月份有所增强,因此该时期生态系统CO2吸收峰值及夜间呼吸通量达到最大。采收期时CO2吸收峰值明显小于平顶期,原因为平顶期后叶片从下而上开始逐渐成熟,并被渐次采收,观测时平均剩余9.3片叶,叶面积指数的大幅度降低,从而造成光合能力明显降低。而其吸收峰值略大于旺长期,其原因一方面是采收期的叶面积指数和光合能力尚高于旺长期;另一方面可能是旺长期正值当地的雨季,多云的天气下太阳辐射有所减弱,也会造成CO2的吸收峰值有所减弱[13],从而导致旺长期的日间CO2通量测量值偏小。平顶期为烟田生态系统净吸收CO2峰值时期,CO2日净交换量为-15.71 g·m-2·d-1,该值小于淮河流域麦田、稻田生态系统及张掖灌区玉米农田生态系统(分别为-43.12 g·m-2·d-1,-38.13 g·m-2·d-1, -33.66 g·m-2·d-1)[16,23]。 其 可 能原因是:一方面是测量方法的不同,本文使用静态箱法,后者使用涡度相关法,两种方法的研究结果存在一定差异[24];另一方面与测量地点的气候、光合辐射及不同作物的种植密度、生物量及其光合特性相关。本文仅是恩施坡地烟田的试验结果,关于烟田生态系统CO2通量变化的规律性结论还需要多地点的研究结果来验证,而且烟田生态系统CO2通量的影响机制也需要进一步深入研究。
4 结论
(1)垄体-烟株系统CO2通量具有明显的日变化特征,通量变化呈“U”型分布,日间通量主要为负值,峰值出现在12:00左右,夜间通量为正值,且通量与温度呈显著的正相关。
(2)垄间土壤CO2通量日变化呈单峰型分布,夜间通量变化较稳定,日间通量主要随着温度的变化而变化,峰值出现在14:00左右,土壤CO2通量与土壤温湿度有着显著的相关关系,其中10 cm土层温度较20 cm土层温度影响土壤CO2通量尤甚。
(3)不同生育期烟田生态系统CO2通量日变化幅度及CO2日收支能力存在一定差异:平顶期生态系统CO2通量变化幅度最大,吸收峰值最高,为-2419.48 mg·m-2·h-1;团棵期至采收期生态系统 CO2日净吸收量大小为平顶期>采收期>旺长期>团棵期,表现为碳汇;采收结束后,生态系统净排放CO2,表现为碳源。
[1]IPCC. Climate change 2007-the physical science basis:Working group I contribution to the fourth assessment report of the IPCC[M]. Cambridge University Press, 2007.
[2]李迎春, 林而达, 甄晓林. 农业温室气体清单方法研究最新进展[J]. 地球科学进展, 2007, 22(10): 1076-1080.
[3]唐海明, 汤文光, 肖小平, 等. 中国农田固碳减排发展现状及其战略对策[J]. 生态环境学报, 2010, 19(7): 1755-1759.
[4]张玉铭, 胡春胜, 张佳宝, 等. 农田土壤主要温室气体(CO2, CH4, N2O)的源/汇强度及其温室效应研究进展[J].中国生态农业学报, 2011, 19(4): 966-975.
[5]Hutchinson J J, Campbell C A, Desjardins R L. Some perspectives on carbon sequestration in agriculture[J].Agricultural and Forest Meteorology, 2007, 142(2): 288-302.
[6]梁涛, 李荣平, 吴航, 等. 玉米农田生态系统CO2通量的动态变化[J]. 气象与环境学报, 2012, 28(3): 49-53.
[7]朱咏莉, 童成立, 吴金水, 等. 亚热带稻田生态系统CO2通量的季节变化特征[J]. 环境科学, 2007, 28(2): 283-288.
[8]王尚明, 胡继超, 吴高学. 等. 亚热带稻生态系统CO2通量特征分析[J]. 环境科学学报, 2011, 31(1): 217-217.
[9]彭记永, 胡继超, 刘荣花, 等. 麦田CO2通量, 热通量特征分析[J]. 河南农业科学, 2012, 41(4): 15-19.
[10]Steduto P, Cetinkku O, Albrizio R, et al. Automated closed-system canopy-chamber for continuous field- crop monitoring of CO2and H2O fluxes[J]. Agricultural and Forest Meteorology,2002, 111(3): 171-186.
[11]刘国顺. 烟草栽培学[M]. 北京: 中国农业出版社, 2003:14-15.
[12]王树键, 王瑞, 申国明, 等. 湖北恩施烤烟平顶期烟田碳通量日变化研究[J]. 中国烟草科学, 2013, 34(6): 43-48.
[13]朱咏莉, 童成立, 吴金水, 等. 透明箱法监测稻田生态系统CO2通量的研究[J].环境科学, 2005, 26(6): 8-14.
[14]尹春梅, 谢小立, 王凯荣. 稻草覆盖对冬闲稻田二氧化碳通量的影响[J]. 应用生态学报, 2008, 19(1): 115-119.
[15]朱咏莉, 吴金水, 童成立, 等. 稻田CO2通量对光强和温度变化的响应特征[J]. 环境科学, 2008, 29(4): 1040-1044.
[16]张蕾, 孙睿, 乔晨, 等. 张掖灌区玉米农田生态系CO2通量的变化规律和环境响应[J]. 生态学杂志, 2014, 33(7):1722-1728.
[17]韩广轩, 周广胜. 土壤呼吸作用时空动态变化及其影响机制研究与展望[J]. 植物生态学报, 2009, 33(1): 197-205.
[18]陈全胜, 李凌浩, 韩兴国, 等. 水分对土壤呼吸的影响及机理[J]. 生态学报, 2003, 23(5): 972-978.
[19]张东秋, 石培礼, 张宪洲. 土壤呼吸主要影响因素的研究进展[J]. 地球科学进展, 2005, 20(7): 778-785.
[20]韩广轩, 周广胜, 许振柱, 等. 玉米地土壤呼吸作用对土壤温度和生物因子协同作用的响应[J]. 植物生态学报,2007, 31(3): 363-371.
[21]Raich J W, Potter C S. Global patterns of carbon dioxide emissions from soils[J]. Global Biogeochemical Cycles,1995, 9(1): 23-36.
[22]邓东周, 范志平, 王红, 等. 土壤水分对土壤呼吸的影响[J]. 林业科学研究, 2009, 22(5): 722-727.
[23]李琪, 胡正华, 薛红喜, 等. 淮河流域典型农田生态系统碳通量变化特征[J]. 农业环境科学学报, 2009, 28(12):2545-2550.
[24]宋涛, 王跃思, 赵晓松, 等. 三江平原农田夜间呼吸的涡度相关法和箱法观测比对[J]. 环境科学, 2007,28(8): 1854-1860.
Characteristic analysis of CO2fl ux variation in Enshi tobacco-growing fi eld ecosystem
DAI Yanchen1,2,WANG Rui3,ZHANG Jiguang1,GAO Lin1,SHEN Guoming1*,ZHANG Jixu1,ZHA Ting1,YU Hairong1,LI Zhigang1,2,XIANG Bikun3,MENG Guixing3
1 Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Key Laboratory of Tobacco Biology and Processing, Ministry of Agriculture, Qingdao 266101, China;2 Graduate School, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3 Hubei Enshi Branch Tobacco Company, Enshi 445000, China
In order to facilitate better understanding of spatial-temporal variation of CO2fluxes in tobacco field ecosystem, diurnal variation of CO2fl uxes in the ridge-tobacco system, and the soil between ridges and the whole tobacco fi eld ecosystem at fi ve different tobacco growing stages (rosette stage, vigorous growing stage, fl at stage, harvest stage, and after- harvest stage) were measured respectively by using a closed chamber technique (infrared CO2analyzer). Results showed that the ridge-tobacco system showed signi fi cant diurnal variation at all stages, except after-harvest stage, and CO2fl uxes curve presented a “U” pattern. In daytime the system mainly absorbed CO2, reaching peak at about 12:00, while at night it released CO2, and a significant positive correlation was found between rate of CO2emission and temperature. At after-harvest stage, the system only showed CO2emission in daytime. The diurnal variation of CO2fl uxes in soil between ridges showed a single peak curve, with peak at about 14:00. There was signi fi cant correlation between CO2fl uxes in soil between ridges and soil temperature and moisture at different depths. The diurnal variation of CO2fl uxes in the whole tobacco fi eld ecosystem was consistent with that in the ridge-tobacco system. However, the range of CO2fl uxes variation and daily net absorption of CO2fl uxes were different at different growing stages. The maximal range of CO2fl uxes occurred at fl at stage with maximum value of -2419.48 mg·m-2·h-1. Daily net absorption of CO2amount at different growing stages was in the following order: fl at stage>harvest stage>vigorous growing stage>rosette stage. It was displayed in the form of carbon sink at the above four growing stages, and was regarded as carbon source at after-harvest stage.
tobacco fi eld ecosystem; CO2fl uxes; characteristic analysis; closed chamber technique; diurnal variation
戴衍晨,王瑞,张继光,等. 恩施烟区烟田生态系统CO2通量变化特征分析[J]. 中国烟草学报,2015,21(4)
中国烟草总公司科技重点项目“‘清江源’生态富硒特色烟叶生产关键技术研究与应用”(110201202014);国家自然科学基金(41201291)
戴衍晨(1990—),在读硕士研究生,主要研究方向为土壤生态,Email:dyc514232@163.com
申国明(1964—),研究员,主要从事烟草栽培与生态研究,Email:ycssgm@163.com
2014-08-02
:DAI Yanchen,WANG Rui,ZHANG Jiguang, et al. Characteristic analysis of CO2fl ux variation in Enshi tobacco-growing fi eld ecosystem [J]. Acta Tabacaria Sinica, 2015, 21(4)
