自噬介导肿瘤多药耐药的研究进展*
2015-11-23王彬彬武承凤张方信马强
王彬彬武承凤张方信马强
·国家基金研究进展综述·
自噬介导肿瘤多药耐药的研究进展*
王彬彬①②武承凤①②张方信①马强①
多药耐药(multidrug resistance,MDR)的出现限制了化疗药物的临床应用及疗效,已成为化疗成功的最大障碍。MDR的发生机制复杂多样,主要有三磷酸腺苷结合盒膜转运蛋白家族、抗凋亡或DNA修复增强、药物靶点或代谢酶改变、微小RNA、肿瘤干细胞及自噬等。自噬通过形成自噬溶酶体降解细胞质中损伤的细胞器及蛋白质并循环利用代谢产物,具有维持细胞内环境稳定及机体平衡的重要意义。近来研究发现,自噬与MDR的病理生理进程密切相关。本文就自噬与MDR的相互作用及其分子机制进行综述,希望从自噬水平了解MDR的发生进程,为治疗MDR提供新思路。
自噬 肿瘤 多药耐药
肿瘤治疗后的复发已经成为临床上常见的问题,其中的原因包括肿瘤细胞产生多药耐药(multi⁃drug resistance,MDR)现象。MDR是肿瘤细胞通过各种策略以逃避抗癌药物的细胞毒作用,而且耐药性与肿瘤细胞种类及化疗药物的结构及其作用机理密切相关[1]。虽然对于肿瘤靶向药物治疗的认识尚不完善,但开发低毒性并克服MDR的新型抗癌制剂是肿瘤学研究的主要目标[2]。目前已有多种机制来描述和解释在哺乳动物细胞中的多药耐药现象[3]。
自噬是机体出现应激、损伤、缺氧等病理生理反应后的一种调控严谨的细胞代谢过程和自我保护机制。自噬在肿瘤细胞发生过程中的作用复杂,很多研究集中于肿瘤进展及治疗中的自噬作用,并阐明如何调整自噬来治疗肿瘤[2-3]。
1 自噬调控
1.1自噬定义及分类
自噬是一种进化上保守的过程,主要涉及溶酶体酶降解已受损细胞器和蛋白质的代谢来维持细胞稳态。在应激条件下可诱导高水平的自噬,通常在细胞死亡时自噬水平高表达,因此认为自噬可充当细胞死亡的执行者[4]。自噬作为一种细胞死亡的机制一直备受争议,在特定的环境中自噬可以促进细胞死亡。由于不同信号通路之间的广泛交通,导致了自噬促进细胞死亡的复杂性[5]。在哺乳动物细胞中自噬主要分为3大类型:巨自噬、小自噬和分子伴侣介导的自噬,而研究最多的是巨自噬(简称自
噬)。自噬的特殊形式是膜运输(图1)[6],首先在细胞质内形成一个芽形的隔离膜,然后延伸并螯合细胞器和大分子,将其称为前自噬结构;当其形成一个完整的封闭双层膜结构时称为自噬体;自噬体经过一系列的成熟事件后与溶酶体融合,在溶酶体水解酶的作用下降解所包含的物质,消化形成的氨基酸、脂肪酸和核苷酸再被循环利用,合成细胞所需的大分子[2]。自噬体膜的来源可以是内质网(ER)、线粒体和高尔基体,目前尚不清楚哪个是主要来源[7]。
1.2自噬调控机制
多种自噬相关基因(autophagy-related genes,ATG)参与自噬的形成过程。主要包括为5个阶段(图1):1)自噬的起始阶段,主要由UNC-51样激酶-1(UNC-51-like kinase-1,ULK-1)的磷酸化激酶复合物(包括ULK-1、ATG3和ATG17)触发,而且当细胞损伤或存在功能障碍时,自噬通过哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin 1,mTOR 1)复合物激活;2)活化的ULK-1复合物激活磷脂酰肌醇-4,5-二磷酸3-激酶(phosphatidylinositol-4,5-bisphosphate 3-kinase,PI3K)复合物(包括PI3K、Be⁃clin-1、ATG14L和Ambra1),形成一个双膜的自噬囊泡;3)自噬囊泡在ATG12-ATG5-ATG16L-1和微管相关蛋白轻链3(microtubule-associated protein light chain 3,MAP-LC3)-磷脂(phosphatidylethanolamine,PE)复合体两个泛素样结合系统的帮助下逐步延伸和闭合,逐渐发展成熟形成自噬体;4)一个成熟的自噬体外膜与溶酶体融合形成自噬溶酶体;5)自噬降解阶段,自噬溶酶体体内包裹的线粒体和蛋白质被SQSTM1/p62选择性识别;SQSTM1/p62蛋白包含LC3作用区域和泛素相关结构域,最终通过自噬选择性降解泛素化物质;自噬通过调节SQSTM1/p62蛋白调控抗氧化应激、炎症反应、细胞生长和凋亡[4-8]。
1.3引起自噬的主要因素
1.3.1营养物质缺乏当细胞营养物质缺乏不足以支持新陈代谢时,细胞内增高的钙离子浓度激活调钙素,活化钙/钙调蛋白依赖性蛋白激酶激酶ß,并激活PI3K、ATG3和ATG5而诱导自噬[9]。调钙素还通过激活死亡相关蛋白激酶促进Beclin-1的磷酸化,进而激活Beclin-1诱导自噬[10]。
1.3.2缺氧在缺氧条件下,活化的缺氧诱导因子通过Beclin-1/Bcl-2/Bcl-xL复合体激活蛋白相互作用蛋白3(protein-interacting protein 3,BNIP3)/ BNIP3L;活化的BNIP3/BNIP3L通过结合Bcl-2/BclxL诱导Beclin-1分离[11],促进自噬的活化。另外,缺氧诱导因子还通过miRNA-210下调Bcl-2的表达增强自噬活性,降低肿瘤细胞对辐射的敏感性[12]。
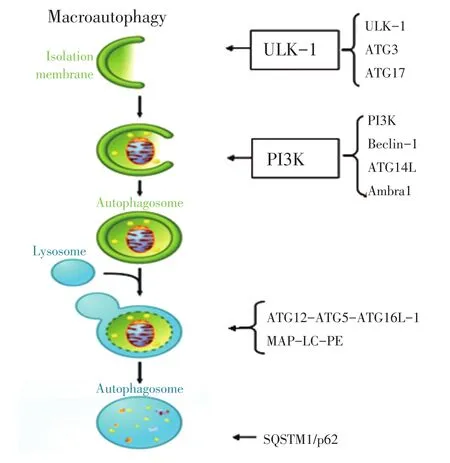
图1 自噬调控机制Figure 1Mechanism of autophagy regulation
1.3.3细胞毒性增加在细胞毒性的威胁下,p53作为转录因子被激活,并促进自噬相关转录因子Ses⁃trin 1/2、结节性硬化症的基因1/2和5'单磷酸腺苷活化蛋白激酶β1/β2的激活,进一步抑制mTOR信号通路激活自噬[13];然而在正常条件下,细胞质中无活性的p53通过ARF转录因子抑制自噬[14]。
2 MDR形成机制
MDR是由于肿瘤细胞群为了自我生存而抵抗多种药物形成的一种自我保护机制,并且是目前联合化疗非常重要的一个问题,其已成为恶性肿瘤化疗失败的主要原因之一。肿瘤细胞通过改变质膜上、细胞质或细胞核内功能结构及作用机制降低对化疗药物的敏感性而形成MDR[15]。由于多种机制间的相互交通,使MDR变得更加复杂,但细胞中通常有一个主要机制发挥作用。MDR机制主要包括非细胞机制和细胞机制两大类(图2)[15]。
2.1非细胞机制
非细胞耐药机制现象与某些实体瘤血管分布有关。实体瘤中,诱导肿瘤血管生成相关因子的结构和功能出现异常,如血管内皮生长因子和血管生成素的不平衡,导致血管形成缺乏,形成的缺血区域可对化疗药物起抵抗作用[16]。因此,肿瘤的血流量比较混乱,从而导致肿瘤细胞耐受缺氧和酸性环境,产生耐药性[17]。
2.2细胞机制
在细胞中的MDR机制尚未研究清楚。常见的耐药途径主要有三磷酸腺苷结合盒(adenosine triphos⁃
phate-binding cassette,ABC)膜转运蛋白家族将药物被主动运输到细胞外,由于细胞表面受体或转运体缺失导致药物不能进入细胞内、抗凋亡、损伤DNA修复增强或DNA甲基化、药物靶点或代谢酶改变、微小RNA(microRNA)突变、肿瘤干细胞过度增殖及自噬等多种调控方式[3,15,18],这些关键基因、蛋白在遗传学上发生的突变是导致耐药性的主要机制。其中自噬与肿瘤细胞对化疗药物的敏感程度密切相关,自噬已成为肿瘤耐药研究领域一个热点。
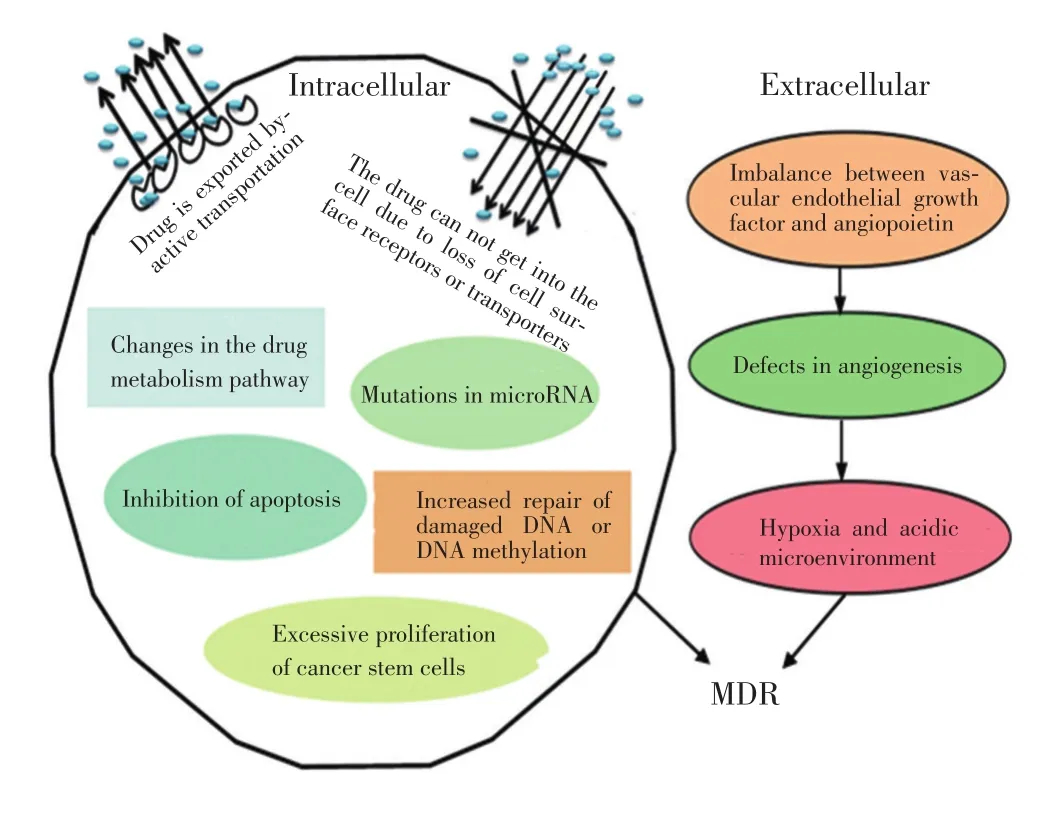
图2 MDR形成机制Figure 2Mechanism of MDR development
3 保护性自噬主要参与MDR的形成
越来越多的证据表明,自噬在化疗中起到显著作用,化疗药物通过多种细胞相关信号通路参与自噬调控,有助于肿瘤细胞逃避其杀伤作用产生MDR[19-21]。但自噬参与MDR的形成过程机制复杂,需待进一步研究。
3.1自噬相关基因参与MDR的形成
最近研究发现,多种自噬相关基因参与急性髓系白血病、肺癌、胃癌、食管癌、骨肉瘤、卵巢癌等人类肿瘤细胞获得MDR过程中扮演着重要角色[22-28]。Beclin-1基因的异位表达联合mTOR抑制剂通过激活自噬水平抑制肿瘤细胞的生长[23]。ATG3、ATG5、ATG7、SQSTM1/p62基因的高表达与多药耐药蛋白密切相关;当抑制或敲出这些自噬相关基因后,可增加化疗药物的敏感性,提高化疗效果[24-28]。因此,自噬相关基因可作为MDR形成的主要因素之一,但是具体相关机制尚不明确,有待进一步研究。
3.2PI3K/Akt/mTOR信号通路双重诱导自噬
PI3K/Akt/mTOR是肿瘤细胞生存的重要调节通路。因此,通过多种方法干预PI3K/Akt/mTOR的活性逆转肿瘤细胞的耐药性。NVP-BEZ235是一种新型的PI3K和mTOR双重抑制剂,通过抑制这条信号通路的相关蛋白,增强自噬通量,阻滞细胞周期,抵抗实体瘤的耐药性[29-30]。双青蒿素也通过抑制mTOR的活化诱导保护性自噬,是卵巢癌细胞产生耐药性[31]。另外,内源性高迁移率族蛋白-1(high mobility group box-1,HMGB1)通过激活PI3K/Akt信号通路诱导保护性自噬促进肿瘤细胞耐药性[32-33]。因此,靶向PI3K/Akt/mTOR信号-自噬途径是一种克服化疗耐药和增强抗癌敏感性的方法。
3.3p53的多型性诱导自噬
众所周知,p53是肿瘤抑制基因之一,其突变与放化疗的失败而产生MDR密切相关。野生型及突变型p53通过自噬的双重作用调节卵巢癌细胞的耐药性。突变型p53采用自体吞噬杀灭耐药的卵巢癌细胞,而野生型p53抑制自噬并逆转MDR[34]。Amrein等[35]研究发现,慢性淋巴细胞白血病细胞通过p53诱导保护性自噬,产生达沙替尼的耐药性,而突变的p53可抑制自噬的发生。最近一项研究发现,缺失或突变的p53通过诱导自噬增强结肠癌细胞对5-FU耐药性,其机制可能是活化的JNK诱导Bcl-2磷酸化激活自噬相关信号通路而导致耐药的发生[36]。以上结果表明p53可能参与自噬形成介导耐药性的发生。
3.4MAPK信号转导系统的激活诱导自噬
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是哺乳动物细胞内广泛存在的一类丝氨酸/苏氨酸蛋白激酶,MAPK信号转导通路是介导细胞外刺激到细胞内反应的重要信号转导系统,调节着细胞的增殖、分化、凋亡和细胞间相互作用。研究发现,MAPK通路在肿瘤化疗耐药中发挥着重要的作用,抗肿瘤药物能够引起MAPK信号转导系统的激活,诱导保护性自噬及MDR的产生[37-38]。
3.5ERK/NF-κB信号的活化诱导自噬
ERK信号通路是MAPK家族的重要成员,控制着细胞多个生理过程。NF-κB最初在免疫球蛋白kap⁃pa轻链增强因子中得以确认的一种转录因子蛋白,可见于不同细胞的胞浆,为结构上相关的家族蛋白。MAPK/ERK激酶的激酶1(MAPK/ERK kinase ki⁃nase,MEKK1)在ERK与NF-κB信号通路的相互关联中起着中介作用。Zhang等[39]研究发现,异黏蛋白(metadherin,MTDH)可能通过活化ERK/NF-κB信号通路及减少caspas-3降解,诱导宫颈癌细胞产生自噬参与MDR的形成。
3.6EGFR抑制自噬
表皮生长因子受体(epidermal growth factor re⁃ceptor,EGFR)是酪氨酸激酶受体,通过多种媒介物质启动繁杂信号通路,调节细胞内环境稳态。最近研究表明,EGFR通过结合Beclin-1导致多位点酪氨酸
磷酸化,降低Beclin1-PI3K的活性而抑制自噬,导致肿瘤细胞产生耐药性;TKI是EGFR酪氨酸激酶的抑制,通过可扰乱酪氨酸磷酸化而恢复自噬,增强EG⁃FR突变化疗的敏感性[40]。自噬抑制剂联合TKI可通过EGFR靶点提高肿瘤治疗的敏感性[41-42]。因此,结合传统的化疗策略,通过EGFR信号靶向抑制肿瘤耐药的自噬水平,有希望提高肿瘤耐药治疗的疗效。
3.7miRNA抑制自噬增强化疗的敏感性
miRNA是内源性非编码RNA,主要负责靶基因的转录后的调节,通过3'非翻译区(3'UTR)的特定序列介导翻译水平的调控[43]。通过研究miRNA调控肿瘤细胞耐药性,探索miRNA在人类肿瘤治疗中的潜能具有现实意义。不同种类的miRNA通过各种相关的靶基因或蛋白间接抑制自噬成熟障碍,诱导自噬性死亡,增强耐药肿瘤细胞对化疗药物的敏感性,以提高化疗疗效[44-49]。另外,抑制miRNA的表达可上调自噬表达,最终导致通过溶酶体途径加速ABC转运蛋白的降解,从而逆转乳腺癌细胞对多柔比星耐药性[50]。miRNA、自噬和抗肿瘤治疗三者之间的关系复杂,目前尚未得到很好的阐明,但是miRNA可能会成为化疗耐药的关键点。
4 结语
MDR是一个复杂的、动态的和无形的现象,已成为癌症治疗成功的主要障碍。虽然关于自噬的促存活或抗癌的作用存在争议,在体外和体内的数据似乎更支持自噬促进癌细胞对化疗耐药性的观点,而且抑制自噬可增强耐药癌细胞对抗癌药物的敏感性。自噬在MDR中的双重机制仍待进步一研究,自噬抑制剂与细胞毒性药物的联合应用在癌症治疗中越来越受到重视。然而自噬抑制剂克服肿瘤耐药的能力,以及如何调控肿瘤微环境仍存在许多问题。如,如何在癌症治疗中设法定量增强或抑制自噬?如何最大限度地将自噬抑制剂应用于更严格的临床研究中?如何研制新一代有效低毒的自噬抑制剂?这些问题都是今后研究自噬与MDR的方向,希望给癌症患者提供一个有前途的治疗策略。
[1]Sun YL,Patel A,Kumar P,et al.Role of ABC transporters in can⁃cer chemotherapy[J].Chin J Cancer,2012,31(2):51-57.
[2]Kumar P,Zhang DM,Degenhardt K,et al.Autophagy and trans⁃porter-based multi-drug resistance[J].Cells,2012,1(3):558-575.
[3]Wu Q,Yang Z,Nie Y,et al.Multi-drug resistance in cancer che⁃motherapeutics:mechanisms and lab approaches[J].Cancer Lett,2014,347(2):159-166.
[4]Yonekawa T,Thorburn A.Autophagy and cell death[J].Essays Biochem,2013,55:105-117.
[5]Gong JS,Kim GJ.The role of autophagy in the placenta as a regu⁃ lator of cell death[J].Clin Exp Reprod Med,2014,41(3):97-107.
[6]Mizushima N,Komatsu M.Autophagy:renovation of cells and tissues[J].Cell,2011,147(4):728-741.
[7]Lavallard VJ,Gual P.Autophagy and non-alcoholic fatty liver disease[J].Biomed Res Int,2014,2014:120179.
[8]Mallat A,Lodder J,Teixeira-Clerc F,et al.Autophagy:a multi⁃faceted partner in liver fibrosis[J].Biomed Res Int,2014,2014:869390.
[9]Crawford SE,Hyser JM,Utama B,et al.Autophagy hijacked through viroporin-activated calcium/calmodulin-dependent ki⁃nase kinase-β signaling is required for rotavirus replication[J]. Proc Natl Acad Sci U S A,2012,109(50):E3405-E3413.
[10]Zalckvar E,Berissi H,Eisenstein M,et al.Phosphorylation of Be⁃clin 1 by DAP-kinase promotes autophagy by weakening its in⁃teractions with Bcl-2 and Bcl-XL[J].Autophagy,2009,5(5):720-722.
[11]Hu YL,DeLay M,Jahangiri A,et al.Hypoxia-induced autopha⁃gy promotes tumor cell survial and adaptation to antiangiogenic treatment in glioblastoma[J].Cancer Res,2012,72(7):1773-1783.
[12]Sun Y,Xing X,Liu Q,et al.Hypoxia-induced autophagy reduc⁃es radiosensitivity by the HIF-1α/miR-210/Bcl-2 pathway in colon cancer cells[J].Int J Oncol,2015,46(2):750-756.
[13]Budanov AV,Karin M.p53 target genes sestrin1 and sestrin2 connect genotoxic stress and mTOR signaling[J].Cell,2008,134(3):451-460.
[14]Abida WM,Gu W.p53-Dependent and p53-independent acti⁃vation ofautophagy by ARF[J].Cancer Res,2008,68(2):352-357.
[15]Saraswathy M,Gong S.Different strategies to overcome multi⁃drug resistance in cancer[J].Biotechnol Adv,2013,31(8):1397-1407.
[16]Yu JL,Coomber BL,Kerbel RS.A paradigm for therapy-in⁃duced microenvironmental changes in solid tumors leading to drugresistance[J].Differentiation,2002,70(9-10):599-609.
[17]Harguindey S,Arranz JL,Polo Orozco JD,et al.Cariporide and other new and powerful NHE1 inhibitors as potentially selective anticancerdrugs-anintegralmolecular/biochemical/metabolic/ clinical approachafter one hundred years of cancer research[J].J Transl Med,2013,11:282.
[18]Niero EL,Rocha-Sales B,Lauand C,et al.The multiple facets of drug resistance:one history,different approaches[J].J Exp Clin Cancer Res,2014,33:37.
[19]Zeng X,Zhao H,Li Y,et al.Targeting Hedgehog signaling path⁃way and autophagy overcome drug resistance of BCR-ABL-positive chronic myeloid leukemia[J].Autophagy,2015,11(2):355-372.
[20]Lefort S,Joffre C,Kieffer Y,et al.Inhibition of autophagy as a new means of improving chemotherapy efficiency in high-LC3B triple-negative breast cancers[J].Autophagy,2014,10(12):2122-2142.
[21]Chen S,Jiang YZ,Huang L,et al.The residual tumor autophagy marker LC3B serves as a prognostic marker in local advanced breast cancer after neoadiuvant chemotherapy[J].Clin Cancer
Res,2013,9(24):6853-6862.
[22]Cheng J,Chen J,Xie B,et al.Acquired multidrug resistance in human K562/ADM cells is associated with enhanced autophagy[J].Toxicol Mech Methods,2013,23(9):678-683.
[23]Eum KH,Lee M.Targeting the autophagy pathway using ecto⁃pic expression of Beclin 1 combination with rapamycin in drugresistant v-Ha-ras-transformed NIH 3T3 cells[J].Mol Cells,2011,31(3):231-238.
[24]Ge J,Chen Z,Huang J,et al.Upregulation of autophagy-related gene-5(ATG-5)is associated with Chemoresistance in human gastric cancer[J].PLoS One,2014,9(10):e110293.
[25]Lee JG,Wu R.Combination erlotinib-cisplatin and ATG3-me⁃diated autophagy in erlotinib resistant lung cancer[J].PLoS One,2012,7(10):e48532.
[26]Zhu L,Du H,Shi M,et al.ATG7 deficiency promote apoptotic death induced by Cisplatin in human esophageal squamous cell carcinomacells[J].Bull Cancer,2013,100(7-8):15-21.
[27]Shen C,Wang W,Tao L,et al.Chloroquine blocks the autophagic process in cisplatin-resistant osteosarcoma cells by regulating theexpression of p62/SQSTM1[J].Int J Mol Med,2013,32(2):448-456.
[28]Yu H,Su J,Xu Y,et al.p62/SQSTM1 involved in cisplatin resis⁃tance in human ovariancancer cells by clearing ubiquitinated pro⁃teins[J].Eur J Cancer,2011,47(10):1585-1594.
[29]Kim KW,Myers CJ,Jung DK,et al.NVP-BEZ-235 enhances radiosensitization via blockade of the PI3K/mTOR pathway in cisplatin-resistant non-small cell lung carcinoma[J].Genes Cancer,2014,5(7-8):293-302.
[30]Li JR,Cheng CL,Yang CR,et al.Dual inhibitor of phosphoinositide 3-kinase/mammalian target of rapamycin NVP-BEZ235 effectively inhibitscisplatin-resistant rothelial cancer cell growth through au⁃tophagic flux[J].Toxicol Lett,2013,220(3):267-276.
[31]Feng X,Li L,Jiang H,et al.Dihydroartemisinin potentiates the anticancer effect of cisplatin via mTOR inhibition in cisplatin-re⁃sistant ovariancancer cells:involvement of apoptosis and autoph⁃agy[J].Biochem Biophys Res Commun,2014,444(3):376-381.
[32]Yang L,Yu Y,Kang R,et al.Up-regulated autophagy by endog⁃enous high mobility group box-1 promotes chemoresistance in leukemia cells[J].Leuk Lymphoma,2012,53(2):315-322.
[33]Meng X,Thiel KW,Leslie KK.Drug resistance mediated by AEG-1/MTDH/LYRIC[J].Adv Cancer Res,2013,120:135-157.
[34]Kong D,Ma S,Liang B,et al.The different regulatory effects of p53 status on multidrug resistance are determined by autophagy in ovariancancer cells[J].Biomed Pharmacother,2012,66(4):271-278.
[35]Amrein L,Soulières D,Johnston JB,et al.p53 and autophagy con⁃tribute to dasatinib resistance in primary CLL lymphocytes[J]. Leuk Res,2011,35(1):99-102.
[36]Sui X,Kong N,Wang X,et al.JNK confers 5-fluorouracil resis⁃tance in p53-deficient and mutant p53-expressing colon cancer cells by inducingsurvival Autophagy[J].Sci Rep,2014,4:4694.
[37]Paillas S,Causse A,Marzi L,et al.MAPK14/p38α confers irino⁃tecan resistance to TP53-defective cells by inducing survival au⁃tophagy[J].Autophagy,2012,8(7):1098-1112.
[38]de la Cruz-Morcillo MA,Valero ML,Callejas-Valera JL,et al. P38MAPK is the balance between apoptosis a major determinant of and autophagy triggered by 5-fluorouracil:implication in resis⁃tance[J].Oncogene,2012,31(9):1073-1085.
[39]Zhang J,Zhang Y,Liu S,et al.Metadherin confers chemoresis⁃tance of cervical cancer cells by inducing autophagy and activat⁃ing ERK/NF-κBpathway[J].Tumour Biol,2013,34(4):2433-2440.
[40]Wei Y,Zou Z,Becker N,et al.EGFR-mediated Beclin 1 phos⁃phorylation in autophagy suppression,tumor progression,and tu⁃mor chemoresistance[J].Cell,2013,154(6):1269-1284.
[41]Zou Y,Ling YH,Sironi J,et al.The autophagy inhibitor chloro⁃quine overcomes the innate resistance of wild-type EGFR nonsmall-cell lungcancer cells to erlotinib[J].J Thorac Oncol,2013,8(6):693-702.
[42]Han W,Pan H,Chen Y,et al.EGFR tyrosine kinase inhibitors activate a autophagy as cytoprotective response in human lung cancer cells[J].PLoS One,2011,6(6):e18691.
[43]Gisel A,Valvano M,El Idrissi IG,et al.miRNAs for the detec⁃tion of multidrug resistance:overview and perspectives[J].Mole⁃cules,2014,19(5):5611-5623.
[44]Yu Y,Yang L,Zhao M,et al.Targeting microRNA-30a-mediat⁃ed autophagy enhances imatinib activity against human chronic myeloid leukemia cells[J].Leukemia,2012,26(8):1752-1760.
[45]Zou Z,Wu L,Ding H,et al.MicroRNA-30a sensitizes tumor cells to cis-platinum via suppressing beclin 1-mediated autopha⁃gy[J].J Biol Chem,2012,287(6):4148-4156.
[46]Li X,Wang S,Chen Y,et al.miR-22 targets the 3'UTR of HMGB1 and inhibits the HMGB1-associated autophagy in os⁃teosarcoma cells duringchemotherapy[J].Tumour Biol,2014,35(6):6021-6028.
[47]Zhang H,Tang J,Li C,et al.MiR-22 regulates 5-FU sensitivity by inhibiting autophagy and promoting apoptosis in colorectal cancer cells[J].Cancer Lett,2015,356(2):781-790.
[48]Pan B,Chen Y,Song H,et al.Mir-24-3p downregulation con⁃tributes to VP16-DDP resistance in small-cell lung cancer by targeting ATG4A[J].Oncotarget,2014,6(1):317-331.
[49]Pennati M,Lopergolo A,Profumo V,et al.miR-205 impairs the autophagic flux and enhances cisplatin cytotoxicity in castrationresistant prostate cancercells[J].Biochem Pharmacol,2014,87(4):579-597.
[50]Wang Z,Wang N,Liu P,et al.MicroRNA-25 regulates chemo⁃resistance-associated autophagy in breast cancer cells,a process modulated by the natural autophagy inducer isoliquiritigenin[J]. Oncotarget,2014,5(16):7013-7026.
(2015-01-13收稿)
(2015-04-08修回)
(编辑:周晓颖)
Research progress on tumor multidrug resistance regulated by autophagy
Binbin WANG1,2,Chengfeng WU1,2,Fangxin ZHANG1,Qiang MA1
Fangxin ZHANG;E-mail:zhangfx59@126.com
Multidrug resistance(MDR)limits the clinical application and efficacy of chemotherapy drugs.Thus,MDR is the biggest obstacle to the success of chemotherapy.Complex and diverse MDR mechanisms exist,including the following:adenosine triphosphate-binding cassette membrane transport protein family,anti-apoptotic or enhanced DNA repair,mutations in drug targets or metabolic enzymes,microRNA,and cancer stem cells.Autophagy can degrade organelles and proteins that have been damaged in the cytoplasm through the formation of autolysosome and recycle metabolites.Maintaining intracellular homeostasis and a balanced internal environment is highly significant.Recent studies found that autophagy is closely related to the pathophysiology of MDR.The interaction between autophagy and MDR and the possible molecular mechanisms underlying these phenomena are reviewed.This paper elucidates the occurrence of MDR in relation to autophagy in order to provide new information on chemotherapy MDR.
autophagy,tumor,multidrug resistance

10.3969/j.issn.1000-8179.20150066
①兰州军区兰州总医院消化科(兰州市730050);②甘肃中医学院临床医学院
*本文课题受国家自然科学基金项目(编号:81374019)资助
张方信zhangfx59@126.com
1Department of Gastroenterology,Lanzhou General Hospital of Lanzhou Military Area Command,Lanzhou 730050;2College of Clinical Medicine,Gansu University of Traditional Chinese Medicine,Lanzhou 730000,China
This work was supported by the National Natural Science Foundation of China(No.81374019)
王彬彬专业方向为消化道肿瘤及高原胃肠病的基础与临床研究。
E-mail:wy4287_1976@163.com
