昆虫葡萄糖氧化酶的基本特性及功能
2015-11-22董人富马小丽陈亚琼戚伟平何玮毅尤民生
董人富,马小丽,陈亚琼,戚伟平,陈 玮,何玮毅,尤民生
(福建农林大学应用生态研究所,农业部闽台作物有害生物综合治理重点实验室,福建省昆虫生态重点实验室,福州350002)
葡萄糖氧化酶 (glucose oxidases,GOX)普遍存在于动物、植物及微生物体内。1904年首先在黑曲霉 Aspergillus niger和灰绿青霉 Penicillium glaucum中发现葡萄糖氧化酶 (邢良英等,2007)。1928年,通过试验确定了黑曲霉无细胞提取液中葡萄糖氧化酶将葡萄糖氧化成葡萄糖酸和过氧化氢的作用机理,并命名为葡萄糖氧化酶,之后把它归入脱氢酶类 (张茜,2009)。1961年按照国际生化协会酶学委员会的分类新命名法,系统命名为β-D-葡萄糖氧化还原酶 (EC1.1.3.4)(程静,2011)。昆虫中GOX的研究起步相对比较迟,本文通过对昆虫GOX的催化机制、进化关系、活性变化、对自身与氧化还原相关生理活动的影响和在植物防御反应中的作用等方面进行阐述,为揭示昆虫与植物协同进化的机制和害虫生态治理提供理论依据。
1 GOX的结构与催化特性
GOX是一种糖蛋白,其氨基酸组成中谷氨酸和谷氨酸盐、天冬氨酸和天冬氨酸盐以及甘氨酸含量较高,不存在半胱氨酸 (Eichenseer et al.,1999)。GOX的结构和性质相对保守,多数GOX分子具有2个黄素腺嘌呤二核苷酸 (FAD)结合位点,它是一个同型二聚体分子,刚性非常强,不易断裂。每个GOX单体都含有2个完全不同的区域:一个与部分FAD非共价紧密结合,主要是β折叠;另一个与底物β-D-葡萄糖结合,由4个α螺旋支撑1个反平行的β折叠。上述结构特征使得GOX对底物β-D-葡萄糖具有高度的识别性和专一性,可以将β-D-葡萄糖氧化成葡萄糖酸和过氧化氢 (程静,2011)。其催化反应的过程是一个氧化还原反应,需要辅酶黄素腺嘌呤二核苷酸 (FAD,flavin adenine dinucleotide)的参与,FAD作为最初的电子受体,自身还原被成FADH2,葡萄糖被氧化成葡萄糖酸,然后FADH2再将电子传递给氧气,生成过氧化氢 (图1)。
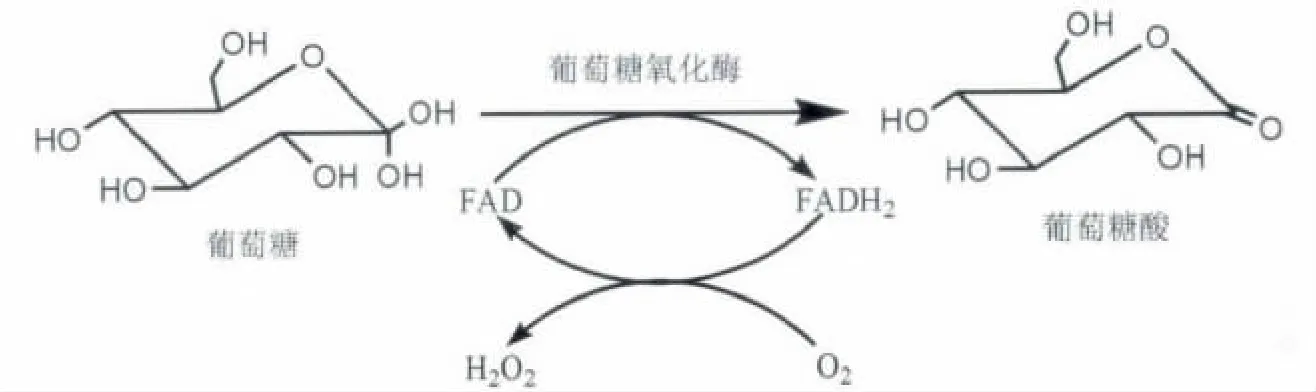
图1 葡萄糖氧化酶 (GOX)催化反应机理示意图(程静,2011)Fig.1 Illustration of glucose oxidase(GOX)-based catalytic reaction,showing that GOX can specifically oxidize β-D-glucose into gluconic acid and hydrogen peroxide
2 昆虫GOX的进化
目前,公共数据库中已有的GOX主要来自真菌和昆虫。我们在Tang等 (2012)构建的GOX与葡萄糖脱氢酶 (glucose dehydrogenase,GLD)的进化树基础上,新增了果蝇Drosophila melanogaster的GLD、以及蜜蜂Apis mellifera、小菜蛾Plutella xylostella和家蚕Bombyx mori的GOX序列,重新构建系统进化树,一共涉及13个物种19条序列。在系统发育树中,昆虫GOX与已经工业化生产的黑曲霉GOX都独立成支,并且它们的生化性质具有较大的差异 (Eichenseer et al.,1999),说明了昆虫和真菌GOX是经过不同的进化历程演变而来;而家蚕和蜜蜂的GOX和GLD聚到了同一个分支,说明了昆虫GOX和GLD可能具有相同的起源。我们发现GOX在进化树中的距离和物种的亲缘关系紧密相关,膜翅目昆虫的GOX和鳞翅目昆虫的GOX可以大体各独立成支,只有家蚕的一个GOX被聚到了膜翅目;在鳞翅目中,棉铃虫Helicoverpa armigera、美洲棉铃虫Helicoverpa zea和甜菜夜蛾Spodoptera exigua这三种夜蛾科昆虫GOX相对菜蛾科的小菜蛾和蚕蛾科的家蚕,在进化树中也独立成一个小支 (图2)。
Kunieda等 (2006)通过分析GOX在蜜蜂基因组中与相邻基因的排布情况、序列同源性及其调控序列后认为,GOX是从与提供飞行能量相关的葡萄糖 -甲醇 -胆碱氧化还原酶 (glucosemethanol-choline(GMC)oxidoreductases)进化而来,首先由GMC氧化还原酶通过基因复制事件而产生数个连续排列的GLD,然后由其中一个GLD进化成GOX。在小菜蛾基因组中,我们鉴定了3个GOX基因 (You et al.,2013),其中较为原始的GOX基因 (Px008506)在成虫中偏好表达 (He et al.,2012),其是否保留了GMC提供成虫飞行能量的功能,需要进一步实验的验证 (图2)。
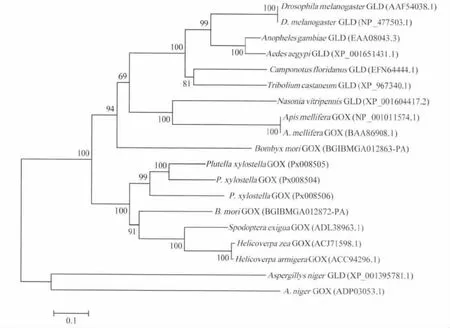
图2 昆虫和真菌GOX和GLD系统进化树Fig.2 Phylogenetic tree of GOX and GLD in insects and fungi
3 昆虫GOX的活性与昆虫食性
虽然昆虫唾液腺 (包括上鄂腺、下鄂腺或下唇腺)中普遍存在GOX(黄志君等,2007),但是同一物种,不同组织器官和发育阶段,其GOX活性不同。例如,GOX在美洲棉铃虫不同组织器官的活性依次 (从高到低)为:下唇腺、颚腺、中肠腔、马氏管、前肠、血淋巴、脂肪体和中肠上皮细胞,而在其虫体外表皮和雄虫睾丸没有检测到GOX的活性 (Eichenseer et al.,1999)。其它鳞翅目昆虫中GOX活性也呈现相似的特征 (宗娜和王琛柱,2004),如在家蚕下唇腺同源器官丝腺中GOX的活性同样较高 (肖丽蓉,2012)。此外,在昆虫的幼虫时期,下唇腺GOX活性呈周期性变化,取食活跃期的GOX活性相对较高 (Eichenseer et al.,1999;宗娜和王琛柱,2004)。昆虫GOX的活性在取食密切相关的唾液腺和取食活跃时期都相对较高,说明了GOX和昆虫取食密切相关。
取食不同寄主植物的昆虫,其GOX活性不同。Peiffer和 Felton(2005)研究发现,取食烟草Nicotiana tabacum的美洲棉铃虫与取食棉花的相比,幼虫下唇腺含有更高的GOX活性;Eichenseer等 (2010)发现美洲棉铃虫、烟草天蛾Manduca sexta和烟芽夜蛾Heliothis virescens取食不同的寄主植物,都会导致的GOX活性产生显著的变化;喂食人工饲料的棉铃虫唇腺中GOX活性显著高于取食烟草N.tabacum的,用浸泡过葡萄糖或者蔗糖的烟草叶片喂养棉铃虫幼虫,其唇腺分泌的GOX含量也显著提高 (Tang et al.,2012)。
Eichenseer等 (2010)通过对85种来自23个的鳞翅目家族和3种来自2个膜翅目家族昆虫的下唇腺GOX的活性调查,发现物种间GOX的活性相差较大,但是一般而言杂食性昆虫比寡食性、单食性昆虫的GOX活性高。
4 昆虫GOX参与自身的氧化还原过程
GOX作为一种脱氢酶,其氧化产物对昆虫自身具有广泛的作用。Candy(1979)发现南美沙漠蝗Schistocerca americana表皮和血淋巴中GOX的活性在蜕皮之后迅速升高,推测GOX在南美沙漠蝗成虫骨化过程中有助于蛋白质的交联;但Eichenseer等 (1999)等人发现美洲棉铃虫的幼虫表皮中不表达GOX。因此,GOX是否通过影响蛋白质交联而影响昆虫骨化还有待证实。目前认为,GOX调节自身与氧化还原相关的生理活动有:①昆虫GOX的氧化产物会抑制所取食植物中过氧化物酶、多酚氧化酶和脂肪氧化酶等对植物营养成分的破坏 (Felton and Summers,1995;Felton and Gatehouse,1996),同时在中肠的氧化反应中GOX与这些氧化酶竞争性结合氧气,使得其它氧化酶缺少结合的底物,从而在昆虫中肠消化系统中增加被摄取食物的营养 (Eichenseer et al.,1999)。②昆虫GOX的催化过程消耗氧气并产生过氧化氢,然后由抗坏血酸过氧化物酶移除过氧化氢,减少了氧气参与其他氧化过程,而在中肠中作为抗氧化系统的一部分而起作用 (Mathews et al.,1997)。③昆虫GOX可以通过其产生的过氧化氢抑制某些特殊组织的细胞程序性死亡,如家蚕的前部丝腺 (Matsui et al.,2011)。
5 昆虫GOX对植物防御反应的影响
昆虫GOX可以抑制植物的防御反应,其不仅可以减少茉莉酸 (JA)诱导的防御物质烟碱含量(Musser et al.,2002)和降低防御物质萜类化合物合成酶基因 (Bede et al.,2006)的转录水平,而且还能抑制JA生物合成的关键酶脂氧合酶(lipoxygenase)的活力,从而抑制JA的水平 (Bi et al.,1997)。多数植食性昆虫口腔唾液中存在两类主要物质,在其与寄主植物的相互作用中起着重要作用:一类是脂肪酸和氨基酸的共轭化合物(fatty acid-amino acid conjugates,FACs);另一类是酶,如 β-葡萄糖苷酶和 GOX(Hu et al.,2008)。Diezel等 (2009)等人提出,昆虫口腔唾液分泌物通过与植物激素的互作调节植物的防御反应。昆虫口腔唾液中在FACs含量多、GOX含量少时,如烟草天蛾,FACs作为口腔分泌物中的主效物质,可以诱导JA和乙烯 (ET)的水平上调,进而通过植物中ET受体 (ETR1)抑制水杨酸(SA)的水平;在FACs含量少、GOX含量多时,如甜菜夜蛾,GOX作为口腔分泌物中的主效物质,可以诱导SA的水平上调,通过与JA的相互拮抗作用,抑制依赖于JA的植物对咀嚼式口器昆虫的防御反应。
昆虫GOX很可能通过其催化产物来抑制与植物激素相关的防御反应。例如,用葡萄糖或者GOX单独处理损伤烟草的伤口,都不能显著的提高植物中与防御相关的SA的水平。但是,若用葡萄糖和GOX两者同时处理植株伤口,却能显著提高植株 SA的水平 (Diezel et al.,2009)。昆虫GOX的水解产物过氧化氢、葡萄糖酸处理机械损伤的烟草叶片,相较于对照组 (水处理)的烟草叶片,使得植物防御物质烟碱含量减少 (Musser et al.,2002)。有趣的是,烟草在受到虫害之后,会将其体内的糖类物质转移到根部 (Schwachtje et al.,2006),这样也就间接降低了昆虫GOX的作用效果,从而提高自身对昆虫的防御。
虽然昆虫GOX抑制植物的防御反应的报道比较多,但是在番茄中却诱发植物的防御反应。昆虫GOX不仅使得番茄中JA上调表达,而且受JA调控的防御基因蛋白酶抑制2(Pin2)也上调表达,这种诱发效应具有组织特异性,并可以传递到下一代。在进一步的研究中发现,番茄中SA及其前体苯甲酸的含量、SA诱导的相关基因和JA途径上游信号基因的表达量在美洲棉铃虫唾液处理前后都没有显著的变化。因此,GOX诱导JA途径的机制可能不是直接作用于JA上游信号因子且与SA途径无关,具体作用机理还有待进一步的研究(Tian et al.,2012)。
6 小结与展望
目前,虽然对昆虫中普遍存在的GOX的研究仍十分有限,但是发现昆虫GOX在调节自身与氧化还原相关的生理活动和对植物防御方面都具有重要的功能。其中,最令人关注的是,包括GOX在内的昆虫口腔分泌物在植物与昆虫互作关系中的作用。Diezel等 (2009)所提出的昆虫口腔分泌物调控烟草中JA、SA和ET途径影响植物防御反应的模型值得我们借鉴,但是其中的信号如何传递有待进一步深入研究。
虽然昆虫GOX及其催化产物和植物的防御紧密相关,但是植物感知GOX的具体机制还不清楚。对此,我们是否可以借鉴植物病理学中效应子触发的植物免疫机制 (effector-triggered immunity)(Jones and Dangl,2006;Boller and He,2009),寻找植物中GOX的受体以及由植物激素介导的响应GOX的途径,从而深入认识昆虫GOX如何对植物防御反应产生影响。
我们可以借助分子生物学和生物技术的手段,如借助昆虫RNA干扰抑制GOX的表达和昆虫转基因诱发GOX过量表达来调控昆虫GOX的分泌过程,进一步探讨昆虫GOX的生理功能;利用体外表达昆虫GOX蛋白处理植物,探究昆虫GOX和植物防御相关的信号转导途径如何关联,从而深入了解昆虫与植物的互作关系;通过构建昆虫GOX与寄主植物相互作用的基因网络,阐明昆虫GOX在与植物互作过程中的关键作用,进而为农业害虫的有效防治和持续控制提供新思路。
References)
Bede JC,Musser RO,Felton GW,et al.Caterpillar herbivory and salivary enzymes decrease transcript levels of Medicago truncatula genes encoding early enzymes in terpenoid biosynthesis[J].Plant Molecular Biology,2006,60(4):519-531.
Bi JL,Murphy JB,Felton GW.Antinutritive and oxidative components as mechanisms of induced resistance in cotton to Helicoverpa zea[J].Journal of Chemical Ecology,1997,23(1):97 -117.
Boller T,He SY.Innate immunity in plants:an arms race between pattern recognition receptors in plants and effectors in microbial pathogens[J].Science,2009,324(5928):742-744.
Candy DJ.Glucose oxidase and other enzymes of hydrogen peroxide metabolism from cuticle of Schistocerca americana gregaria [J].Insect Biochemistry,1979 ,9(6):661-665.
Cheng J. Cloning, Expression and Sequence Analysis of Bmgox,Glucose Oxidase Genes in the Silkworm,Bombyx mori[D].Chongqing:Southwest University,2011.[程静.家蚕葡萄糖氧化酶基因BmGox的克隆和表达以及序列分析 [D].重庆:西南大学,2011]
Diezel C,von Dahl CC,Gaquerel E,et al.Different lepidopteran elicitors account for cross-Talk in herbivory-induced phytohormone signaling[J].Plant Physiology,2009,150:1576-1586.
Eichenseer H,Mathews MC,Bi JL,et al.Salivary glucose oxidase:multifunctional roles for Helicoverpa zea?[J] Archives of Insect Biochemistry and Physiology,1999,42(1):99 -109.
Eichenseer H,Mathews MC,Powell JS,et al.Survey of a salivary effector in caterpillars:glucoseoxidase variation and correlation with host range [J].Journal of Chemical Ecology,2010,36(8):885-897.
Felton GW,Gatehouse JA.Antinutritive plant defence mechanisms[M].In:Lehane MJ,Billingsley P,eds.The Biology of the Insect Midgut.London:Chapman & Hall.1996,373 -416.
Felton GW,Summers CB.Antioxidant systems in insects[J].Archives of Insect Biochemistry and Physiology,1995,29(2):187-197.
He WY,You MS,Vasseur L,et al.Developmental and insecticideresistant insights from the de novo assembled transcriptome of the diamondback moth,Plutella xylostella [J]. Genomics,2012,99(3):169-177.
Huang ZJ,Zeng WN,Hu ZY.Progress of study on insect salivary gland[J].Guangdong Sericulture,2007,41(2):44-48[黄志君,曾文年,胡占英.昆虫唾液腺的研究进展 [J].广东蚕业,2007,41(2):44 -48].
Hu YH,Leung DW,Kang L,et al.Diet factors responsible for the change of the glucose oxidase activity in labial salivary glands of Helicoverpa armigera[J].Archives of Insect Biochemistry and Physiology,2008,68(2):113-121.
Jones JDG,Dangl JL.The plant immune system [J].Nature,2006,444(7117):323-329.
Kunieda T,Fujiyuki T,Kucharski R,et al.Carbohydrate metabolism genes and pathways in insects:insights from the honey bee genome[J].Insect Molecular Biology,2006,15(5):563 -576.
Mathews MC,Summers CB,Felton GW.Ascorbate peroxidase:a novel antioxidant enzyme in insects[J].Archives of Insect Biochemistry and Physiology,1997,34(1):57-68.
Matsui H,Kakei M,Iwami M,et al.Glucose oxidase prevents programmed cell death of the silkworm anterior silk gland through hydrogen peroxide production [J]. FEBS Journal, 2011,278(5):776-785.
Musser RO,Cipollini DF,Hum-Musser SM,et al.Evidence that the caterpillar salivary enzyme glucoseoxidase provides herbivore offense in solanaceous plants[J].Archives of Insect Biochemistry and Physiology,2005,58(2):128-137.
Musser RO,Hum -Musser SM,Eichenseer H,et al.Herbivory:Caterpillar saliva beats plant defences [J]. Nature,2002,416(6881):599-600.
Musser RO,Kwon HS,Williams SA,et al.Evidence that caterpillar labial saliva suppresses infectivity of potential bacterial pathogens[J]. Archives of Insect Biochemistry and Physiology,2005,58(2):138-144.
Peiffer M,Felton GW.The host plant as a factor in the synthesis and secretion of salivary glucose oxidase in larval Helicoverpa zea [J].Archives of Insect Biochemistry and Physiology,2005 ,58(2):106-113.
Schwachtje J,Minchin PE,Jahnke S,et al.SNF1 - related kinases allow plants to tolerate herbivory by allocating carbon to roots [J].Proceedings of the National Academy of Sciences,2006,103(34):12935-12940.
Tang QB,Hu YH,Kang L,et al.Characterization of glucose‐induced glucose oxidase gene and protein expression in Helicoverpa armigera larvae [J].Archives of Insect Biochemistry and Physiology,2012,79(2):104-119.
Tian D,Peiffer M,Shoemaker E,et al.Salivary glucose oxidase from caterpillars mediates the induction of rapid and delayed-induced defenses in the tomato plant [J]. PloS One, 2012,7(4):e36168.
Xiao LR.GOX Inhibits JA Mediated Defence in Mulberry Induced by Silkworm [D].Chongqing:Southwest University,2012.[肖丽蓉.GOX抑制家蚕取食诱导的桑叶JA信号防御 [D].重庆:西南大学,2012]
Xing Ly,Wang YS,Zheng YG.Production and application of glucose oxidase[J].Food Science and Technology,2007,32(6):24-26[邢良英,王远山,郑裕国.葡萄糖氧化酶的生产及应用[J].食品科技,2007,32(6):24-26]
You M,Yue Z,He W,et al.A heterozygous moth genome provides insights into herbivory and detoxification.Nature Genetics,2013,45(2):220-225.
Zhang Q.Purification and Characterization of GOD from Penicillium amagasakiense[D].Xiamen:Xiamen University,2009.[张茜.尼崎青霉菌葡萄糖氧化酶的分离纯化及性质研究[D].厦门:厦门大学,2009]
Zong N,Wang CZ.The induction of tobacco nicotine by feeding of three noctuid insects and its relationship with glucose oxidase in labial gland[J].Chinese Science Bulletin,2004,49(14):1380 -1385[宗娜,王琛柱.三种夜蛾科昆虫对烟草烟碱的诱导及其与昆虫下唇腺葡萄糖氧化酶的关系 [J].科学通报,2004,49(14):1380 -1385]
