生长期RNAi抑制POD基因表达对心里美萝卜花青素含量的影响
2015-11-22李日辉
李日辉
(新乡医学院三全学院,河南新乡 453000)
生长期RNAi抑制POD基因表达对心里美萝卜花青素含量的影响
李日辉
(新乡医学院三全学院,河南新乡 453000)
前期结果表明,在生长期通过RNAi可有效地抑制其POD基因的长期表达,但对72h内的变化无从了解。本实验模拟心里美萝卜自然生长条件,在前期研究基础上进行RNAi干扰POD基因表达,进一步证实POD活性被抑制的时间可以提前到RNAi干扰质粒作用后的4h,而花青素的含量随POD活性被抑制而逐渐增加。同时植物的生长状态可以影响到干扰强弱,对干扰趋势影响不明显。
POD rsprx1基因 RNAi 花青素
心里美萝卜(Raphanus sativus L)属十字花科、两年生草本植物,是我国著名的萝卜品种,其肉质根的木质部中含有丰富的过氧化物酶和花青素。过氧化物酶(Peroxidase,POD)是广泛存在于植物体内的一类能利用H2O2氧化供氢体的酶,它对H2O2具有高度专一性,而对供氢体的要求则较为广泛,它催化如下反应:A H+ H2O2=A+2H2O[1]。由于POD成分和结构的复杂性,同功酶的多样性,以及多基因编码特点,造成对其功能的认识尚不全面。POD一方面与植物正常的形态发生和形态建成有关,在植物的生长、发育过程中起作用;另一方面与植物的抗逆性有关,包括抗旱、抗寒、抗盐和抗病等,是植物重要的保护酶。
花青素(Anthocyanidin),又称花色素,是苯并吡喃衍生物,常与一个以上葡萄糖、鼠李糖等通过糖苷键形成花青苷(Anthocyanin)。花青素主要存在于植物液泡中,水果、蔬菜、花卉等五彩缤纷的颜色大部分与之有关,也是树木叶片的主要呈色物质。花青素具有抗氧化、消除自由基、抗变异、抗肿瘤、降低血清和肝脏中脂肪含量以及防止人体内过氧化的作用。植物花青素代谢途径研究已较为成熟,苯丙氨酸是花青素合成的直接前体,由苯丙氨酸到花青素经历3个阶段:第1阶段由苯丙氨酸到香豆酰CoA;第2阶段是由4-香豆酰CoA和丙二酰CoA到二氢黄酮醇,是类黄酮代谢的关键反应;第3阶段是花青素的合成 。通过外源结构基因的导入,利用共抑制原理等技术调控花青素等类黄酮物质的合成,以改变植物花色、果色和叶色已经取得了许多成果。RNAi技术已经成功应用到通过抑制花青素合成基因来改变花的颜色,创造出新的植物品种这一领域上来。
1 材料与方法
1.1 材料
心里美萝卜品种为京研牌“满堂红”菌株:含有pART-rsprx1i干扰载体的农杆菌菌株和含有空载体pART-27的农杆菌菌株,由本实验室保存。

图1 抑制rsprx1基因对POD活性的影响
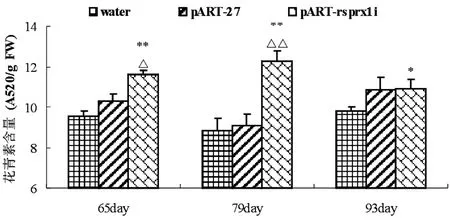
图2 抑制rsprx1基因对花青素含量的影响
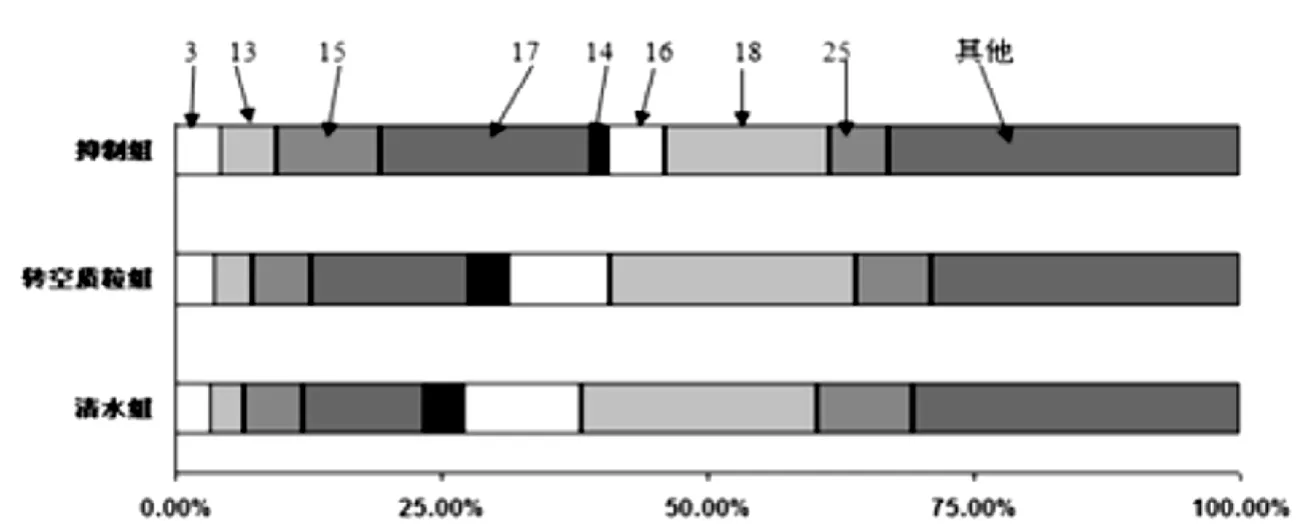
图3 各组花青苷相对含量比例示意图
1.2 方法
(1)浸染。将含有干扰载体pART-rsprx1i和空质粒pART-27的农杆菌在含有50mg/L卡那霉素(Kan)的LB固体培养基上分别划线培养,长出菌落后,挑取单菌落接种于附加50mg/L卡那霉素(Kan)的LB液体培养基中,培养48h左右,使OD达到0.8。用含有10mmol/L MES和2%蔗糖、pH为5.6的1/2MS液体培养基做为细胞重悬液,重悬菌液至OD为2.4。取生长至65天、79天和93天的心里美萝卜去皮,灭菌后切成0.5cm3,用含有pART-rsprx1i的菌液浸泡10min,并以含有pART27的农杆菌及清水做对照,浸泡时置于摇床。浸泡后置于培养皿,在培养箱中进行培养,培养箱的光照强度为12000LX,温度为24°C。培养4h、8h、24h、48h和72h后测定各指标。
(2)POD活性的检测。称0.9g肉质根,加入适量石英砂及0.9 ml PB [50mmol/L (pH7.0)],低温下匀浆,12000r/min离心20 min。参照张龙翔等方法[3],取上清10μl,加入2.9 ml 0.01mol/L PB,并加入50μl 0.02mol/L愈创木酚,最后加入10μl 0.04mol/L新配制的H2O2后470nm处比色,每隔30秒测定OD,连续记录3min,以光吸收每分钟增加0.001为一个酶活性单位(U),酶活性用U/g·FW表示。
(3)花青素含量的测定取0.3g肉质根,加少量石英砂和0.9 ml提取液(含1%浓盐酸的无水乙醇),研磨至匀浆,在4°C冰箱避光浸提24h,加等体积蒸馏水1.8 ml,12000 r/min,4°C离心10 min,于520nm处测定吸光值,含量单位用A520/g·FW表示。
(4)花青素高效液相色谱分析。取培养48h的萝卜肉质根,切碎后称取1g萝卜肉质根,加入2ml的5%甲酸充分研磨,浸提12h后,8000r/m,离心15min,收集上清。HPLC使用C18柱,柱温40°C,流动相A为5%甲酸,流动相B为5%乙腈/甲酸,流速0.4 ml/min,进样量为20μl,检测波长为520nm,采用梯度洗脱。
2 结果
(1)生长期抑制rsprx1基因对POD活性的影响在不同生长期,其肉质根经含有pART-rsprx1i干扰载体的农杆菌浸染10 min,并以含有空质粒pART-27的农杆菌及清水做对照,培养至48h,POD活性均达到组内最低值,以48h为组间比较时间点,如图1:在播种后的第65、79和93天,肉质根经含有干扰载体的菌液浸染10 min,培养至48h,POD活性均达到最低且与对照组有极显著差异(p<0.01);播种后第79天,处理后48h,抑制组POD活性14.2×103U/g·FW,为组内组间最低值。
(2)生长期抑制rsprx1基因对花青素含量的影响以48h为组间比较时间点,花青素含量测定如图2:在播种后的第79天,其肉质根小块经含有pART-rsprx1i干扰载体的农杆菌浸染10 min,培养至48h后,花青素含量达到最高且与对照组有极显著差异(p<0.01);第65天时抑制组花青素含量与清水组有极显著差异(p<0.01),与转空质粒组有一般显著差异(p<0.05);第93天时抑制组花青素含量与清水组有一般显著差异(p<0.05);播种后第79天,处理后48h,抑制组花青素含量为12.3 A520/g·FW,为组内组间最大值。
(3)花青素高效液相分析对上述花青素进行HPLC,从萝卜肉质根中共分离出了26种花青苷,它们主要为天竺葵素的衍生物,抑制组各花青苷的含量和表达量高于两个对照组,有极显著差异(P<0.01)。其中第14、16、18、25号所代表的花青苷在抑制组中的相对表达量要低于对照组;而抑制组中的第3、13、15、17号所代表的花青苷相对表达量则要高于对照组;从花青苷的种类来说,抑制组和与对照组的花青苷成分有明显差异,其中,抑制组检测出花青苷26种,转空质粒组检测出23种,而在清水组检测出24种,如图3所示。
3 结语
在心里美萝卜生长的不同时期,采取对肉质根进行转染,POD活性的抑制作用最强效果是在萝卜播种后生长至第79天的时期。浸染后培养48h POD活性达到最底点,至72h时抑制作用有减低趋势。
浸染法会对植物组织造成一定程度的损伤,同时农杆菌本身也会对植物组织造成病害。在本实验中没有进行愈伤培养,但从实验结果可见,无论那种处理,清水对照组的POD活性和花青苷含量在研究中变化不明显,同时以清水对照的数据作为参考,可以排除机械损伤对实验结果的影响[5]。
在萝卜营养生长期肉质根POD活性有一个先升高后下降的过程,而花青素含量变化则是逐渐升高然后相对稳定。心里美萝卜肉质根花青素的合成主要是在其营养生长早期,而后期主要是花青素的积累.在富含花青素的植物器官伴随有高活性的POD,POD在体外可以降解花青素,抑制POD可延缓花青素降解。在本实验中过氧化物酶的活性减低和花青素含量的增高位于同一时间点,进一步证明过氧化物酶在花青素代谢中的作用。抑制rsprx1基因的表达,降低POD含量和活性,可以增加转录因子TT8表达,进而增加CHS,CHI,DFR和LDOX基因的表达,从而使花青素合成增加。参与花青素合成途径的基因很多,干扰rsprx1并不能影响所有花青素合成基因,只是选择性影响部分基因表达[6]。从实验结果可以得出初步推论:过氧化物酶对花青素的作用不仅体现在影响花青素合成相关基因的表达,还能在花青苷修饰方面影响其酰基化。
[1]Penel C.The peroxidase system in higher plants.In: Greppin H, Penel C, Integrated Plant Systems [J].University of Geneva,Switzerland,2000,pp:359-367.
[2]张龙翔,张庭芳,李令媛.生化实验方法和技术[M].第2版.北京:高等教育出版社,1997,188-189.
[3]Sharp P A. RAN interference[J].Genes Dev,2001,15(5):485-490.
[4]杨少华.转萝卜过氧化物酶RsPrx1基因影响拟南芥花青素代谢机理[D].河南:河南师范大学,2010.
[5]Holton T A,Cornish E C. Genetics and biochemistry of anthocyanin biosynthesis [J].Plant Cell,1995,7:1071-1083.
