柴胡皂苷d对氧化应激诱导的HSC-T6活化细胞内AP-1、NF-κB表达的影响及其雌激素受体机制
2015-11-21沈艳婷刘进锴阙任烨陶智会林柳兵李勇
沈艳婷 刘进锴 阙任烨 陶智会 林柳兵 李勇
(1.上海中医药大学附属市中医医院脾胃病科,上海 200071;2.中国人民解放军第二军医大学附属东方肝胆外科医院肝外一科,上海 200433)
柴胡皂苷d对氧化应激诱导的HSC-T6活化细胞内AP-1、NF-κB表达的影响及其雌激素受体机制
沈艳婷1刘进锴2阙任烨1陶智会1林柳兵1李勇1
(1.上海中医药大学附属市中医医院脾胃病科,上海 200071;2.中国人民解放军第二军医大学附属东方肝胆外科医院肝外一科,上海 200433)
目的:研究柴胡皂苷d(SSd)对氧化应激诱导的肝星状细胞HSC-T6活化细胞内AP-1、NF-κB表达的影响及其雌激素受体(ER)机制,探讨植物雌激素对肝纤维化的作用机制,为临床应用植物雌激素提供理论依据。方法:体外培养大鼠肝星状细胞HSC-T6,采用免疫组化法,检测SSd对氧化应激诱导的HSC-T6活化细胞内α-SMA蛋白表达的影响;采用Western blot法,观察SSd对氧化应激诱导的HSC-T6活化细胞内AP-1、NF-κB表达的影响。结果:氧化应激处理HSC-T6细胞后,α-SMA、AP-1和P65/NF-κB表达明显增加。如使用雌二醇(E2)或SSd预处理HSC-T6细胞24h后再接受氧化应激处理,三种蛋白表达明显降低,这种作用可被雌激素受体(ER)完全拮抗剂ICI-182780和ERβ拮抗剂THC抑制。结论:E2、SSd可能通过调控ERβ,进而抑制核转录因子AP-1和P65/NF-κB的表达起到抑制HSC-T6活化的作用。
柴胡皂苷d 肝 星状细胞 HSC-T6细胞 体外实验 大鼠
肝纤维化(hepatic fibrosis,HF)是由于各种致病原因所致慢性肝损伤反复修复,经过过度的创伤愈合应答,导致瘢痕组织形成,引起细胞外基质(extracellular matrix,ECM)在肝脏内过度增生与异常沉积所致肝脏结构和肝功能异常改变的一种病理变化,其发生发展是一个连续的阶段性过程。肝星状细胞(Hepatic Stellate Cell,HSC)的活化在肝纤维化发生发展过程中占据着重要地位,多种核转录因子如转录激活蛋白-1(Activator protein-1,AP-1)、核因子NF-κB(Nuclear factor-kappa B,NF-κB)等表达增高与HSC的活化有关。由于肝纤维化是一个可逆性的病理过程,所以早期诊断、进行药物干预可防止肝硬化的发生,从而破坏“慢性肝病-肝纤维化-肝硬化-肝癌”这条“死亡链”。
柴胡(Bupleurum)作为一种治疗肝相关疾病的中药材已经有几千年的历史,但其主要起作用的成分及机制至今尚未完全揭示。目前研究发现柴胡主要的提取成分是柴胡皂苷a(SSa)、柴胡皂苷b(SSb)、柴胡皂苷c(SSc)和柴胡皂苷d(SSd)等,其中SSd是其活性最强的成分之一[1]。我们前期研究已初步证实SSd在体内外有弱雌激素样作用[2],但其是否能通过雌激素受体作用于肝星状细胞至今尚未明确。本实验旨在研究SSd对氧化应激诱导的大鼠肝星状细胞HSC-T6活化细胞内AP-1、NF-κB表达的影响及其雌激素受体机制。
1 实验材料
1.1 主要试剂雌二醇(E2,Sigma公司),柴胡皂苷d(中国食品药品检定所),DMEM高糖培养基(Thermo Scientific公司),胎牛血清(奥地利PAA公司),二甲基亚砜(美国Amresco公司),牛血清白蛋白(美国Amresco公司),AP-1、NF-κB、α-SMA、β-actin抗体(CST公司),ECL化学发光试剂盒(Millipore公司),蛋白质分子量预染Marker(Thermo公司),山羊抗兔HRP标记二抗(CST公司),山羊抗鼠HRP标记二抗(CST公司),雌激素受体α选择性拮抗剂MPP、雌激素受体β选择性拮抗剂THC(TOCRIS公司),雌激素受体完全拮抗剂ICI-182780(sigma公司),即用型免疫组化试剂盒(福州迈新公司),苏木素染液(福州迈新公司),DAB显色试剂盒(福州迈新公司)。
1.2 主要仪器电泳仪(Bio-rad),离心机(Heal force),AIRTECH超净工作台(苏州苏净集团安泰公司),V-5060型二氧化碳细胞培养箱(德国Heraeus公司),DM2500型正置荧光显微镜(Leica公司),ChemiDocTMXRS+自动显影系统(Bio-Rad)。
1.3 细胞肝星状细胞株HSC-T6,由SV40转染SD大鼠肝星状细胞获得,其表型为活化肝星状细胞,由第二军医大学长征医院消化科提供。
2 实验方法
2.1 细胞培养HSC-T6细胞用含有10%热灭活胎牛血清的DMEM完全培养基在37℃、体积分数为5%CO2、完全饱和湿度条件下常规培养,每48h更换培养基,细胞生长铺满培养瓶底80%后,用0.25%胰蛋白酶联合0.02%EDTA消化传代,实验选用对数生长期细胞。
HSC-T6细胞用含有5%热灭活胎牛血清的无酚红DMEM培养基培养,接种于6孔板,1.5×105/孔,24h贴壁后,分为DMEM组(Vehicle)、ICI-182780处理组、MPP处理组及THC处理组,提前处理0.5h。每组各加入SSd(5μmol/L)或E2(1μmol/L)或DMEM(空白对照组、模型组),3孔/组,24h后再用H2O2(0.01mol/L)或DMEM(空白对照组)处理4h。
2.2 观察指标
2.2.1 免疫组化将药物处理后的细胞用PBS漂洗2×2min,4%多聚甲醛固定15min,PBS漂洗3× 2min,空气干燥5min;PBS清洗3×2min,0.5%Triton X-100孵育20min,PBS清洗3×2min;3%H2O2孵育15min,PBS清洗3×2min;血清封闭,37℃,20min;一抗孵育(阴性对照用PBS代替一抗),4℃过夜;二抗孵育,37℃,30min;PBS清洗5×2min;DAB显色(避光,镜下观察至棕色)约10~15min,蒸馏水冲洗1次5min,苏木素复染10min,自来水洗5min,脱水及透明,树胶封片。
应用计算机图像分析技术对免疫组化结果进行定量分析。每张切片随机选取10个高倍镜视野(×200),使用Imagepro-IPP图像系统,半定量测定α-SMA的表达。
2.2.2 Western blot将药物处理后的细胞弃去培养液,PBS洗涤细胞3次后,将6孔板置于冰上。向培养板中加入150μL细胞裂解液(含蛋白酶抑制剂1∶100),置于摇床上30min(冰上),用细胞刮刀将细胞刮下后,将细胞悬液移入EP管内,超声,离心12000g,20min,取上清。按照1∶4体积比加入4×loading buffer,100℃水浴10min,使蛋白变性。分装,-20℃保存备用。配制PAGE胶,分离胶的浓度为8%,积层胶为5%。上样10μL预染的SDSPAGE蛋白分子量marker,以确定所检测蛋白带的位置。初始电压为60V,溴酚蓝电泳至积层胶和分离胶分界面后加大至100V,至凝胶底部时停止电泳。
3 实验结果
3.1 SSd对氧化应激诱导HSC-T6细胞α-SMA蛋白表达的影响空白对照组细胞中有少量α-SMA蛋白表达,氧化应激处理细胞后α-SMA表达明显增加,与空白对照组比较差异有统计学意义(P<0.01)。如使用E2或SSd预处理HSC-T6细胞24h后再接受氧化应激处理,α-SMA蛋白表达则明显降低(P<0.01),此种作用可被ICI-182780和THC阻断,提示E2和SSd可显著抑制HSC-T6细胞活化标志蛋白α-SMA的表达,此种作用可能是通过ERβ激活调控。见图1。
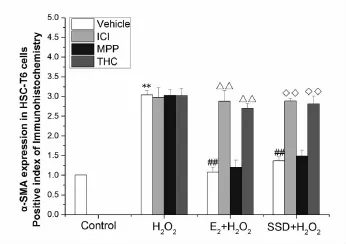
图1 SSd对氧化应激诱导HSC-T6细胞α-SMA蛋白表达的影响
3.2 SSd对氧化应激诱导HSC-T6细胞中AP-1和P65/NF-κB活化的影响空白对照组细胞中可见少量AP-1和P65/NF-κB蛋白表达,氧化应激处理细胞后AP-1和P65/NF-κB表达明显增加,与空白对照组比较差异有统计学意义(P<0.01)。如使用E2或SSd预处理HSC-T6细胞24h后再接受氧化应激处理,两种蛋白表达明显降低(P<0.01),此种作用可被ICI-182780和THC阻断,提示AP-1和P65/NF-κB参与了HSC-T6细胞活化过程,E2、SSd处理细胞后,两种信号通路作用可被抑制,此种作用可能是通过ERβ激活调控。见图2、图3。
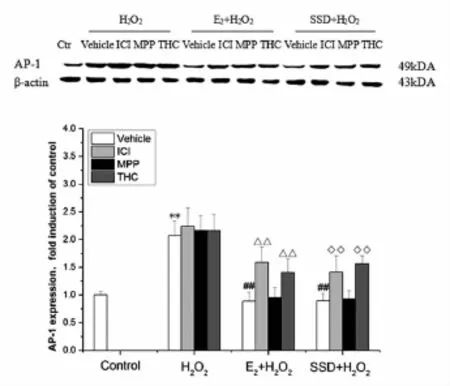
图2 SSd对氧化应激诱导HSC-T6细胞中AP-1活化的影响
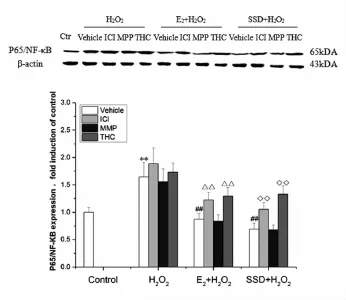
图3 SSd对氧化应激诱导HSC-T6细胞中P65/NF-κB活化的影响
4 讨论
肝星状细胞是肝脏Disse腔内的一种间质细胞,在生理状态下,它主要参与维系着肝细胞的构架以及生理功能。当肝细胞受到损伤时,释放多种脂质过氧化产物、细胞因子(转化生长因子β、血小板源生长因子等)、炎症介质(肿瘤坏死因子α、白介素-1、白介素-6等)等刺激导致肝星状细胞活化,由静止的低表达平滑肌α-肌动蛋白(α-SMA)的肝星状细胞转化成具有增殖性、成纤维性、收缩性、高表达平滑肌α-肌动蛋白的肌成纤维细胞,并合成大量细胞外基质。因此,肝星状细胞的活化在肝纤维化发生发展过程中起关键作用。
氧化应激在HSC活化过程中起主导作用。目前研究还表明多种信号转导通路如MAPK、TGF-β/ Smad、Wnt/β-catenin、JAK/STAT、Rho-ROCK等及核转录因子AP-1、NF-κB等都参与了HSC的活化过程。研究表明,NF-κB的激活能启动下游多种靶基因如环氧合酶-2(COX-2)、细胞间黏附分子-1(ICAM-1)、肿瘤坏死因子α(TNF-α)等的表达,最终诱导HSC α-SMA的表达和前胶原的合成,促使HSC增殖活化,减少其凋亡,促使肝纤维化发生及发展[3]。另外,AP-1可能是HSC活化的关键转录因子,多种与纤维化密切相关的细胞因子的基因转录为AP-1依赖性的。与ECM密切相关的MMP-1和TIMP-1的启动子区均含有AP-1结合位点。α1(I)型前胶原的基因转录是由依赖AP-1的BETB激活所介导的[4]。
大量临床资料表明,除了原发性胆汁性肝硬化外,大多数肝硬化患者中,男性发病比例明显高于女性[5],男性患者肝纤维化进展速度快、个体存活时间短,而女性患者恰恰相反,且多发生在闭经后,育龄期妇女很少有肝硬化发生,提示肝纤维化与性别有关系。临床上男性肝硬化患者绝大多数都会出现血清雌二醇(E2)水平升高,常伴有乳房发育、蜘蛛痣及肝掌等临床表现,对此现象目前通常的解释是由于肝功能减退导致雌激素灭活障碍所致。然而,我们认为也可能存在其他机制:肝脏在纤维化进程中机体的一种自我代偿性保护作用[6]。一项临床研究也发现,慢性乙型肝炎、肝硬化代偿期、肝硬化失代偿期患者性激素(包括雌激素)及其受体水平显著升高,随着病情发展,肝功能损伤越严重,这些指标上升越显著。另一方面,在动物水平实验中,雌激素已被证实对二甲基亚硝胺(dimethyl nitrosamine)和四氯化碳(CCl4)诱导的肝纤维化动物模型具有明显的抗纤维化作用[7-8]。在细胞水平实验中,雌激素可以抑制过氧化氢诱导的原代大鼠肝星状细胞的增殖与活化,这种效应可能是通过减少脂质过氧化水平来实现的[9]。虽然雌激素的抗纤维化作用已有多种证据支持,但由于其各种副作用而在临床上的应用受到限制,所以我们需要寻找其他具有雌激素样效应的替代药物。近年来很多研究表明一些植物雌激素具有抗肝纤维化效应,对心血管、肝脏、生殖系统均具有显著的保护作用,如白藜芦醇、槲皮素等,由于其副作用小,可以考虑用于替代雌激素在临床上治疗肝纤维化的病人。
本研究结果表明,氧化应激处理HSC-T6细胞后,α-SMA、AP-1和P65/NF-κB表达明显增加,提示HSC-T6细胞被活化。如使用E2或SSd预处理HSC-T6细胞24h后再接受氧化应激处理,三种蛋白表达均明显降低,这种作用可被ER完全拮抗剂ICI-182780和ERβ特异性受体拮抗剂THC抑制。SSd可能通过调控ERβ,进而抑制下游核转录因子AP-1和P65/NF-κB的表达起到抑制HSC-T6活化的作用。提示SSd可能是柴胡的调经、改善绝经前后诸症、保肝、治疗肝纤维化等多种药理作用的物质基础。SSd具有多途径防治肝病的药理作用,但许多研究工作要进一步深化,比如其他方面的药理活性,有无长期的毒性作用,及其吸收、分布、代谢及排泄等各个环节均应进行深入细致的研究,以寻找活性代谢物,更好地揭示其发挥药效的作用机制及物质基础,从而为其在临床上的推广应用提供可靠的依据。
[1]金树根,王灵台,任家潍,等.二甲基亚硝胺致大鼠肝纤维化的造模研究.中西医结合肝病杂志,1994(1):28
[2]Yong L I,Peng W,Ren J L,et al.Estrogen-like effects of saikosaponin-d in mice.Journal of Chinese Integrative Medicine,2009,7(7):657
[3]Li X,Meng Y,Wu P,et al.AngiotensinⅡand Aldosterone stimulating NF-kappaB and AP-1 activation in hepatic fibrosis of rat.Regul Pept,2007,138:15
[4]Chen A,Davis B H.The DNA Binding Protein BTEB Mediates Acetaldehyde-Induced,Jun N-Terminal Kinase-Dependent αI(I)Collagen Gene Expression in Rat Hepatic Stellate Cells.Molecular&Cellular Biology, 2000,20:2818
[5]Shimizu I,Kohno N,Tamaki K,et al.Female hepatology:favorable role of estrogen in chronic liver disease with hepatitis B virus infection.World J Gastroenterol,2007,13(32):4295
[6]张达利,王健,李毅平,等.性激素及其受体与肝硬化的相关性.世界华人消化杂志,2009,17(36):3749
[7]Yasuda M,Shimizu I,Shiba M,et al.Suppressive effects of estradiol on dimethylnitrosamine-induced fibrosis of the liver in rats.Hepatology,1999,29(3):719
[8]Liu Q H,Li D G,Huang X,et al.Suppressive effects of 17β-estradiol on hepatic fibrosis in CCl4-induced rat model.World J.Gastroenterol,2004,10:1315
[9]Shimizu I,Mizobuchi Y,Yasuda M,et al.Inhibitory effect of oestradiol on activation of rat hepatic stellate cells in vivo and in vitro.Gut,1999,44(1):127
R282.710.5
A
1672-397X(2015)12-0081-04
沈艳婷(1990—),女,硕士研究生,从事消化系统疾病的临床与基础研究。
李勇,博士,主任医师,博士生导师。liyong8256@126.com
2015-08-06
编辑:吴宁
上海市自然科学基金资助项目(09ZR1429700);第二批上海市卫生系统优秀学科带头人和优秀青年人才培养计划基金资助项目(沪卫计委科教[2013]9号-50)
