MMP- 3对大鼠牙髓损伤后修复性牙本质形成的促进作用及意义
2015-11-21刘继明李正强张颖丽
李 雯, 尹 硕, 张 娟, 王 贺, 刘继明, 罗 莹, 李正强, 张颖丽
(吉林 长春 130021: 1.吉林大学口腔医院; 2 .长春市中医院)
·基础研究·
MMP- 3对大鼠牙髓损伤后修复性牙本质形成的促进作用及意义
李 雯1, 尹 硕1, 张 娟1, 王 贺1, 刘继明1, 罗 莹2, 李正强1, 张颖丽1
(吉林 长春 130021: 1.吉林大学口腔医院; 2 .长春市中医院)
目的: 研究基质金属蛋白酶3(MMP- 3)对牙髓损伤后修复性牙本质形成的作用。方法:取48只Wistar大鼠,分为3组(n=16);在各组大鼠的左侧上颌第一磨牙牙合面备洞至露髓后,分别用PBS、氢氧化钙、MMP- 3(均以胶原蛋白海绵做载体)盖髓。于术后3、7、14、28d各时间点,每组各随机处死4只动物,制备实验牙组织切片;HE和免疫组化染色,观察各组修复性牙本质形成及成牙本质细胞中DMP- 1的表达情况。结果:MMP- 3组在盖髓后DMP-1的表达情况: 3d时,呈弱阳性表达;7d时,呈阳性表达,露髓点下方可见散在的骨样牙本质;14d时, 呈强阳性表达,露髓点下方可见连续完整的钙化桥;28d时,表达明显减弱,露髓点下方可见大量修复性牙本质。各时间点各组成牙本质细胞中DMP- 1阳性区的灰度值均以MMP- 3组最高,PBS组最低;MMP- 3组与PBS组相比,在术后3、7、14d时均有显著性差异(P<0.05);MMP- 3组与氢氧化钙组相比,在术后3、7d时有显著性差异(P<0.05)。结论:MMP- 3对牙髓损伤后修复性牙本质的形成具有促进作用。
基质金属蛋白酶3; 牙髓; 损伤修复; 成牙本质细胞
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.08.001
[Chinese Journal of Conservative Dentistry,2015,25(8):453]
牙本质基质蛋白-1(DMP- 1)是一种酸性磷酸化的细胞外基质蛋白,是矿化组织中非胶原蛋白的重要组成部分,在牙齿中主要表达于分泌型成熟的成牙本质细胞[1],也是成牙本质细胞的特异性蛋白。牙髓组织在受到外界各种刺激(如外伤、放射线、化学药物、备洞时的机械力等)时,会出现一系列的反应以抵御刺激并进行自身修复[2-5]。在形成修复性牙本质的过程中,成牙本质细胞分泌活动的调节和成牙本质细胞样细胞的分化对损伤后牙髓的修复起着极其重要的作用[6]。有研究表明[7],DMP- 1在深龋的成牙本质细胞样细胞胞浆和修复性牙本质中均呈强阳性表达,说明DMP- 1参与了牙髓的自身修复过程,并能反映牙髓损伤后硬组织的修复性再生情况。
近年来,研究较多的基质金属蛋白酶3(Matrix metalloproteinase 3 ,MMP- 3)是基质金属蛋白酶家族的重要成员, 其能降解多种细胞外基质成分,不仅参与组织形态发生、损伤修复、炎症反应等一系列生理、病理过程;还在风湿性关节炎[8]、动脉粥样硬化[9]、乳腺癌[10]等疾病和肿瘤的发生、发展中发挥重要作用。已有体外实验[11]证明,MMP- 3在成熟牙齿的矿化牙本质中呈高表达,所以大胆猜想 MMP- 3可能参与了硬组织的矿化过程。
目前关于MMP- 3对牙髓损伤修复效果的研究甚少。本实验在构建大鼠牙髓机械性损伤的基础上建立模型,分别将 MMP- 3、氢氧化钙、PBS置于损伤牙髓断面;然后以DMP- 1作为修复性牙本质形成的特异性标志物[12],分别观察不同盖髓剂盖髓后成牙本质细胞中DMP- 1的表达情况,以期探讨MMP- 3对修复性牙本质形成的作用。
1 材料和方法
1.1 主要材料和试剂
清洁级雄性Wistar大鼠(吉林大学实验动物中心提供);1/4钨钢球钻、高速涡轮机(上海医用器械设备厂);30 g/L水合氯醛、乙醚(长春市永辉化工商贸有限公司);胶原蛋白海绵(吉林大学口腔颌面外科提供);基质金属蛋白酶3(Sigmag公司,美国);氢氧化钙(登士柏,日本);DMP- 1 单克隆抗体、DAB显色试剂盒(福州迈新生物技术开发有限公司);富士Ⅸ玻璃离子(吉林大学口腔医院提供 );显微镜和照相系统(OLYMPUS, BX71,日本)。
1.2 实验动物分组及盖髓处理
1.2.1 实验动物的选择和分组
取8周龄健康雄性Wistar大鼠48只(体质量180~220 g),所有大鼠牙体、牙列完整,咬合关系正常,无龋病、牙周病及牙齿畸形;用软硬混合饲料适应性饲养两周后,按不同盖髓剂随机分为3大组(n=16):阴性对照组(PBS盖髓)、阳性对照组(氢氧化钙盖髓)、实验组(MMP- 3盖髓), 每组大鼠再根据观察时间各随机分为3、7、14、28 d 4个亚组(n=4)。
1.2.2 牙髓损伤模型的制备及盖髓处理
上述各组Wistar大鼠称重后,用30 g/L水合氯醛肌肉注射(3 mL/kg)进行麻醉。然后将各大鼠仰卧位固定于手术板上,20 g/L碘伏消毒口腔后,用1/4球钻分别在每只大鼠的左侧上颌第一磨牙牙合面中央制洞,当出现细小穿髓点时立即停止;用生理盐水充分冲洗,无菌棉球压迫止血并干燥窝洞后,按分组进行盖髓:实验组露髓处放置含MMP- 3(100 μg/μL)的胶原蛋白海绵; 阴性对照组露髓处放置含PBS(100 μg/μL)缓冲液的胶原蛋白海绵; 阳性对照组露髓处放置含氢氧化钙糊剂(100 μg/μL)的胶原蛋白海绵,最后用玻璃离子(富士Ⅸ)充填窝洞。以上所有操作均由一名临床经验丰富的医生单独完成。
1.3 取材及组织切片制备
所有大鼠分别于盖髓术后3、7、14、28 d用40 g/L多聚甲醛心内注处死后,迅速分离各大鼠的上颌骨并制备包含左侧上颌第一磨牙的骨组织块。然后将各组骨组织块置于新配置的40 g/L多聚甲醛中,常温固定48 h后置于100 g/L EDTA(pH=7.4)溶液中脱钙8周;梯度乙醇脱水、二甲苯透明、常规石蜡包埋后,平行于牙体长轴方向做近、远中向连续切片(厚5 μm)。最后选取各组通过穿髓孔的组织切片用于以下观察。
1.4 HE染色观察
取上述各组组织切片常规脱蜡至水,分别经苏木素染色5 min、流水返蓝15 min、伊红染色3 min、流水冲洗5 min后,梯度乙醇脱水、二甲苯透明、中性树胶封片;然后在显微镜下观察各组修复性牙本质的形成情况并采集图像。
1.5 免疫组化染色观察
取上述各组组织切片脱蜡至水,用PBS 洗涤并
擦干组织周围的多余水分后,浸入新鲜配置的30 mL/L过氧化氢液中室温孵育10 min以灭活内源性的过氧化氢酶; 0.1 mol/L PBS洗涤5 min×3次,滴加正常非免疫动物血清封闭 30 min;甩去多余液体,不洗,滴加稀释的DMP- 1单克隆抗体 (1 ∶200), 4 ℃ 湿盒过夜;次日37 ℃复温45 min,0.1 mol/L PBS洗5 min×3次,滴加生物素化二抗IgG(山羊抗兔)孵育20 min; 0.1 mol/L PBS洗5 min×3次,滴加链酶亲和素-生物素-过氧化物酶复合物(SABC)孵育20 min; 0.1 mol/L PBS洗5 min×3次,DAB显色后,苏木精轻度复染胞核1~3 min;流水冲洗,梯度乙醇水化后,二甲苯透明(5~10 min)、中性树胶封片,显微镜下观察DMP- 1表达情况并照相。同时,在高倍镜下从每张切片的染色阳性区各随机选取3个不重叠区域,用Image- Pro Plus软件测其阳性灰度值,并取均值。
1.6 统计学分析
2 结果
2.1 HE染色观察结果
PBS组:盖髓后3 d时,露髓点下方有大量炎细胞聚集(较MMP- 3组炎症反应重),呈化脓性征兆(图1a);7 d时,炎症细胞数量进一步增多,可见少量前期牙本质形成(图1b);14 d时,露髓点下方炎细胞密集,可见前期牙本质不均匀增厚而形成的少量修复性牙本质(图1c);28 d时,可见髓室内的牙髓呈变性坏死征兆 (图1d)。


a.术后3d,炎症反应明显,成牙本质样细胞活跃b.术后7d,露髓点下方大量炎细胞聚集,成牙本质细胞排列紊乱,有前期牙本质形成c.术后14d,穿髓孔下方仍有大量炎细胞聚集,可见前期牙本质增厚而形成的修复性牙本质d.术后28d,前期牙本质增厚而形成的少量修复性牙本质,髓腔中有局限的液化变性坏死灶
图1 盖髓术后不同时间点PBS组大鼠的牙髓组织学观察(#示前期牙本质, *示修复性牙本质; HE染色)
氢氧化钙组:盖髓后3 d时,露髓点下方可见大量炎细胞及明显扩张的血管(图2a);7 d时,穿髓孔下方的炎细胞和扩张的血管数目进一步增多(图2b);14 d时,可见少量不连续的钙化桥形成,并可见牙髓呈坏死征兆(图2c);28 d时,牙髓钙化坏死(图2d)。
MMP- 3组:盖髓后3 d时,露髓点下方有少量炎细胞聚集,并可见明显扩张的血管及新生血管(图3a);7 d时,炎症和血管扩张明显,露髓点下方可见少量前期牙本质及散在的骨样牙本质(图3b);14 d时,穿髓孔下方可见连续完整的钙化桥形成,无明显炎细胞浸润(图3c);28 d时,露髓点下方可见大量修复性牙本质,无明显炎细胞浸润(图3d)。
2.2 DMP- 1免疫组化染色观察结果
PBS组:盖髓后3 d时,穿髓孔下方的成牙本质细胞几乎无阳性表达(图4a);7 d时呈弱阳性表达(图4b);14 d时呈阳性表达,但其强度较MMP- 3 组和氢氧化钙组弱(图4c);28 d时穿髓孔下方的成牙本质细胞几乎无阳性表达(图4d)。
氢氧化钙组:盖髓后3 d时,穿髓孔下方的成牙本质细胞呈弱阳性表达(图5a);7 d时呈阳性表达(图5b);14 d时呈强阳性表达,且其表达强度介于PBS组和MMP- 3组之间(图5c);28 d时呈弱阳性表达(图5d)。
MMP- 3组:盖髓后3 d时,穿髓孔下方的成牙本质细胞呈弱阳性表达(图6a);7 d时呈阳性表达(图6b);14 d时呈强阳性表达(图6c);28 d时呈弱阳性表达(图6d)。
各组DMP- 1染色阳性区的灰度值分析结果显示:盖髓后3、7、14、28 d各时间点,各组灰度值由高至低依次为MMP- 3组、氢氧化钙组、PBS组;MMP- 3组与PBS组灰度值相比,术后3、7、14 d各时间点均有统计学差异(P<0.05), 术后28 d时差异无统计学意义(P>0.05);MMP- 3组与氢氧化钙组相比,术后3、7 d各时间点,两者的灰度值均有统计学差异(P<0.05),术后14、28 d各时间点,两者的灰度值差异均无统计学意义(P>0.05)(表1)。

a.术后3d,炎症反应明显,血管扩张b.术后7d,露髓点下方有大量炎细胞聚集,扩张血管数目增多c.术后14d,穿髓孔下方形成不连续钙化桥,可见牙髓呈坏死征兆 d.术后28d,牙髓钙化坏死
图2 盖髓术后不同时间点氢氧化钙组大鼠的牙髓组织学观察(#示扩张血管, *示修复性牙本质; HE染色)


a.术后3d,炎症反应较轻,可见新生血管,成牙本质细胞排列正常b.术后7d,血管扩张,成牙本质细胞活跃,露髓点下方见前期牙本质形成及散在的骨样牙本质c.术后14d,成牙本质细胞增生活跃,炎症反应减轻,露髓点下方有连续的钙化桥形成d.术后28d,成牙本质细胞活跃程度减弱,露髓点下方已形成大量修复性牙本质
图3 盖髓术后不同时间点MMP- 3组大鼠的牙髓组织学观察(#示新生血管, *示修复性牙本质; HE染色)
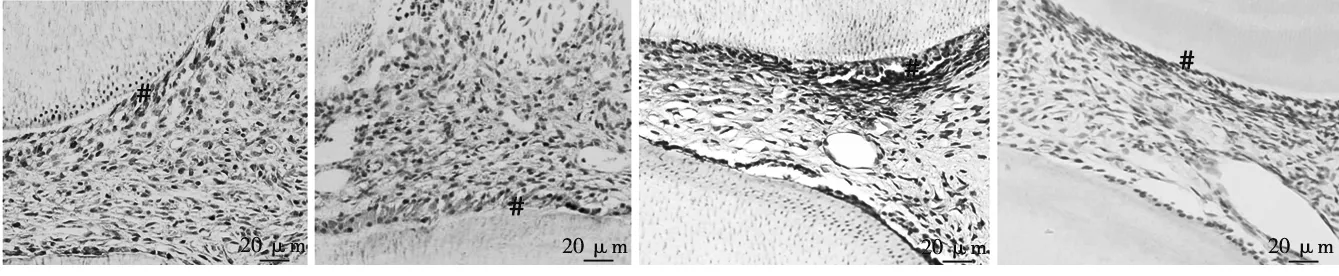

a.术后3d,几乎无阳性表达 b.术后7d,呈弱阳性表达c.术后14d,呈阳性表达,弱于实验组d.术后28d,几乎无阳性表达
图4 盖髓术后不同时间点PBS组DMP- 1免疫组化染色 (#示成牙本质细胞)


a.术后3d,呈弱阳性表达b.术后7d,呈阳性表达c.术后14d,呈强阳性表达d.术后28d,呈弱阳性表达
图5 盖髓术后不同时间点氢氧化钙组DMP- 1免疫组化染色 (#示成牙本质细胞)


a.术后3d,呈弱阳性表达b.术后7d,呈阳性表达c.术后14d,呈强阳性表达d.术后28d,呈弱阳性表达

图6 盖髓术后不同时间点MMP- 3组DMP- 1免疫组化染色 (#示成牙本质细胞)
*与PBS组相比P<0.05;#与氢氧化钙组相比P<0.05
3 讨论
牙髓组织的自身修复是很复杂的过程,而且取决于炎症的程度及其他相关因素。炎症较重时,一方面,未分化的牙髓干细胞向损伤处迁移并分化为成牙本质细胞样细胞来抵抗外界刺激[13];另一方面,牙髓组织中的一些细胞外基质蛋白如牙本质涎磷蛋白(DSPP)、基质金属蛋白酶(MMPs)和细胞因子如转化生长因子β(TGF- β)、胰岛素样生长因子1(IGF- 1)等可通过自身的调节作用来参与牙髓组织的修复[14]。而且有研究证明,成牙本质细胞样细胞通过分泌基质蛋白形成修复性牙本质是牙髓损伤修复的关键环节[15-16]。近年来,关于牙髓受损后的保髓治疗已成为备受关注的牙髓治疗方法,即在牙髓的创伤面上放置保护性材料,可使牙髓-修复体界面形成连续的牙本质桥,并最终形成修复性牙本质。MMPs是一类在细胞外基质的生理性和病理性降解过程中起重要作用的蛋白酶超家族,它广泛存在于各结缔组织中,并与多种疾病的发生有着紧密的联系[17-19]。在病理条件下,MMP- 3不仅可降解细胞外基质,还可通过诱导细胞的增殖、迁移而完成组织的重建过程[20-21],是参与机体损伤组织修复的重要因子。
本实验首次将MMP- 3作为盖髓剂用于大鼠牙髓损伤的盖髓治疗,并以PBS、氢氧化钙作为对照,分别观察不同盖髓剂盖髓后成牙本质细胞中DMP- 1的表达情况,以探讨MMP- 3对修复性牙本质的形成作用。HE染色结果显示:PBS组牙髓组织炎症反应从3 d开始就较明显,盖髓后期(14 d)仅有少量修复性牙本质形成,但依然可见一定范围内的炎细胞浸润及牙髓坏死征兆。氢氧化钙组在盖髓初期的牙髓炎症反应亦较重,14 d时髓腔逐渐缩小并形成不连续的钙化桥,虽然氢氧化钙的强碱性可以中和牙髓炎症产生的酸性物质[22],但在28 d时牙髓组织仍出现了凝固性变性坏死。而MMP- 3组在盖髓后3 d时,其牙髓组织的炎症反应即较PBS组和氢氧化钙组轻,并可见新生血管的形成,从而证实了MMP- 3在牙髓损伤修复过程中可以促进血管再生的说法[23];从7 d开始,前期牙本质逐渐增厚而形成连续的钙化桥,并最终形成明显的修复性牙本质。有学者通过建立成年大鼠轻度牙髓损伤修复模型证实,当牙髓的炎症局限于露髓点下方较小范围时, MMP- 3有一定的抗炎作用[24]。结合本实验中MMP- 3可以促进血管再生和修复性牙本质形成的结果, 提示MMP- 3是一种良好的盖髓剂。免疫组化染色结果显示,DMP- 1在MMP- 3组成牙本质细胞中的阳性表达从第3天开始出现,随后逐渐增强并于盖髓后第14天达到最高峰, 28 d时阳性表达明显减弱。盖髓术后各时间,各组成牙本质细胞中DMP- 1表达阳性区的平均灰度值均以MMP- 3组最高,PBS组最低。MMP- 3组与PBS组相比,在术后3、7、14 d时具有显著性差异(P<0.05);MMP- 3组与氢氧化钙组相比,在术后3、7 d时具有显著性差异(P<0.05)。以上结果说明,MMP- 3在炎症初期和中期可增强成牙本质细胞和牙髓细胞的活跃性,使之在受到外界刺激时可通过分泌DMP- 1而逐渐形成修复性牙本质;28 d时成牙本质细胞活跃程度降低,其分泌的DMP- 1也相应减少,所以DMP- 1的阳性表达也减弱。
综上所述,将 MMP- 3置于损伤牙髓的露髓处,对增强成牙本质细胞的活跃性和提高修复性牙本质的形成能力均有一定的促进作用,证实了Biochem等[25]报道的MMP- 3可诱导炎症牙髓细胞的生长、分化、迁移和矿化这一实验结论。本结果提示,基质金属蛋白酶-3(MMP- 3)是一种良好的盖髓剂,可与氢氧化钙等盖髓剂联合应用于临床,为开发新的盖髓剂提供了理论基础和新思路。
[1]Jacob A,Zhang Y,George A,etal.Transcriptional regulation of dentin matrix protein 1 (DMP1) in odontoblasts and osteoblasts[J].ConnectTissueRes, 2014,55(1):107-112.
[2]Mead B, Logan A, Berry M,etal. Intravitreally transplanted dental pulp stem cells promote neuroprotection and axon regeneration of retinal ganglion cells after optic nerve injury[J].InvestophthalmolVisSci, 2013,54(12):7544-7556.
[3]Simon S, Smith AJ. Regenerative endodontics[J].BrDentJ, 2014,216(6):E13.
[4]郝靖惠,杨博,白庆霞,等. 骨髓间充质干细胞参与牙髓损伤修复的体内实验研究[J]. 牙体牙髓牙周病学杂志,2012,22(4):189-193.
[5]Lee YL, Liu J, Clarkson BH,etal. Dentin- pulp complex response to carious lesions [J].CariousRes, 2006,40(3):256-264.
[6]Taira Y, Shinkai K, Suzuki M,etal. Direct pulp capping effect with experimentally developed adhesive resin systems containing reparative dentin- promoting agents on rat pulp:mixed amounts of additives and their effect on wound healing[J].Odontology, 2011,99(2):135-147.
[7]逢键梁,吴补领,张亚庆,等. 牙本质基质蛋白在人不同龋坏牙齿中的免疫定位[J]. 实用口腔医学杂志, 2003,19(5):414-417.
[8]Mamehara A, Sugimoto T, Sugiyama D,etal. Serum matrix metalloproteinase- 3 as predictor of joint destruction in rheumatoid arthritis, treated with non- biological disease modifying anti-rheumatic drugs[J].KobeJMedSci, 2010,56(3):E98-E107.
[9]Samnegård A, Silveira A, Lundman P,etal. Serum matrix metalloproteinase- 3 concentration is influenced by MMP- 3- 1612 5A/6A promoter genotype and associated with myocardial infarction[J].JInternMed, 2005,258:411-419.
[10]LaBarge MA. Breaking the canon: indirect regulation of Wnt signaling in mammary stem cells by MMP3[J].CellStemCell, 2013,13(3):259-260.
[11]Mazzoni A, Papa V, Nato F,etal. Immunohistochemical and biochemical assay of MMP- 3 in human dentine[J].JDent, 2011,39(3):231-237.
[12]Choussain C, Eapen AS, Huet E,etal. MMP2- cleavage of DMP1 generates a bioactive petide promoting differention of dental pulp stem / progenitor cell[J].EurCellMater,2009,18:84-95.
[14]Horda MJ, Watonabe E, Mikami Y,etal. Mesenchymal dental stem cells for tissues regeneration[J].IntJOralMaxillofacImplants, 2013,28(6):e451-e460.
[15]丛明宇,赵亮,常蓓,等. 修复性牙本质形成的机理与调控[J]. 牙体牙髓牙周病学杂志,2014,24(10):615-622.
[16]Murrary PE, Hafez AA, Smith AJ,etal. Hierarchy of pulp capping and repair activities responsible for dentin brige formation[J].AmJDent, 2002,15(4):236-243.
[17]Gronthos S, Mankani M, Brahim J,etal. Postnatal human dental pulp stem cells(DPSCS) in vitro and in vivo[J].ProcNatlAcadSciUSA, 2000, 97(25):13625-13630.
[18]Iyer RP, Patterson NL, Fields GB,etal. The history of the matrix metalloproteinases: milestones, myths, and misperceptions[J].AmJPhysiolHeartCircPhysiol, 2012, 303(8):H919-H930.
[19]Galliera E, Randelli P, Dogliotti G,etal. Matrix metalloproteinases MMP- 2 and MMP- 9 :are they early biomarkers of bone remodeling and healing after arthroscopic armoioplasty? [J].Injury, 2010,41(11): 1204-1207.
[20]田鲲,陈宇,耿宁,等. 基质金属蛋白酶及其组织抑制剂表达失衡与涎腺恶性肿瘤浸润生长的关系[J]. 华西口腔医学杂志, 2005,23(4):273-279.
[21]Yamashita CM, Dolgonos L, Zemans RL,etal. Matrix metalloproteinase 3 is a mediator of pulmonary fibrosis[J].AmJPathol, 2011,179(4):1733-1745.
[22]Li M, Moeen Rezakhanlou A, Chavez- Munoz C,etal. Keratinocyte- releasable factors increased the expression of MMP1 and MMP3 in co- cultured fibroblasts under both 2D and 3D culture conditions[J].MolCellBiochem, 2009,332(1/2):1-8.
[23]Swarup SJ, Rao A, Boaz K,etal. Pulpal response to nano hydroxyapatite, mineral trioxide aggregate and calcium hydroxide when used as a direct pulp capping agent: an in vivo study[J].JClinPediatrDent, 2014, 38(3): 201-206.
[24]Zheng L, Amano K, Iohara K,etal. Matrix metalloproteinase- 3 accelerates wound healing following dental pulp injury[J].AmJPathol, 2009, 175(5): 1905-1914.
[25]Eba H, Murasawa Y, Iohara K,etal. The anti- inflammatory effects of matrix metalloproteinase- 3 on irreversible pulpitis of mature erupted teeth[J].PLoSOne, 2012,7(12):e52523.
[26]Eguchi T, Kubota S, Kawata K,etal. Novel transcription factor-like function of human matrix metalloproteinase 3 regulating the CTGF/CCN2 gene[J].MolCellBiol, 2008, 28(7):2391-413.
Effects of MMP-3 on the reparative dentin formation in rats after dental pulp injury
LI Wen*, YIN Shuo, ZHANG Juan, WANG He, LIU Ji- ming , LUO Ying, LI Zheng- qiang , ZHANG Ying- li
(*DepartmentofEndodontics,SchoolofStomatology,JilinUniversity,Changchun130021,China)
AIM: To study the role of MMP- 3 on the reparative dentin formation after pulp injury. METHODS: 48 Wistar rats were divided into 3 groups(n=16). A cavity on the occlusal surface of maxillary first molars on left side was prepared in each rat, PBS, calcium hydroxide, and MMP-3 was applied on the exposed pulp in the rats of the 3 groups respectively. On day 3, 7, 14 and 28 after operation, the rats were sacrificed. The tooth were stained with HE and immunohistochemistry.DMP- 1 expression was observed. RESULTS: In MMP- 3 group, DMP- 1 was weakly expressed on d 3, positively expressed on d 7 and strongly expressed on d 14, but its expression decreased on d 28 in odontoblasts. A large number of scattered osteoid dentin was observed under the exposed pulp on d 7. Continuous calcified bridge was observed under the exposed pulp on d 14 . A thick layer of reparative dentin was observed under the exposed pulp, MMP- 3 group showed stronger DMP- 1exoression(P<0.05) and more reparative dentin than PBS group at each time point, and than calcium hydroxide group on d 3 and d 5. CONCLUSION: MMP- 3 may promote the repair of dental pulp after injury.
matrix metalloproteinase 3(MMP-3); dental pulp; wound healing; odontoblas
2015-01-07
吉林省科技发展计划(20130102096JC)
李 雯(1989-),女,汉族,山西长治人。硕士生(导师:张颖丽)
张颖丽,E-mail:zhangyingli1989@163.com
R
A
1005-2593(2015)08-0453-07
长春市科技计划项目 (12SF88)
