典型生活垃圾填埋场覆盖土微生物群落分析
2015-11-20赵天涛邢志林袁建华重庆理工大学化学化工学院重庆400054重庆大学城市建设与环境工程学院重庆400030
何 芝,赵天涛,2*,邢志林,2,袁建华(.重庆理工大学化学化工学院,重庆 400054;2.重庆大学城市建设与环境工程学院,重庆 400030)
典型生活垃圾填埋场覆盖土微生物群落分析
何 芝1,赵天涛1,2*,邢志林1,2,袁建华1(1.重庆理工大学化学化工学院,重庆 400054;2.重庆大学城市建设与环境工程学院,重庆 400030)
采用第二代高通量测序技术Illumina MiSeq对典型生活垃圾填埋场覆盖土样(山东莱芜,SD;广东深圳,GD;上海老港,SH;重庆长生桥,CQ)进行16S rDNA V3~V4区高通量测序,并分析了Alpha多样性、物种组成和丰度、菌群结构及环境因子对群落结构的影响.结果表明:取自垃圾填埋场GD土样的物种种类多于其他土样,GD、SD、SH、CQ土样的Shannon指数分别为5.52±0.026、4.76±0.030、4.89±0.037、3.43±0.027;所有覆盖土样的优势菌为Alphaproteobacteria(α-变形杆菌纲)和Betaproteobacteria(β-变形杆菌纲),所占比例范围分别为12.67%~25.54%,14.35%~18.88%;SD、GD和SH三种覆盖土样的优势菌为Sphingomonas(鞘氨醇单胞菌属),分别占7.25%、10.67%、11.30%;Deltaproteobacteria(德耳塔变形杆菌纲)和Gammaproteobacteria(γ-变形菌杆纲)的相对丰度分别与TN(r=1.00,P<0.001)和TP(r=1.00,P<0.001)呈正相关关系,且结合RDA图,TN、TP和OM含量可能是SD土样区别于其他土样群落组成的主要因素.
Illumina MiSeq测序;垃圾填埋场覆盖土;微生物多样性;群落结构;环境因子
垃圾填埋气由200多种挥发性有机化合物组成,包括甲烷、二氧化碳、硫化氢以及痕量气体如C2-C10烷烃、C2-C4烯烃、芳香族和卤代烃类等有机化合物,排放于大气中会造成臭氧层空洞、温室效应等环境问题的加重.覆盖土微生物经填埋气长期驯化,对填埋气中有毒有害物质具有较高的耐受性,并且具备了能够降解烷烃、烯烃、芳香族等有害物质的能力[1],极大地降低了填埋气中污染物的浓度.Lakhouit等[2]模拟覆盖土层对垃圾填埋气中BTEX(苯、甲苯、乙苯、二甲苯同分异构体)挥发性有机物和OVOC (其他挥发性有机物)排放的影响,研究表明覆盖层对BTEX和OVOC的降解效率范围分别在67%~100%之间和96%~97%之间.张云茹等[3]对覆盖土中甲烷氧化菌氯代烃降解能力进行研究,结果表明三氯乙烯初始浓度为15.64μmol/L,反应时间为5d时,甲基孢囊菌Methylocystis sp. JTC3对TCE的降解率为93.79%.
微生物的群落结构及多样性是微生物生态学和环境科学研究的重点内容,对于开发生物资源,阐明微生物群落与其生境的关系,揭示群落结构与功能的联系,从而指导微生物群落结构功能的定向调控具有重要价值.由于覆盖土中绝大多数的微生物是不可培养或非活性状态存在,采用传统培养分离方法并不能代表该生境内真正的微生物多样性.而荧光原位杂交(FISH)、末端限制性酶切片段长度多态性分析(T-RFLP)、变形梯度凝胶电泳(DGGE)、基因芯片技术等[4]分子生物学技术虽能够绕开分离和培养,但受到样品大小、采集等因素的影响,且许多微生物需在分离培养后才能透彻的对其研究,进而阻碍了覆盖土微生物群落结构及多样性的研究[5].近年来,以测序通量高、成本低、定量准为特点的高通量测序技术(如Roche 454测序技术、IIumina的MiSeq和HiSeq测序技术)的出现,使得微生物多样性及群落结构的研究更深入、更全面.Kim等[6]模拟垃圾填埋场覆盖层甲烷降解,通过基于DNA和RNA的核糖体标签焦磷酸测序对细菌群落进行分析研究,研究表明甲烷氧化菌活跃区域RNA占80%,而DNA占20%.大部分研究利用分子生态学方法(FISH、T-RFLP等)对垃圾填埋场覆盖土微生物进行研究.Su等[7]研究了甲烷和甲苯、甲烷、甲苯3种体系对垃圾填埋场覆盖土甲烷氧化菌群落结构及活性的影响,研究表明在3种体系中Proteobacteria和Bacteroidetes为优势菌,且甲烷和甲苯共代谢体系对甲烷氧化菌和甲苯降解细菌具有较大影响.多数关于填埋场覆盖土的研究都是基于覆盖土具有良好的甲烷生物氧化能力[8],而忽视了其他微生物在污染降解中的作用,他们既可降解其他非甲烷有机污染物,同时也能通过共代谢等作用影响甲烷氧化菌的活性.此外,不同土壤因氮磷含量、酸碱度、有机质含量及水分含量等的不同,其微生物群落结构及多样性具有一定差异.Zhang等[9]研究NH4+-N含量对覆盖土中微生物甲烷菌的影响,研究表明NH4+-N含量的增加会促进Methylobacter的生长.Liu等[10]研究表明pH值是土壤微生物群落变化的因素之一,然而大部分未测量的变化因素还未被解释到.据此,本文考察了国内华东、华南和西南地区的典型生活垃圾填埋场,基于不同地区垃圾填埋场覆盖土理化性质的不同,对微生物群落结构及多样性进行初步研究,分析细菌微生物群落结构在自然条件下覆盖土层中的演变规律,了解理化性质与微生物群落组成之间的关系,为功能菌筛选及填埋场覆盖层微生物降解优化工艺提供理论依据.
1 材料与方法
1.1 垃圾填埋场描述
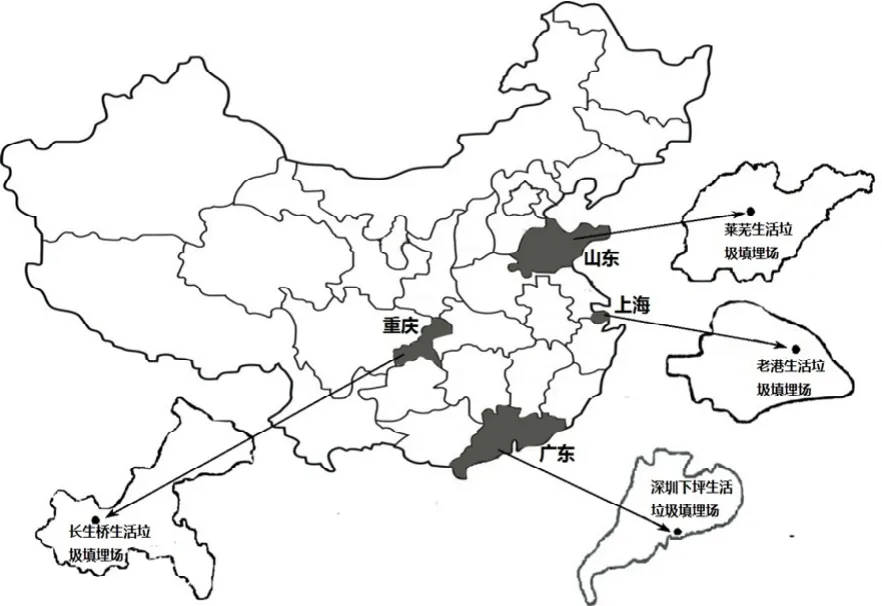
图1 填埋场地理位置Fig.1 Location of study landfills
选取了4个国内规模较大、填埋较规范的卫生填埋场进行采样分析,填埋场所处的地理位置不同、气候环境各有差异,具有一定的地域代表性.4个生活垃圾填埋场的地理分布情况如图1所示,山东莱芜(36°02′N, 117°19′E)生活垃圾填埋场位于山东省中部,泰山东麓,占地面积为20×104m2,日处理量400t,使用期限超过20年[11];广东深圳(22°27′N, 113°46′E)下坪生活垃圾填埋场位于深圳市罗湖区和布吉镇交接处,库容量为46.93×106m3,使用期限可达30年以上[12];上海南汇区(31°2′N, 121°4′E)老港生活垃圾填埋场占地面积为33.6×105m2,每天消纳城市生活垃圾6000~8000t[13];重庆南岸区(29°35′N, 106°33′E)长生桥生活垃圾填埋场,占地69.14×104m2,库容12×106m3,使用期限超过20年[14].
1.2 土样的采集和处理
土样的采集于2013年8月进行,均采集垃圾填埋场覆盖层10cm以下的土壤.山东莱芜、广东深圳下坪、上海老港和重庆长生桥城市生活垃圾填埋场覆盖土样分别编号为SD、GD、SH、CQ.用网孔为2mm的筛子将废物、石头等物质滤去,留下粒径较小的土样.每种土样取部分于50mL的离心管中,置于-20℃冰箱中以备DNA提取和土壤理化性质检测.
1.3 土壤DNA提取
用Mobio PowerSoil® DNA Isolation Kit提取土壤样品中微生物总基因组DNA.并利用Mobio PowerClean® DNA Clean-Up Kit完成对DNA的纯化.纯化后的DNA产物经1%琼脂糖凝胶电泳进行检测.
1.4 PCR扩增
以部分纯化后的DNA为扩增模板,用细菌16S rDNA V3~V4区通用引物(338F:5'-ACTCCTACGGGAGGCAGCA-3'及806R:5'-GGACTACHVGGGTWTCTAAT-3')和TransGen AP221-02:TransStart Fastpfu DNA聚合酶,使用ABI GeneAmp® 9700型PCR仪进行扩增.20μL PCR反应体系中包括各0.8μL的引物,10μL的DNA模板,dNTPs(2.5mmol/L)4μL,0.4μL FastPfu聚合酶,4μL 5×PCR buffer.PCR扩增升温程序为:94℃预变性5min;94℃变性35s、59℃退火30s、72℃延伸35s,30个循环,最后于72℃延伸5min,4℃保存.每个样品3个重复,将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测.
1.5 上机测序
样本定量、DNA序列修饰及验证和混合文库后,将其定量稀释至4~5pmol/L后放于Illumina MiSeq测序仪中测序,使用合成测序法,测定长度2×250bp.
1.6 数据分析
1.6.1 原始数据处理与样品序列数目统计 对16S rDNA高变区序列采用双峰(pair-end)测序,测序区域为V3~V4区.首先将原数据进行质量控制,除去低质量序列(50个连续碱基平均质量值低于20).利用Flash软件对质量控制序列进行对应两端序列的连接,将连接上的序列进行过滤(连续相同碱基<10,最大错配比率为0.2),最终获得可分析的序列.
1.6.2 OTU列表生成 应用Qiime,在Usearch软件平台中使用uparse方法将序列按照彼此相似性为97%分归为许多小组,一个小组为一个操作分类单元(OTU),从而得到OTU的代表序列.然后,使用uchime检测PCR扩增中产生的嵌合体序列并从OTU中去除,再用usearch_global方法将优化序列map比对回OTU代表序列,最终得到OTU各样品序列丰度统计表.
1.6.3 稀释曲线及多样性指数 根据获得的OTU数据,并利用R软件以个体数与物种数来构建稀释曲线,以该曲线表明样品的取样深度.多样性指数可以反映微生物群落的丰度和多样性,其计算公式如下:
Chao-the chao1estimator:
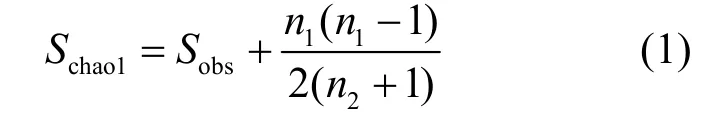
式中:Schaol为估计的OTU数;Sobs为实际观测到的OTU数;n1为只含有一条序列的OTU数目;n2为只含有两条序列的OTU数目.

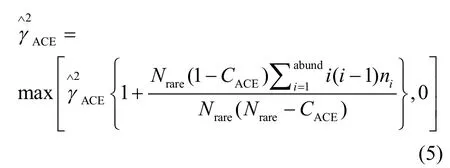
式中:ni为含有i条序列的OTU数目;Srare为含有“abund”条序列或者少于“abund”的OTU数目;Sabund为多于“abund”条序列的OTU数目;abund为“OTU”阈值,默认为10.
Shannon-the Shannon index:
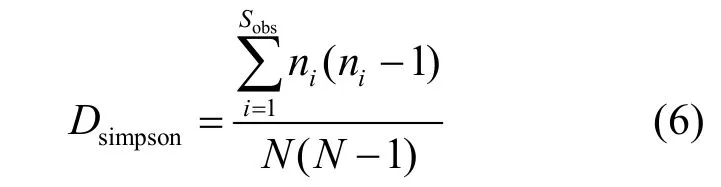
式中:Sobs为实际观测到的OTU数目;ni为含有i条序列的OTU数目;N为所有的序列数.
Simpson-the Simpson index:
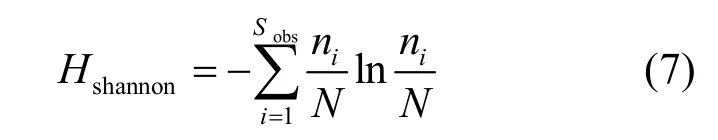
式中:Sobs为实际测量出的OTU数目; ni为含有i条序列的OTU数目;N为所有的序列数.
1.6.4 群落结构分析 对OTU列表中获得的分类信息与丰度进行整理,在纲和属分类水平下对各样品进行物种丰度统计、聚类分析及RDA分析,可得到样品中群落组成结构、相似性以及群落结构与环境因子的关系.其中RDA(基于线性模型)分析图是一种基于对应发展的排序方法,将对应分析与多元回归分析相结合,每一步计算均与环境因子进行回归,又称多元直接梯度分析,可以反映群落组成与环境因子之间的关系.
2 结果与讨论
2.1 土壤理化性质
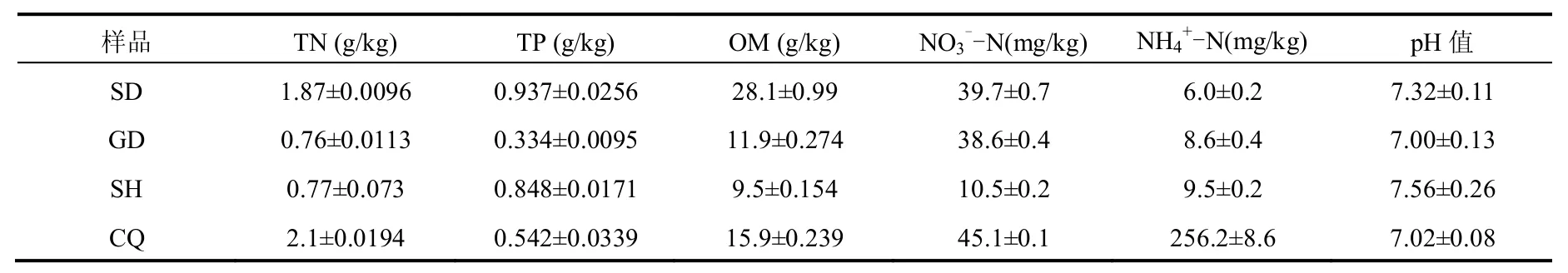
表1 土样理化性质Table 1 Soil physical and chemical properties used for this study
土样SD、GD、SH和CQ理化性质分析,如表1所示.TN含量范围在0.7487~2.119g/kg之间,小于中国东北农田黑土TN含量范围(0.99~4.25g/kg)[10];TP含量范围在0.3245~0.9626g/kg之间;有机质(OM)含量范围在9.346~29.09g/kg之间;硝态氮(N-N)含量和铵态氮(N-N)含量范围分别在10.03~45.2mg/kg和5.8~264.8mg/kg之间,显著高于甘肃某地区森林土壤N-N含量和N-N含量,分别在0.62~5.89mg/kg和5.71~7.80mg/kg之间[15];pH值变化范围在6.87~7.82之间,且波动较小,高于桑椹根际土壤及黑土pH值范围(5.00~6.60)[10,16],说明覆盖土微生物适于中性偏碱性环境.SD土样中TN、TP、OM和N-N含量显著高于其他土样,而N-N含量明显低于其他土样.CQ土样中TN、N-N和N-N含量显著高于其他土样,分别为2.1g/kg,45.1mg/kg,256.2mg/kg,是SH土样的2.73倍、4.29倍、26.97倍.重庆(CQ)长生桥垃圾填埋场占用农田较多,且覆盖土取自填埋场附近土壤,这可能是其TN、N-N和N-N含量较高的原因之一.而SH土样中TN和TP含量分别为0.77g/kg和0.848g/kg,均低于我国标准TN和TP含量的一般水平(1g/kg),与先前关于上海垃圾填埋场覆盖土理化性质的研究结果一致[17].此外,从表中还可发现,土样中N-N含量普遍高于N-N的含量,从前3个土样的N--N和N-N含量可看出随着N-N的增加两种理化性质含量差值减少.这可能是土壤中N-N较高,从而促进了硝化过程,被硝化细菌吸收转化为NN而积累下来[18].
2.2 Alpha多样性分析结果
利用MiSeq平台对SD、GD、SH和CQ 4种样品通过边测序边合成的方法进行高通量测序,其测序结果如表2所示.4种样品分别获得有效序列数为12956、15786、8618、21856,样品的平均覆盖率为98.92%,且稀释曲线趋于平台期,表明该测序效果理想.土壤中微生物种类丰富,4种样品物种丰富度顺序为GD>SH>SD>CQ,表明GD土样需更多序列来评估它的物种丰富度.CQ土样测序序列数量明显多于其他土样,但其OTU丰度显著低于其他样品,这可能是由于重庆长生桥垃圾填埋场覆盖土多为周边黏土[19],土壤中微生物种类较少.
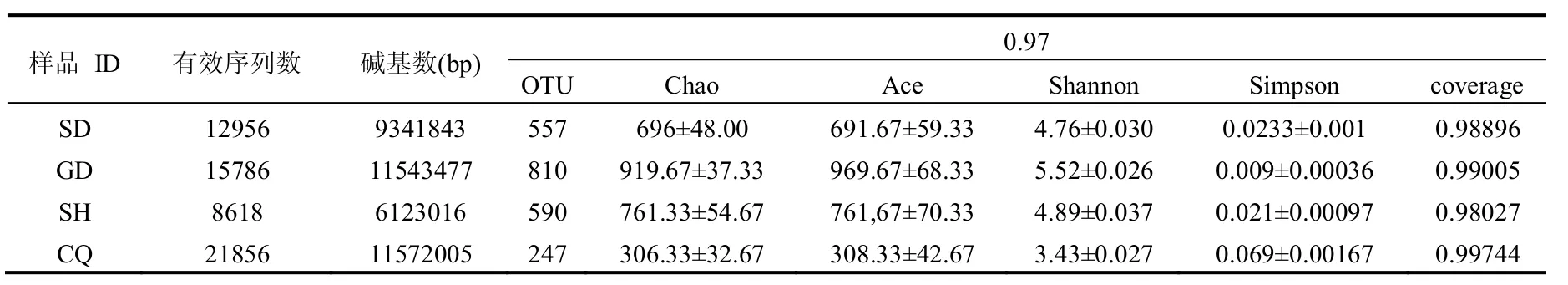
表2 序列统计及多样性指数Table 2 Sequence statistics and diversity index
2.3 群落结构组成分析
总土样中共检测到80多种纲分类水平上的微生物,如图2a所示.在所考察的4种土样中,Alphaproteobacteria(α-变形杆菌纲)和Betaproteobacteria(β-变形杆菌纲)均为优势菌,所占比例范为分别为12.67%~25.54%,14.35%~18.88%,同时也是黑土中的优势菌群,约占20%[10]. Alphaproteobacteria和Betaproteobacteria是土壤中重要的2-甲基-4-氯苯氧乙酸(MCPA)降解菌群[20],且参与了农业土壤中2,4-二氯苯酚的转化[21].据此,4个城市的填埋垃圾中可能含有大量的农药和医药物质(含有大量MCPA),从而使2种微生物菌群丰度较高.而Gammaproteobacteria(γ-变形菌杆纲)为SD和SH土样的优势菌,所占比例分别为18.25%,11.91%,可能是因为SD和SH填埋垃圾中含有较多的油脂物质[22].此外,图2a中Actinobacteria(放线菌纲)为GD和SH土样的优势菌,所占比例约为16%;Sphingobacteria(鞘脂杆菌纲)为CQ土样的优势菌,所占比例约为19.02%.在根际土壤中,Actinobacteria所占比例范围在15%~27%之间,而Sphingobacteria只约占2%[23].
属分类水平上共检测到460多种微生物,如图2b所示.Sphingomonas(鞘氨醇单包菌属)为SD、GD和SH 3种土样的优势菌,分别占7.25%、10.67%、11.30%.它是清理土壤中有毒物质最有效的微生物群类之一,能够降解芳香化合物(如萘、联苯、甲苯、二甲苯、甲酚、氧芴等)和聚乙烯醇等[24],且芳香族化合物是土壤气体中主要的挥发性有机物,占71.5%[25].有许多研究者从土壤中分离出不同种类的Sphingomonas.Srinivasan等[26]于2011年从位于韩国科技技术学院的池塘附近土壤中分离出了Sphingomonas属的两株菌PB196T和PB62T,但在垃圾填埋场覆盖土中分离得到Sphingomonas尚未见报道.
由于城市生活垃圾分类不均等原因,填埋场中垃圾组成十分复杂,主要含有装饰品、食物残渣、塑料、纺织品、玻璃等,其中纤维素物质占总垃圾量的40%~70%[27].在填埋过程中,生活垃圾会放出大量恶臭物质,严重污染周边环境.其中H2S最普遍,且最典型,占微量填埋气污染物的90%以上[28-29].有研究表明硫氧化细菌(SOB)如Thiobacillus(硫杆菌属)、Halothiobacillus(盐硫杆菌属)和Bradyrhizobium(慢生根瘤菌属)为中国亚热带地区垃圾填埋覆盖土中的优势菌群,且土壤中的有机含量对这些微生物活性具有较大影响[30].从图2b中也可发现,SD土样中含有11.38%的Thiobacillus,为主要优势菌,且在表3中,OM与Alphaproteobacteria (r=-1.00, P<0.001)具有明显的负相关性,与Betaproteobacteria (r=0.8,P=0.2)具有显著的相关性,这可能是因为山东莱芜城市供热和天然气的逐渐推广和使用,生活垃圾组成成分中的有机物含量增多,致使生物气中含有大量的硫化物.从图2b中还可知, Oxalobacter (草酸杆菌属)和Sandaracinus(橙色菌属)为CQ土样的优势菌,分别占12.77%、18.11%,但相关的文献报道还较少.从属分类水平上的微生物群落组成图可知,甲烷氧化菌并不是4种覆盖土样的优势菌,这与Alphaproteobacteria中的甲烷氧化菌为主要优势菌的结论具有差异[31].
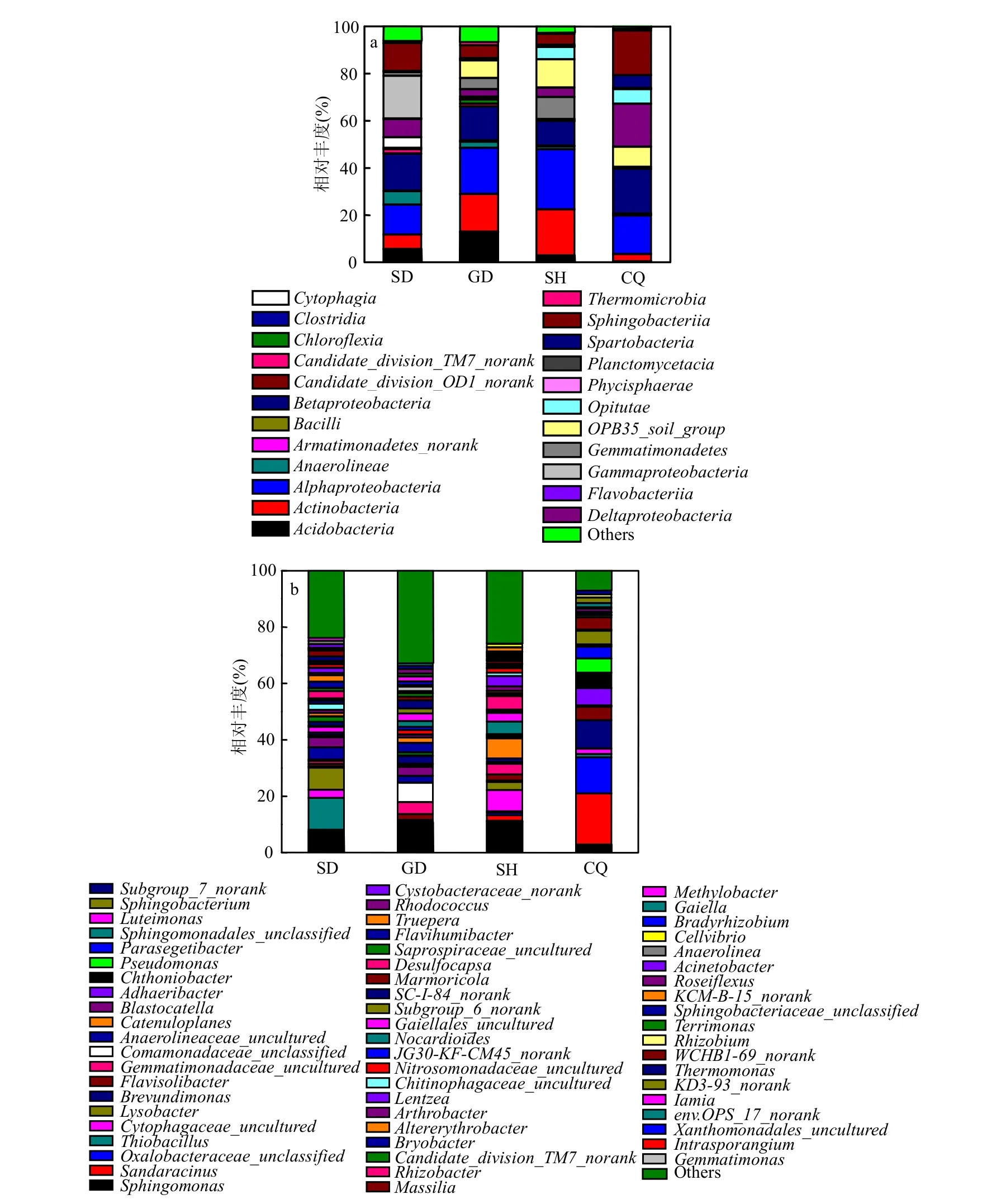
图2 纲和属分类水平下的微生物群落组成Fig.2 Composition of bacterial community at class and genera levels
2.4 环境因素对微生物群落的影响
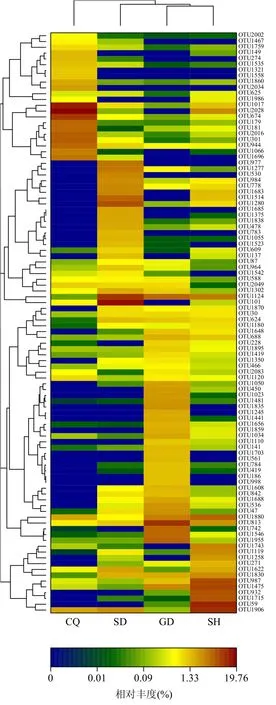
图3 OTU分类水平下的heatmapFig.3 Rainbow color percentage heatmap for OTU level
2.4.1 群落组成的相似性分析 样品中前100个OTU丰度比例,如图3所示.从图3可看出,不同地区OTU相对丰度明显不同,其中OTU1017和OTU2028在CQ土样中相对丰度明显高于其他土样,分别为13.52%、19.76%;OTU1124和OTU101在SD土样中相对丰度高于其他土样,分别为9.11%、15.69%;OTU813在GD土样中相对丰度最高,为9.57%;OTU59和OTU1906在SH土样中相对丰度高于其他土样,分别为11.62%、10.11%.从图中样品间聚类关系树可知GD和SH土样间序列的进化关系相近,而CQ土样与其他土样间的序列进化关系较远.这可能是由于两地区的TN含量相似,有研究表明垃圾填埋土中TN与土壤中微生物酶的活性具有明显的相关性,而酶的活性与微生物数量具有显著的相关性(r=0.98302,P<0.001)[1].
2.4.2 环境因子与优势菌群的相关性分析 土壤中的各种物质会抑制或促进相应微生物的生长,使优势菌群发生相应变化.Im等[31]研究表明N含量的增加会减少甲烷氧化菌群的多样性,特别是I型甲烷氧化菌,而NH4Cl和KNO3的加入会显著增加甲烷氧化菌群丰度.此外,土壤中有机磷和无机磷的加入也能增加微生物的活性[32].相关性分析能够初步的反应理化性质等环境因素对菌群丰度的影响,如表3所示.从表中发现TN和TP含量与3种优势菌群的相对丰度具有密切关系,Deltaproteobacteria和Gammaproteobacteria相对丰度分别与TN(r=1.00,P<0.001)和TP(r= 1.00, P<0.001)具有明显的正相关性,而Gemmatimonadetes相对丰度与TN(r=-1.00,P<0.001)具有明显的负相关性,但其相对丰度与TP(r=-0.40,P=0.6)关联.同样地,土样中OM、N-N、N-N含量与一些优势菌群的相对丰度也有密切关系.Actinobacteria、Alphaproteobacteria、Anaerolineae相对丰度分别与N-N(r=1.00,P<0.001)、OM(r=1.00,P<0.001)和N-N(r=1.00,P<0.001)含量呈正相关.对于N-N,相关研究表明N-N含量对Betaproteobacteria中的Burkholderia(伯克氏菌属)、Azospiril(固氮螺菌属)等固氮微生物有显著的影响[33],表3中也发现Betaproteobacteria相对丰度与N-N(r=1.00,P<0.001)密切正相关,且Sphingobacteria(鞘氨醇杆菌纲)相对丰度与N-N(r=1.00,P<0.001)也具有密切的正相关性.而主要的-N汇为自养硝化细菌[34],Nitrosomonas(亚硝化单胞菌属)、Nitrosospira(亚硝化螺菌属)等属于Betaproteobacteria的硝化细菌与N-N具有一定的相关性,而在本研究中发现Betaproteobacteria(r=0.20,P=0.80)与N-N无明显相关性.
表3 细菌种群与理化性质全氮(TN)、全磷(TP)、有机质(MO)、铵态氮(N-N)和硝态氮(N-N)含量的相关性分析Table 3 The correlation (r) and significance (P) values of linear regressions between relative abundances of bacterial groups and soil total nitrogen (TN), total phosphorus (TP), organic matter (OM), ammonium nitrogen (N-N) and nitrate nitrogen (N-N)
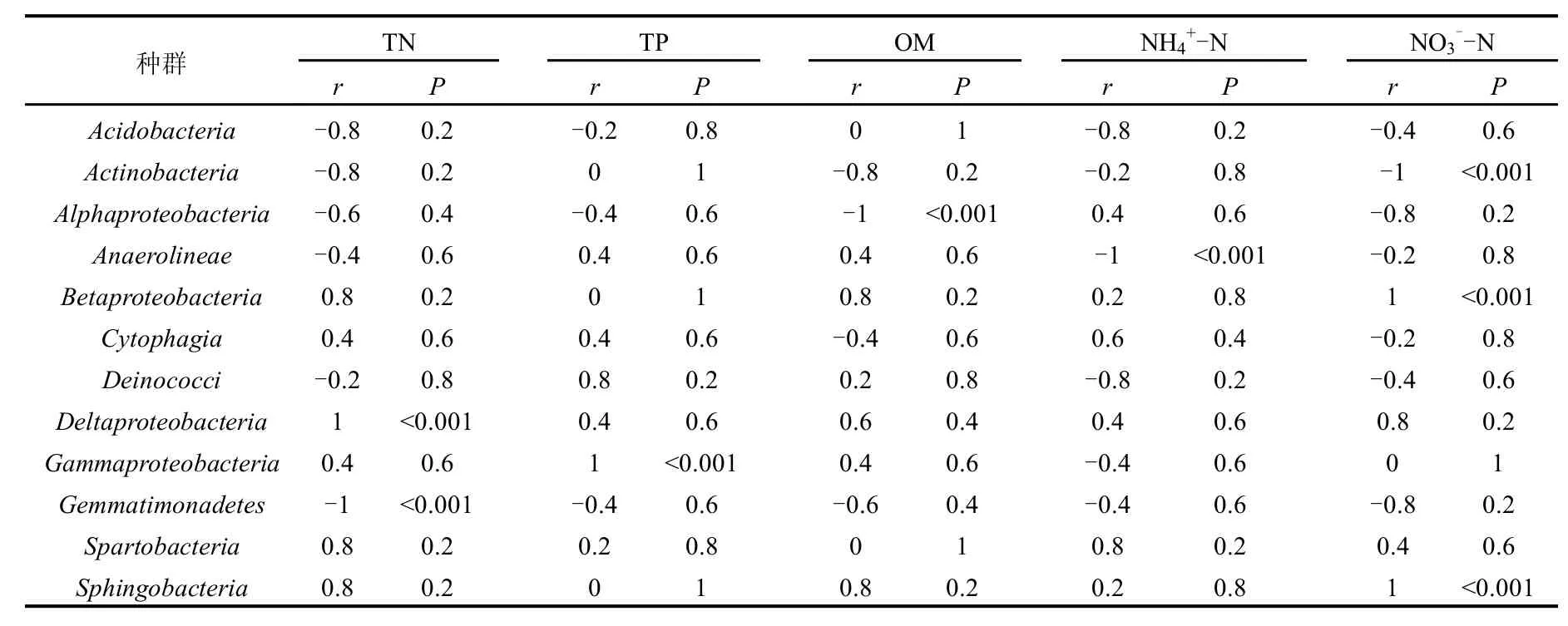
表3 细菌种群与理化性质全氮(TN)、全磷(TP)、有机质(MO)、铵态氮(N-N)和硝态氮(N-N)含量的相关性分析Table 3 The correlation (r) and significance (P) values of linear regressions between relative abundances of bacterial groups and soil total nitrogen (TN), total phosphorus (TP), organic matter (OM), ammonium nitrogen (N-N) and nitrate nitrogen (N-N)
种群 TN TP OM NH4+-N NO3--N r P r P r P r P r P Acidobacteria -0.8 0.2-0.2 0.80 1-0.8 0.2-0.4 0.6 Actinobacteria -0.8 0.2 0 1 -0.8 0.2 -0.2 0.8 -1 <0.001 Alphaproteobacteria -0.6 0.4 -0.4 0.6 -1 <0.001 0.4 0.6 -0.8 0.2 Anaerolineae -0.4 0.6 0.4 0.6 0.4 0.6 -1 <0.001 -0.2 0.8 Betaproteobacteria 0.8 0.2 0 1 0.8 0.2 0.2 0.8 1 <0.001 Cytophagia 0.4 0.6 0.4 0.6 -0.4 0.6 0.6 0.4 -0.2 0.8 Deinococci -0.2 0.8 0.8 0.2 0.2 0.8 -0.8 0.2 -0.4 0.6 Deltaproteobacteria 1 <0.001 0.4 0.6 0.6 0.4 0.4 0.6 0.8 0.2 Gammaproteobacteria 0.4 0.6 1 <0.001 0.4 0.6 -0.4 0.6 0 1 Gemmatimonadetes -1 <0.001 -0.4 0.6 -0.6 0.4 -0.4 0.6 -0.8 0.2 Spartobacteria 0.8 0.2 0.2 0.8 0 1 0.8 0.2 0.4 0.6 Sphingobacteria 0.8 0.2 0 1 0.8 0.2 0.2 0.8 1 <0.001
2.4.3 环境因子与样品之间的相关性分析 4种样品因环境因素的不同而聚类或分离的情况,如图4所示.从图4中可看出,SD和CQ与SH、GD土样的微生物组成差异较大,土样都分散于第一、二、四象限内.这可能是因为CQ土样N-N含量显著的高于其他土样,且N-N含量显著高于SH和GD土样.而对于SD样,TN、TP和OM含量是造成该土样与其他土样分离的主要因素,其TN、TP和OM含量明显高于其他土样.Xiong等[35]研究表明土壤参数(TN、TC和水分)对土壤细菌群落组成的变化为37.52%. SH、GD土样的微生物组成比较相似,主要聚集在第一象限中,主要原因可能是SH、GD土样TN、TP、OM和N-N的含量适中,N-N含量明显少于其他2种土样.不同理化性质对不同覆盖土微生物群落组成的影响不同.有研究表明环境的异质性和扩散限制是决定微生物地理分布格局的两个主要的因素[36],上述结果突出了覆盖土中的环境异质性对微生物地理分布的影响.
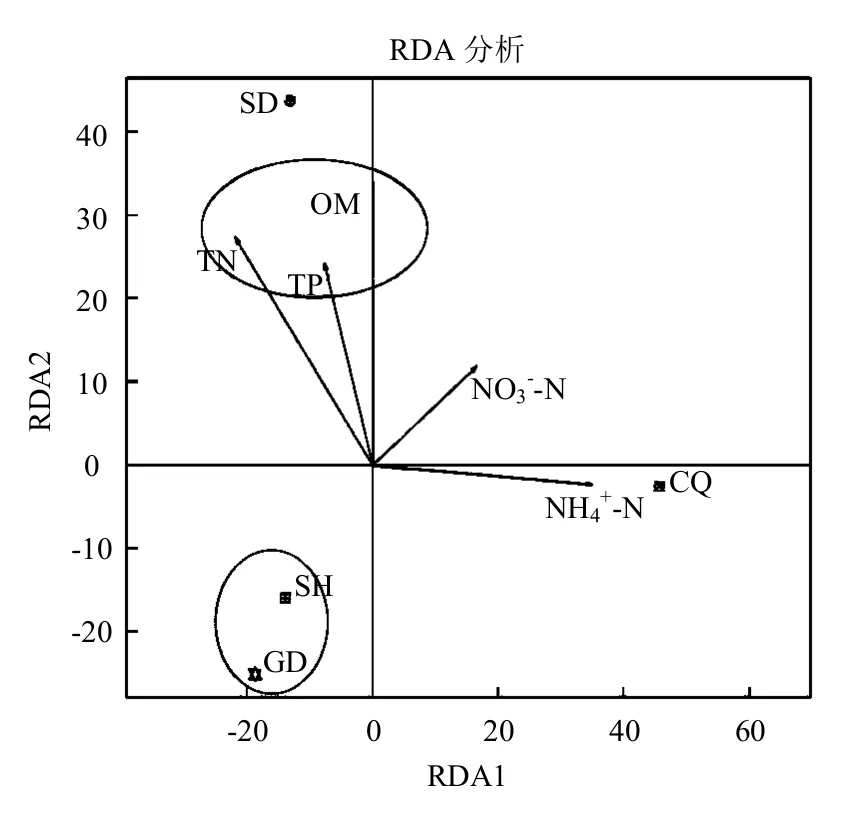
图4 基于土样和环境因子的冗余分析Fig.4 Redundancy analysis(RDA)based on binary data and environmental factors of the soil samples
3 结论
3.1 利用高通量测序技术分析样品,平均覆盖率为98.92%,测序结果能够全面的反映样品组成及结构. 多样性指数可得4种样品的物种丰富度顺序为GD>SH>SD>CQ.
3.2 垃圾填埋场覆盖土中优势菌纲为Alphaproteobacteria(α-变形杆菌纲)和Betaproteobacteria(β-变形杆菌纲),所占比例范围分别为12.67%~25.54%,14.35%~18.88%. Sphingomonas(鞘氨醇单包菌属)为SD、GD和SH 3个城市覆盖土中的优势菌属,分别占7.25%、10.67%、11.30%.
3.3 覆盖土中Deltaproteobacteria(德耳塔变形杆菌纲)和Gammaproteobacteria(γ-变形菌杆纲)相对丰度分别与TN(r=1.00,P<0.001)和TP(r= 1.00, P<0.001)呈正相关关系,且TN、TP和OM含量可能为SD土样区别于其他土样群落组成的主要因素.
李 俊,舒为群,陈济安,等.垃圾填埋场土壤酶活性与化学性质和微生物数量的关系研究 [J]. 生态学杂志, 2005,24(9): 1043-1047.
Lakhouit A, Schirmer W N, Johnson T R, et al. Evaluation of the efficiency of an experimental biocover to reduce BTEX emissions from landfill biogas [J]. Chemosphere, 2014,97:98-101.
张云茹,邢志林,赵天涛,等.可降解TCE的甲烷氧化菌16S rDNA与pmoCAB基因簇序列分析 [J]. 生物工程学报, 2014,30(12):1-12.
韩 睿,陈来生,李 莉,等.PCR-DGGE研究青海农村户用沼气池微生物群落结构 [J]. 中国环境科学, 2015,35(6):1794-1804.
薛圆圆,孙宝盛,杜 江,等.贫营养条件下IAMBR污泥微生物群落结构的演变 [J]. 中国环境科学, 2015,35(3):839-845.
Kim T G, Moon K E, Yun J, et al. Comparison of RNA- and DNA-based bacterial communities in a lab-scale methane degrading biocover [J]. Applied Microbiology and Biotechnology,2013,97(7):3171-3181.
Su Y, Xia F F, Tian B H, et al. Microbial community and function of enrichment cultures with methane and toluene [J]. Applied Microbiology and Biotechnology, 2014,98(7):3121-3131.
Zhao T T, Zhang L J, Zhang Y R, et al. Characterization of methylocystis strain JTA1isolated from aged refuse and its tolerance to chloroform [J]. Journal of Environmental Sciences, 2013,25(4):770-775.
Zhang X, Xia F F, Su Y, et al. Effects of ammonium on the activity and community of methanotrophs in landfill biocover soils [J]. Systematic and Applied Microbiology, 2014,37:296- 304.
Liu J J, Sui Y Y, Yu Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China [J]. Soil Biology and Biochemistry,2014,70:113-122.
郑宪忠,卢 华,魏春玲.生活垃圾填埋场渗沥液收集系统的设计思路探讨-以莱芜市铜山生活垃圾卫生填埋场为例 [J]. 中国建设信息, 2010,(2):68-69.
胡志毅.深圳下坪垃圾填埋场滑坡成因分析及综合治理 [J]. 有色冶金设计与研究, 2002,23(4):68-74.
Ding Z H, Tang Q H, Liu C E, et al. Distribution and ecological effect of mercury in Laogang landfill, Shanghai, China [J]. Journal of Environmental Suences, 2007,19:200-204.
王渝昆,刘胜初.重庆长生桥垃圾卫生填埋场雨污分流系统工程研究[J]. 环境卫生工程, 2008,16(3):53-58.
张彩霞.新一代高通量测序技术研究土壤微生物群落结构对环境条件的响应 [D]. 南京:南京农业大学, 2012.
Yu C, Hu X M, Deng W, et al. Changes in soil microbial community structure and functional diversity in the rhizosphere surrounding mulberry subjected to long-term fertilization [J]. Applied Soil Ecology, 2015,86:30-40.
梁 晶,王肖刚,张庆费,等.上海市垃圾填埋场土壤特性研究 [J]. 南京林业大学学报, 2013,37(1):147-152.
郑林雪,李 军,胡家玮,等.同步硝化反硝化系统中反硝化细菌多样性研究 [J]. 中国环境科学, 2015,35(1):116-121.
杨运华,郭绪元.重庆主城区生活垃圾处理及长生桥卫生填埋场设计小结 [J]. 有色金属, 2003,55:99-103.
Liu Y J, Liu H J, Drake Arold L. Alphaproteobacteria dominate active 2-methyl-4-chlorophenoxyacetic acid herbicide degraders in agricultural soil and drilosphere [J]. Environmental Microbiology,2011,13(4):991-1009.
Anja D,Marcus A.Agricultural soil and drilosphere as reservoirs of new and unusual assimilators of 2,4-dichlorophenol carbon [J]. Environmental Microbiology, 2014,16(1):84-100.
韩亚飞,伊文慧,王文波,等.基于高通量测序技术的连作杨树人工林土壤细菌多样性研究 [J]. 山东大学学报, 2014,49(5):1-6.
Gao Y C,Wang J N,Guo S H,et al.Effects of salinization and crude oil contamination on soil bacterial community structure in the Yellow River Delta region, China [J]. Applied Soil Ecology,2015,86:165-173.
胡 杰,何晓红,李大平,等.鞘氨醇单胞菌研究进展 [J]. 应用与环境生物学报, 2007,13(3):431-437.
Tassi F, Montegross G, Vaselli O, et al. Degradation of C2-C15volatile organic compounds in a landfill cover soil [J]. Science of TheTotal Environment, 2009,407(15):4513-4525.
Srinivasan S, Lee J J, Kim M K. Sphingomonas rosea sp. nov. and Sphingomonas swuensis sp. nov., rosy colored betaglucosidase-producing bacteria isolated from soil [J]. The Journal of Microbiology, 2011,49(4):610-616.
Borjesson G, Sarnuelsson J, Chanton J. Methane oxidation in Swedish landfills quantified with the stable carbon isotope technique in combination with an optical method for emitted methane [J]. Environmental Scienee and Teehnology, 2007,41(19):6684-6690.
Kim K H, Choi Y J, Jeon E C, et al. Characterization of malodorous sulfur compounds in landfill gas [J]. Atmospheric Environment,2005,39:1103-1112.
Sorokin D Y, Tourova T P, Panteleeva A N, et al. Desulfonatronobacter acidivorans gen. nov., sp. nov. and Desulfobulbus alkaliphilus sp. nov., haloalkaliphilic heterotrophic sulfate-reducing bacteria from soda lakes [J]. International Journal of Systematic and Evolutionary Microbiology, 2012,62(9): 2107-2113.
Xia F F, Su Y, Wei X M, et al. Diversity and activity of sulphur-oxidizing bacteria and sulphate-reducing bacteria in landfill cover soils [J]. Letters in Applied Microbiology, 2014,59(1):26-34.
Im J, Lee S W, Bodrossy L, et al. Field application of nitrogen and phenylacetylene to mitigate greenhouse gas emissions from landfill cover soils: effects on microbial community structure [J]. Applied Microbiology and Biotechnology, 2010,89(1):189-200.
Koutika L S, Crews T E, Ayaga G, et al. Microbial biomass P dynamics and sequential P fractionation in high and low P fixing Kenyan soils [J]. European Journal of Soil Biology,2013,59:54-59.
李玉洁,李 刚,王丽娟.呼伦贝尔沙地不同植被恢复模式对土壤固氮微生物多样性的影响 [J]. 应用生态学报, 2013,24(6): 1639-1646.
Boyle S A, Yarwood R R, Bottomley P J, et al. Bacterial and fungal contributions to soil nitrogen cycling under Douglas fir and red alder at two sites in Oregon [J]. Soil Biology and Biochemistry,2008,40(2):443-451.
Xiong J B, Liu Y Q, Lin X G, et al. Geographic distance and pH drive bacterial distribution in alkaline lake sediments across Tibetan Plateau [J]. Environmental Microbiology, 2012,14:2457- 2466.
Lozupone C, Knight R. UniFrac: a new phylogenetic method for comparing microbial communities [J]. Applied and Environmental Microbiology, 2005,71:8228-8235.
Analysis of bacterial community composition in landfill cover soil.
HE Zhi1, ZHAO Tian-tao1,2*, XING Zhi-lin1,2,YUAN Jiang-hua1(1.School of Chemical Engineering, Chongqing University of Technology, Chongqing 400054, China;2.School of City Construction and Environment Engineering, Chongqing University, Chongqing 400030, China). China Environmental Science, 2015,35(12):3744~3753
In this study, the bacterial community composition in 4geographically different location (Shandong Laiwu, SD; Guangdong Shenzhen, GD; Shanghai Laogang, SH; Chongqing Changshengqiao, CQ) was investigated by Illumina MiSeq sequencing targeting V3~V4region of 16S rDNA gene and the link between the bacterial community composition and environmental parameters was analyzed. Results showed that representatives of Alphaproteobacteria and Betaproteobacteria dominated at all 4cover soils, ranging from 12.67%~25.54% and 14.35%~18.88% of the total abundance, respectively. Cover soil of GD had higher bacterial diversity than the others, which suggested by Shannon index (5.52±0.026 Vs 4.76±0.030 of SD, 4.89±0.037 of SH, and 3.43±0.027 of CQ). Genus Sphingomonas dominated at cover soils of SD、GD and SH, accounting for 7.25%、10.67%、11.30% of the total abundance, respectively. Person correlation suggested that groups of Deltaproteobacteria and Gammaproteobacteria highly correlated to total nitrogen(TN) (r=1.00, P<0.001) and total phosphorus (TP) (r=1.00, P<0.001). Redundancy analysis (RDA) further indicated that TN、TP and organic matter (OM) are the important factors in shaping the bacterial community structure.
Illumina MiSeq sequencing;landfill cover soil;bacterial diversity;bacterial community structure; environmental factors
X505
A
1000-6923(2015)12-3744-10
何 芝(1991-),女,重庆大足人,硕士,主要从事环境微生物多样性分析及污染控制研究.
2015-04-16
国家自然科学基金项目(51378522,41502328);重庆市基础与前沿研究项目(cstc2014jcyjA20007)
* 责任作者, 教授, zhaott@cqut.edu.cn
