辽东湾浮游生物粒径结构稳定性分析
2015-11-19宋广军王年斌辽宁省海洋水产科学研究院辽宁大连116023辽宁省海洋环境监测总站辽宁大连116023
宋 伦,宋广军,王年斌(1.辽宁省海洋水产科学研究院,辽宁 大连 116023;2.辽宁省海洋环境监测总站,辽宁 大连 116023)
辽东湾浮游生物粒径结构稳定性分析
宋 伦1,2*,宋广军1,2,王年斌1,2(1.辽宁省海洋水产科学研究院,辽宁 大连 116023;2.辽宁省海洋环境监测总站,辽宁 大连 116023)
基于2012~2014年春、夏、秋、冬季辽东湾网采浮游生物及环境因子的调查资料,采用显微测微计法结合粒径谱理论分析了辽东湾南、北2个区域的浮游生物粒径结构特征,并构建了浮游生物群落稳定性评估模型.结果表明,辽东湾海域浮游生物不同营养级间能量传递效率近似相等,但生态转化效率偏低; 2012~2014年辽东湾南部区域稳定性系数平均为0.53,北部区域平均为0.47,南部区域浮游生物群落整体上较北部稳定,夏季表现更为明显,说明南部区域受环境胁迫影响较小;海水营养状况分析表明,北部区域属于富营养化水平较高海域,营养指数(E)平均为1.69,南部区域基本属于低营养水平,营养指数(E)平均为0.42,富营养化会导致系统偏离稳定状态;本文构建的浮游生物群落稳定性评估模型可尝试比较不同海域浮游生物群落的健康状况.
浮游生物;粒径结构;粒径谱;ABC曲线;生态稳定性;辽东湾
海洋浮游生物群落作为海洋生态系统的重要组成部分之一,是能量流动和物质循环的最基础环节,而其稳定性与否与海洋生态灾变密切相关,但因其复杂的三维生态空间和系统内微小种群个体的存在, 长久以来一直是海洋生态学研究的瓶颈[1].粒径谱理论提出[2],为生态系统状态指示、生态群落胁迫效应评估、浮游生物群落稳定性研究提供了新思路.其标准生物量谱的斜率、回归相关系数、谱线剩余方差可用于表征生物群落的粒径结构,指示生态系统健康与稳定状况[3-4].自王荣等[5-6]首次把粒径谱概念引入国内以来,有关海洋浮游生物粒径谱的研究出现过一些综述性的文章报道[4,7-10].
近些年,关于浮游生物粒径结构的研究主要涉及粒级的划分及方法比较[11-12]、粒径谱构建及环境影响关系等[1,13-15].尽管国内浮游生物粒径谱的研究取得了一些初步成果,但揭示浮游生物群落稳定性机制研究方面还比较欠缺.
辽东湾为渤海半封闭式海湾,多年来超负荷承载陆源污染,近岸海域富营养化严重[16],浮游生物粒径结构变化复杂, 本研究选取辽东湾南、北2个区域,首次采用显微测微计法结合粒径谱理论构建了浮游生物群落稳定性评估模型,分析了浮游生物粒径结构特征,探讨了不同环境胁迫下浮游生物群落的稳定性状况,揭示了富营养化海域浮游生物粒径结构变化规律及响应机制,可为近岸海域浮游生物群落稳定性评价提供技术支持.
1 材料与方法
1.1 调查区域与样品采集
2012~2014年5月(春)、8月(夏)、10月(秋)、12月(冬,2012年未调查)分别在辽东湾海域进行了网采浮游动、植物及环境因子调查,于南(S区)、北(N区)2个区域分别设置10个调查站位,其中N区邻近河口,受近岸陆源环境影响较大,S区则相对影响较小(图1).
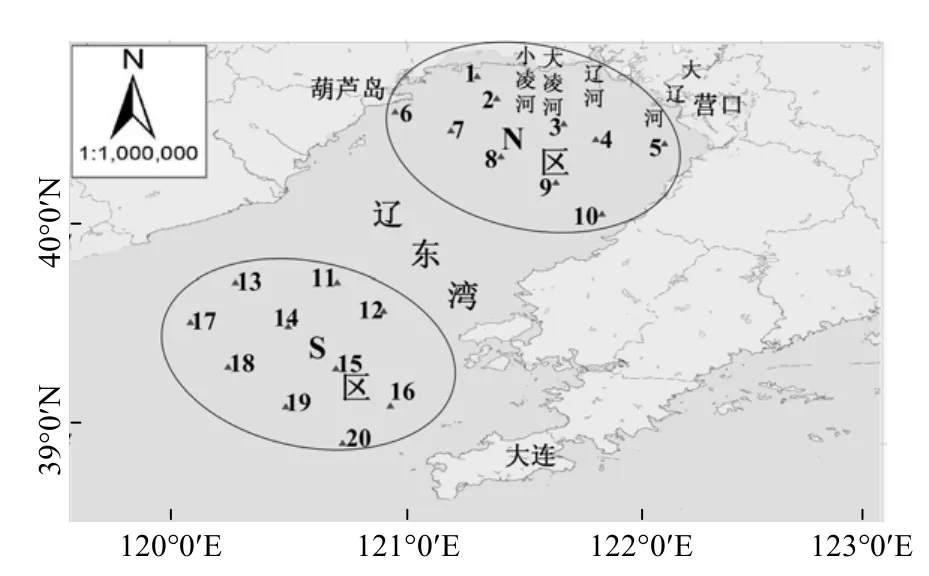
图1 辽东湾采样站位示意Fig.1 Sampling sites in Liaodong Bay
浮游生物调查采用《海洋调查规范》[17]推荐的方法,使用浅水Ⅰ、Ⅱ、Ⅲ型浮游生物网从底至表层垂直拖网,分别统计大(等效球径,ESD>500μm)、中型浮游动物(ESD<500μm)和浮游植物;同期进行海水的水温、盐度、叶绿素a(Chl a.)、无机氮(DIN)[铵盐、硝酸盐、亚硝酸盐、活性磷酸盐(DIP)、石油类(Oil)、pH值、溶解氧(DO)、化学耗氧量(COD)、重金属汞(Hg)、铅(Pb)、铜(Cu)、锌(Zn)、镉(Cd)、砷(As)等指标的监测.调查和监测分析方法均参照《海洋调查规范》(GB/T 12763-2007)和《海洋监测规范》(GB17378-2007)[18]执行.
1.2 样品分析与量值换算
实验室内分别对浮游动、植物样品进行镜检、计数、称量并记录其体长、宽和高.根据测定的形态参数、借助数学几何运算公式和体长-含碳量的经验公式分别对浮游生物个体体积和生物个体含碳量进行估算.浮游植物只统计长轴大于5μm的细胞个体,对于难以准确鉴定到种的个体,按未定种归类到属记录,根据测定的形态参数、借助数学几何运算公式和体长-含碳量的经验公式分别对浮游植物个体体积和个体含碳量进行估算[19-21].
桡足类和等足类体积根据椭球体积公式进行估算:

十足类、磷虾类、住囊类、毛颚类依近似圆台(或圆柱)体积计算:

式中:L、2a和2b分别为生物个体体长、最大体宽和最小体宽(体高).
双壳类、腹足类和介形类等由于其特殊的生物结构组成,体积计算采用公式:

式中:L和W分别为测量每个生物体的体长和最大体宽,C值为对应转化系数450.
个体含碳量主要是依据相同或相近的种类的体长-含碳量的关系式[22-25]进行直接估算,如桡足类、糠虾类、毛颚类、十足类等.其他种类则先根据其形态参数计算其近似体积或等效球径,再估算其个体含碳量.多毛类疣足幼体、担轮幼虫、辐轮幼虫等,参考含碳量与等效球径的转换式:
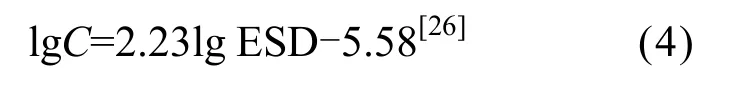
式中:C为含碳量μg;ESD为等效球径,μm.双壳类、腹足类、介形类等,按照体积(cm3)×1.13→湿重生物量(g)×0.25→干重(g)×0.9→含碳量(g)换算[27-28].
1.3 粒径谱构建与数据处理
标准化生物量谱(NBSS)以经Log2转换的个体含碳量[11-12]为横坐标划分粒级,以最小值为起点,每一粒级的上限对应的生物量是下限相应值的2倍,以Log2[总丰度/粒级差]为纵坐标构建,并对谱线进行相关性及回归分析.
采用相对重要性指数(IRI)确定群落中的优势种:

式中:W为某种类的生物量百分比;N为某种类的丰度百分比;F为调查某种类出现的频率[29].
采用Shannon-Wiener指数(H′)[15]统计物种多样性水平:
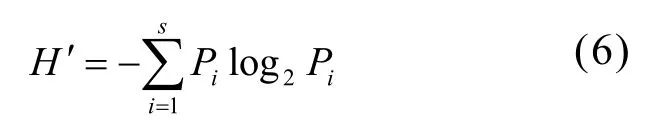
式中:Pi为第i种生物的丰度(或生物量)与样本总丰度(或生物量)的比值;S为种类数.
利用营养指数法(E)并结合CN/CP(无机氮/无机磷)对研究海域的营养状况进行分类[30-31]:

式中:E为富营养化判断值(E),COD、DIN、DIP分别为化学耗氧量(mg/L)、无机氮(mg/L)、无机磷(mg/L)的测定值.若E≥1,即为富营养化.
环境指数(测定值/标准值)中标准值参照《海水水质标准》(GB3097-1997)中的第二类海水水质标准计算.
通过ABC 曲线法(Abundance-Biomass Comparison curves)对群落的稳定性和胁迫变化状况进行分析,用W统计量(W-statistic)作为ABC曲线方法的一个统计量,其公式为:

式中:Bi和Ai为ABC曲线中种类序号对应的生物量和丰度的累积百分比,S为出现物种数.当生物量优势度曲线在丰度优势度曲线之上时,W为正,反之W为负[32].
对上述公式计算、数据分析、方差检验、曲线绘制均通过Microsoft Excel 2007和SPSS 19.0、PRIMER 5.0软件完成.
2 结果
2.1 浮游生物粒径及优势种组成
研究区(N、S)浮游植物ESD全年分布在3~245µm,个体体积范围129µm3~0.061mm3,个体生物量范围142pg~67µg,个体含碳量范围18pg~368ng;浮游动物ESD全年分布在88~2256µm,个体体积范围0.00288~48mm3,个体生物量范围3µg~50mg,个体含碳量范围282ng~387µg.
综合各调查年度、季节,研究区(N、S)ESD<20μm粒径组优势种主要由中肋骨条藻(Skeletonema costatum)、具槽帕拉藻(Paralia sulcata)、角毛藻(Chaetoceros sp.)组成,20μm<ESD<100μm粒径组优势种主要由桡足类无节幼体(Copepod nauplii)、格式圆筛藻(Coscinodiscus granii)组成,100μm<ESD<200μm粒径组优势种主要由星脐圆筛藻(Coscinodiscus asteromphalus)、洪氏纺锤水蚤(Acartia hongis)组成, 200μm<ESD<500μm粒径组优势种主要为夜光藻(Noctiluca scintillans),ESD>500μm粒径组优势种主要为强壮滨箭虫(Aidanosagitta crassa),N、S区优势种的种类差异不明显(表1).
2.2 粒径谱特征
研究区(N、S)浮游生物标准生物量谱见图2,线性回归的参数值见表2.
从总的浮游生物标准生物量谱线回归相关性来看,回归拟合系数(r2)N区全年分布在0.748~0.946,S区全年分布在0.820~0.927,N、S区所有调查时段均达到极显著水平(P<0.01),总体回归性较好.剩余方差(s2) N区全年分布在5.82~35.46,S区全年分布在6.65~27.46.
从标准生物量谱线斜率(k)看,N区春季变化范围为-1.652~-1.300、夏季为-1.844~-1.613、秋季为-1.674~-1.470、冬季为-1.529~-1.473,全年来看斜率变化范围为-1.844~-1.300;S区春季变化范围为-1.751~-1.377、夏季为-1.654~-1.430、秋季为-1.679~-1.511、冬季为-1.582~-1.576,全年来看斜率变化范围为-1.751~ -1.377.S区除夏季谱线斜率高于N区外,其他季节均低于N区.

表1 研究区浮游生物各粒径组第一优势种Table 1 Plankton size of the first dominant species of in the study area
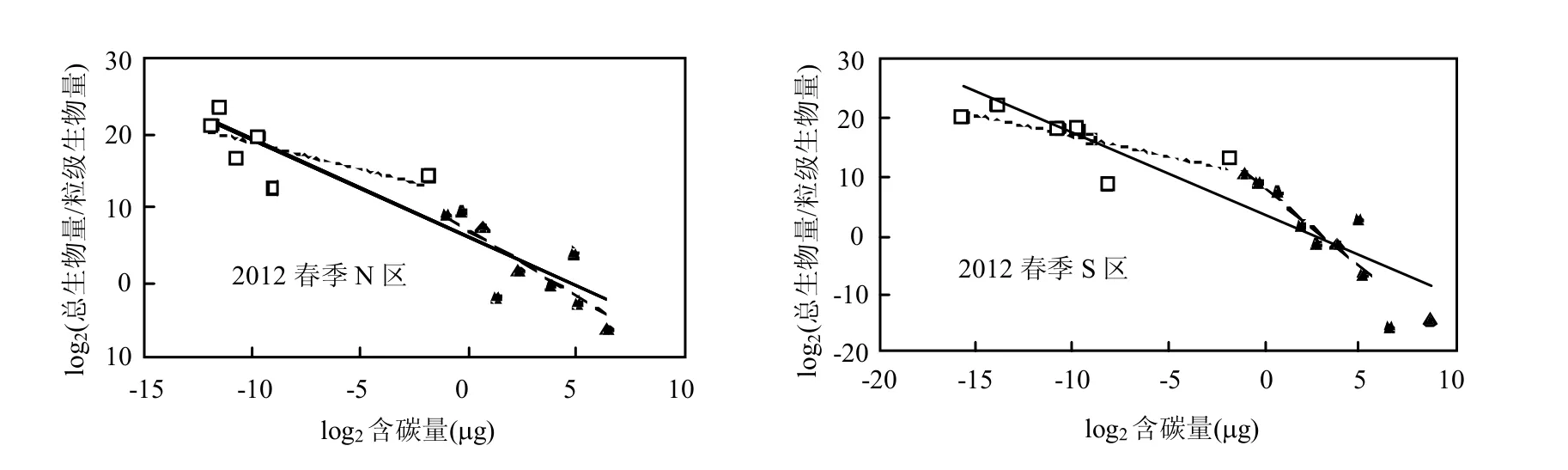
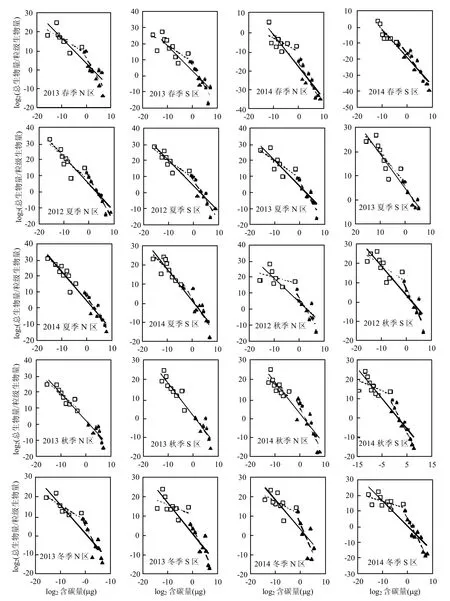
图2 研究区浮游生物标准生物量谱季节变化Fig.2 Seasonal variation in normalized biomass size spectra of plankton in the study area
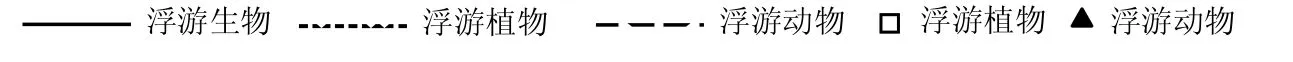

表2 标准生物量谱参数及ABC曲线W统计值Table 2 Descriptive statistics of the normalized biomass spectra and W-statistics of the ABC curves
从浮游生物的W统计值来看,除2013年春、冬季S区较N区W统计值低外,其余调查时段S区均高于N区.除N区2012~2014年夏季和2013年秋季外(W统计值为负),N、S区其余时段累积生物量均处于优势地位.
2.3 群落稳定性状况
为评估N、S区浮游生物群落稳定性状况,参考相关文献[33]基础上,优化筛选了用于表征浮游生物群落偏离稳定状态程度的4个参数,构建了浮游生物群落稳定性评估模型(表3).其中K-χ2为标准化生物量谱线性回归斜率(k)与理论斜率比较的χ2值,并进行N、S区归一化比较负相关处理;r2为标准化生物量谱的回归直线相关系数,并进行N、S区归一化比较正相关处理;s2为围绕谱线的剩余方差,并进行N、S区归一化比较负相关处理;W为ABC曲线的统计值,并对其进行N、S区归一化比较正相关处理(两区出现单一负值计为0,另一正值计为1).稳定性系数(SF)为各参数的平均值.
测算结果为, 2012~2014年S区SF平均值为0.53,N区SF平均值为0.47,除2012年春季和2013年春、冬季测算的SF值S区低于N区外,其余调查时段S区均高于N区.而且围绕标准生物量谱回归谱线的K-χ2、r2、s23个值测算结果与ABC曲线的W统计值测算结果基本一致.说明S区浮游生物群落结构整体上较N区稳定,受环境影响胁迫较小.从N、S区SF值差异来看,夏季S区较N区浮游生物群落更加稳定.
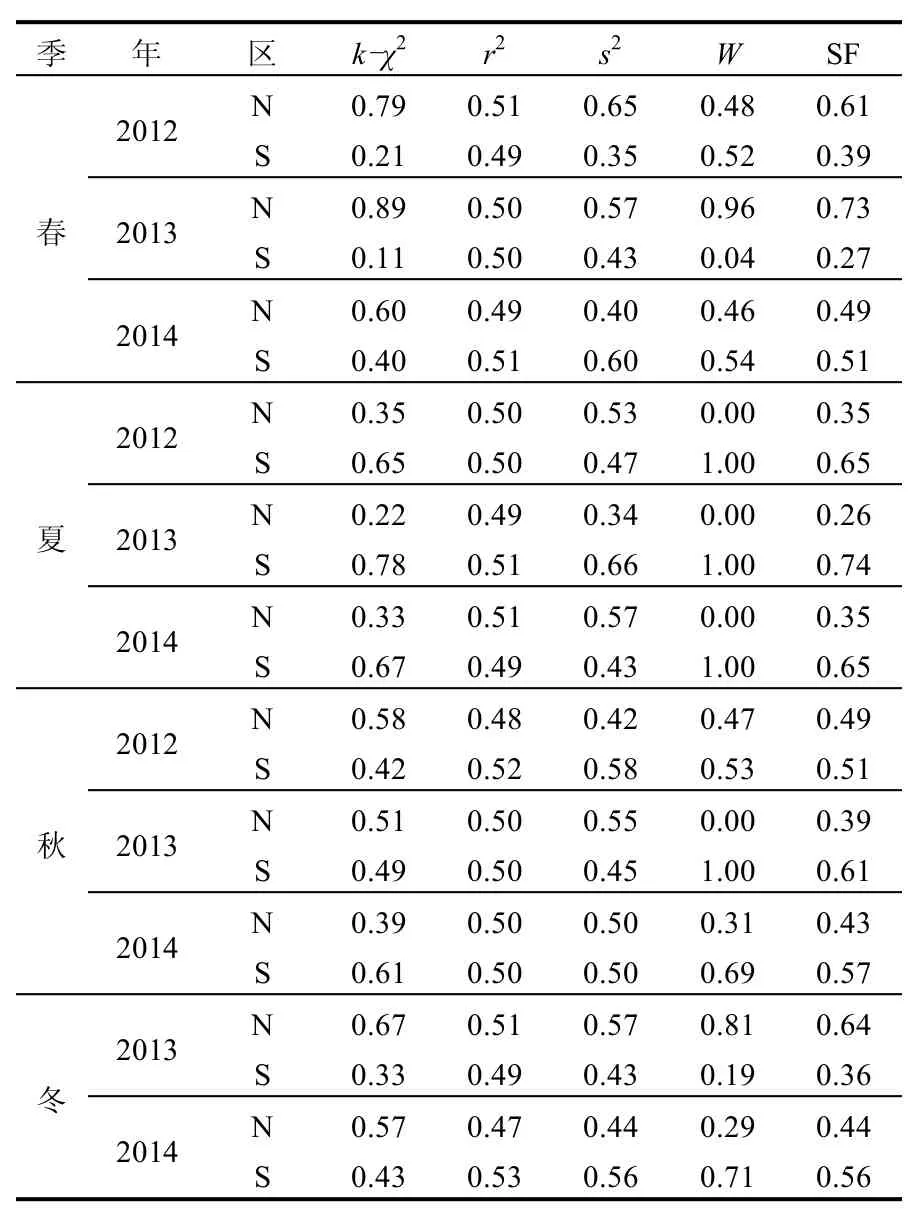
表3 浮游生态系统稳定性评估模型Table 3 Stability assessment model of marine plankton communities
2.4 研究区水质环境差异
调查期间N区水温(5.19±0.39)~(25.76±0.21) ℃,盐度(24.87±1.01)~(27.87±0.41);S区水温(9.99± 0.20)~(25.01±0.35)℃、盐度(28.93±0.31)~ (30.88± 0.15) (图3).N区DIN在春、秋、冬季全部超过第二类海水水质标准,S区水质均在第一类海水水质标准范围内(图4).
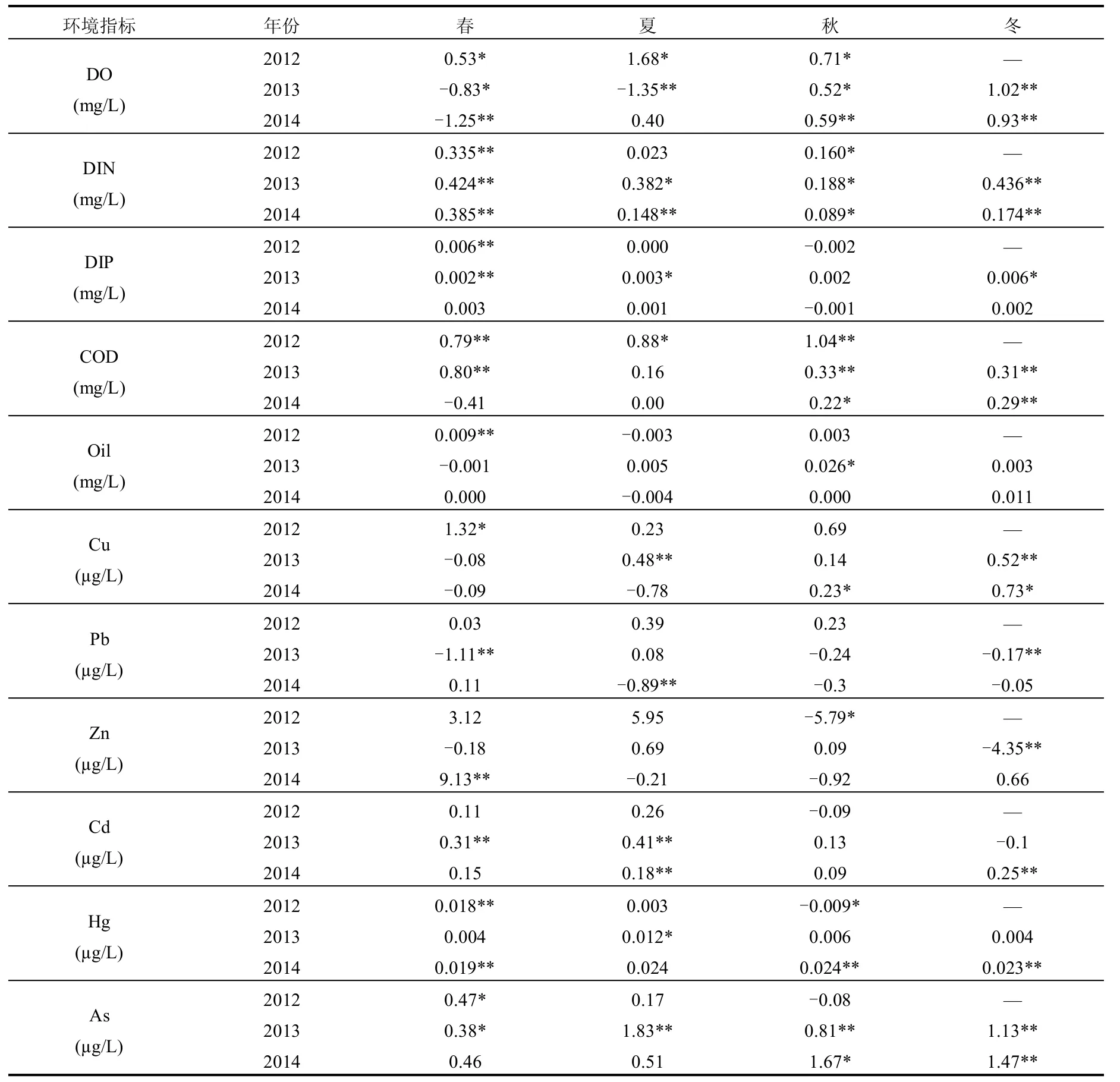
t检验(成对双样本均值分析)结果表明,N、S区部分水环境指标在调查期间差异较为显著(表4),综合考虑差值和相关系数的大小,DIN、COD、Cd、Hg、As含量N区较S区高,而S区盐度全年高于N区,水温冬季也高于N区.
海水营养状况分析表明,N区属于富营养化水平较高海域,营养指数(E)平均为1.69,S区基本属于低营养水平,营养指数(E)平均为0.42(表5).这也符合本海域的自然属性,N区北侧邻近辽河、大辽河及大、小凌河,陆域氮源输入丰富.

图3 研究区温、盐季节变化Fig.3 Seasonal changes in temperature and salinity in the study area
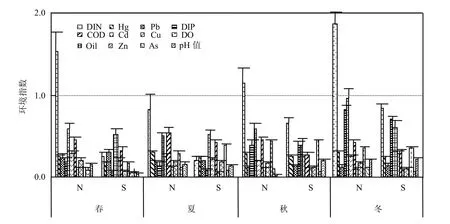
图4 研究区环境因子季节变化Fig.4 Seasonal changes in environmental factors in the study area

表4 研究区环境因子差值(N-S)Table 4 Differences in environmental factors between northern and southern areas of Liaodong Bay
续表4
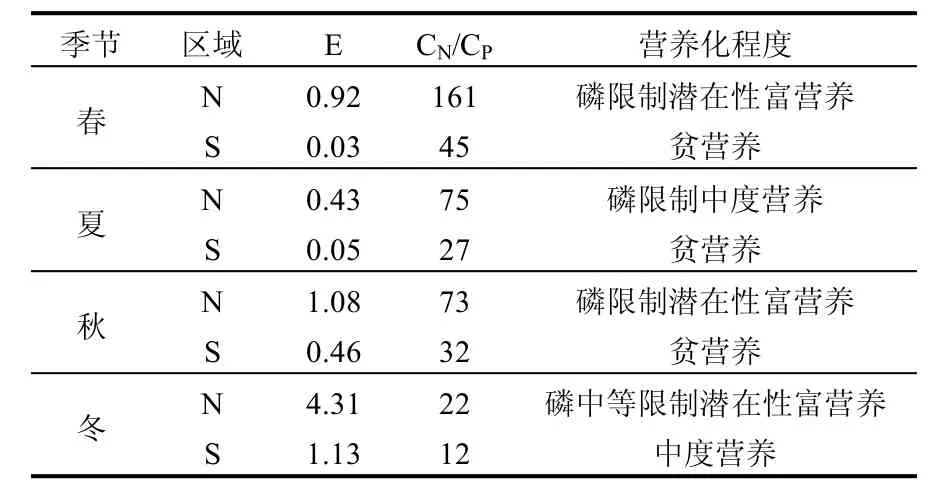
表5 研究区海水营养水平Table 5 Levels of eutrophication in the study area
3 讨论
3.1 粒级分布与营养级变化
粒径谱中各功能群粒级的分布往往体现了其在生态系统中能量流动的位置,因此结合生物量粒径谱和种类组成分析可以确定相应水域的食物网结构.辽东湾南、北2个区域各粒级优势种依次为中肋骨条藻、具槽帕拉藻、角毛藻、桡足类无节幼体、格式圆筛藻、星脐圆筛藻、洪氏纺锤水蚤、夜光藻、强壮滨箭虫,而且随粒级增加,营养级逐级上升.研究发现,虽然N、S区水环境、生物群落稳定性有所不同,但优势种差异并不明显,从生物量谱分析可知,应该是不同粒级的浮游生物数量差异所致.
粒径谱斜率(k)表示能量在群落中的传递效率及环境营养水平,斜率越负,表明不同营养级间的能流效率就越低[4].从斜率上看,浮游生物群落谱线较为陡峭,说明群落中相对较小的浮游生物占据优势地位,向较大浮游动物传递能量的效率偏低.从回归系数上看,粒径谱的线性测度较高(回归拟合系数r2),表明不同营养级间能量传递效率近似相等,系统较为稳定.
3.2 浮游生物群落的稳定性评估
ABC曲线法具有生态学中r-选择和k-选择策略的理论基础,可比较分析不同时期,不同胁迫情况下浮游生物群落的响应[34],W统计值可定量比较不同区域生物群落结构稳定性,统计结果显示,N区2012~2014年夏季和2013年秋季浮游生物累积丰度处于优势地位,受外界环境胁迫影响较大,而S区累积生物量全年处于优势地位,群落结构相对比较稳定,整体上看,S区浮游生物群落结构稳定性高于N区.本文构建的浮游生物群落稳定性评估模型测算结果表明,S区群落稳定性整体上高于N区,夏季尤为明显,与ABC曲线的W统计值测算结果基本一致,说明S区受外界环境影响胁迫较小.
由于北方海域浮游生物种类偏少,网采样品比水采样品有较高的采集效率,覆盖粒径范围更广泛,而目前的鉴定手段无法测算每个微微型生物种类的粒径大小,也无法衔接小型浮游植物和浮游动物的数量.本研究针对的浮游生物粒级研究是网采样品,不可避免漏掉大部分微型、微微型浮游植物及原生动物,可能无法全面表征各粒级浮游生物的实际分布,但本研究针对2个区域利用同种调查方法进行分析,基本可以反映不同环境胁迫下网采浮游生物的粒级结构响应规律.
3.3 粒级结构的环境胁迫响应
浮游生物标准生物量谱变化受多重因素影响,包括温度、盐度、营养盐、海流、捕食作用等[1,4].N、S区相距仅150km,但盐度、水温、DIN、 COD含量差异较为显著,为避免浮游生物低盐种类的影响,N区选取的10个站位盐度均在20以上,S区选取的10个站位盐度均在28以上,调查中N区也未检出淡水种类.由于N区水深相对较浅,同期调查水温在春、夏季略高,秋、冬季略低.重金属Cd、Hg、As含量在两区之间虽有差异,但差值较小,所测阈值也均在第二类海水水质标准范围内,对浮游生物的群落结构影响较小.而营养盐水平是影响浮游植物粒度的主要因素,调查发现,N区富营养化水平较高,S区则为寡营养水平.
浮游生物相对于底栖生物和游泳生物,受人类直接干扰较小,除了浮游动物上级食物链的捕食作用,浮游生物粒级结构的变化主要受环境影响较大.对比研究同一海域不同区域浮游生物粒级结构特征.环境因子的异同应该是最大的胁迫因素.
研究发现,N区较高的营养盐使得中肋骨条藻、具槽帕拉藻、角毛藻等以r-对策者为主的小个体浮游植物迅速繁殖,用以快速消耗进入系统中的能量,导致浮游生物群落偏离稳定状态.而S区环境系统相对较为稳定,生物群落反馈调节相对温和,因此浮游生物群落较N区稳定.许多研究也表明,较低的温度更适于大粒径浮游植物的生存[35].寡营养海域,微微型浮游植物占优势,富营养海域,初级生产力主要由粒径较大的小型浮游植物贡献[8,36-39].
4 结论
4.1 辽东湾海域浮游生物各粒级优势种依次为中肋骨条藻、具槽帕拉藻、角毛藻、桡足类无节幼体、格式圆筛藻、星脐圆筛藻、洪氏纺锤水蚤、夜光藻、强壮滨箭虫,营养级随粒级增加而上升,不同营养级间能量传递效率近似相等,但生态转化效率偏低.
4.2 辽东湾海域南部区域浮游生物群落整体上较北部稳定,富营养化会导致浮游生物群落偏离稳定状态,本文构建的浮游生物群落稳定性评估模型可尝试比较不同海域浮游生物群落的健康状况.
[1]李自尚.春季黄河口及其邻近水域浮游动物群落特征与粒径谱的初步研究 [D]. 青岛:中国海洋大学, 2012.
[2]Sheldon R W, Parkash A, Sutcliffe W H. The size distribution of particles in the ocean [J]. Limnology and Oceangraphy, 1972,17:327-340.
[3]Boudreau P R, Dickie L M, Kerr S R. Body-size spectra of production and biomass as system-level indicators of ecological dynamics [J]. Journal of Theoretical Biology, 1991,152(3):329-339.
[4]周林滨,谭烨辉,黄良民,等.水生生物粒径谱/生物量谱研究进展[J]. 生态学报, 2010,30(12):3319-3333.
[5]王 荣,林雅蓉,刘孝贤.太平洋表层水某些生物海洋学要素和颗粒谱的分布规律研究.海洋湖沼通报 [J]. 1988,19(6):505-517.
[6]王 荣.发展生物海洋学研究 [J]. 海洋科学, 1991,(5):17-21.
[7]王新刚,孙 松.粒径谱理论在海洋生态学研究中的应用 [J].海洋科学, 2002,26(4):36-39.
[8]杨茹君,王修林,石晓勇,等.海洋浮游植物粒径分布方法研究[J]. 高技术通讯, 2004,(6):89-94.
[9]杨茹君,王修林,韩秀荣,等.海洋浮游植物粒径组成及其生物粒径效应研究 [J]. 海洋科学, 2003,27(11):5-9.
[10]吴成业,焦念志.海洋浮游生物粒径谱分析技术 [J]. 高技术通讯, 2005,15(4):71-74.
[11]左 涛,王 俊,金显仕,等.春季长江口邻近外海网采浮游生物的生物量谱 [J]. 生态学报, 2008,28(3):1174-1182.
[12]左 涛,王 俊,唐启升,等.秋季南黄海网采浮游生物的生物量谱 [J]. 海洋学报, 2008,30(5):71-80.
[13]马艳娥,柯志新,黄良民,等.夏冬两季大亚湾典型海域浮游植物粒级结构特征 [J]. 热带海洋学报, 2013,32(3):40-46.
[14]邓春梅,于志刚.东 海、南黄海浮游植物粒级结构及环境影响因素分析 [J]. 中国海洋大学学报, 2008,38(5):791-798.
[15]宋 伦,王年斌,宋永刚,等.辽宁近岸浑浊海域网采浮游生物的粒径结构特征 [J]. 应用生态学报, 2013,24(4):900-908.
[16]宋 伦,周遵春,王年斌,等.辽东湾浮游植物多样性与海洋环境的关系 [J]. 海洋环境科学, 2007,26(4):365-368.
[17]GB/T 12763-2007 海洋调查规范 [S].
[18]GB17378-2007 海洋监测规范 [S].
[19]孙 军,刘东艳.中国海区常见浮游植物种名更改初步意见 [J].海洋与湖沼, 2002,33(3):271-286.
[20]孙 军,刘东艳,钱树本.浮游植物生物量研究 I. 浮游植物生物量细胞体积转化法 [J]. 海洋学报, 1999,21(2):75-85.
[21]Eppley R W, Reid F M, Strickland J D. The ecology of the plankton off La Jolla, Callifornia, in the period April through September 1967 Par Ⅱ. Estimates of phytoplankton crop size, growth rate and primary production [J]. Bulletin of the Scripps Institution of Oceanography. 1970,17:33-42.
[22]李雨苑,刘光兴,陈洪举.秋季黄海WP2型网采浮游动物的群落特征 [J]. 中国海洋大学学报(自然科学版), 2015,7:46-52.
[23]Satapoomin S. Carbon content of some common tropical Andaman Sea copepods [J]. Journal of Plankton Research, 1999,21(11):2117-2123.
[24]Ikeda T, Shiga N. Production, metabolism and production/ biomass (P/B) ratio of Themisto japonica (Crustacea: Amphipoda) in Toyama Bay, southern Japan Sea [J]. Journal of Plankton Research, 1999,21(2):299-308.
[25]Hopcroft R R, Roff J C, Chavez F P. Size paradigms in copepod communities: a re-examination [J]. Hydrobiologia, 2001,453/454: 133-141.
[26]Rodríguez J, Mullin M M. Relation between biomass and body weight of plankton in a steady state oceanic ecosystem [J]. Limnology and Oceanography, 1986,31:361-371.
[27]Yu Z S, Zhang Z N, Han J. Preliminary Study on Secondary Production of Macrobenthos in Bohai Sea [J]. Journal of Ocean University of Qingdao, 2001,31(6):867-871.
[28]Lalli C M, Parsons J R. Introduction to biologicaloceanography [J]. Oxford: Butterworth- Heinemann Publishing Ltd. 1997:228-229.
[29]Pinkas L, Oliphant M S, Iverson I L K. Food habits of albacore, bluefin tuna, and bonito in California waters [J]. California Department of Fish and Game Fish Bulletin, 1971,152:1-105.
[30]郭卫东,章小明,杨逸萍,等.中国近岸海域潜在性富营养化程度的评价 [J]. 台湾海峡, 1998,17(1):64-70.
[31]李清雪,陶建华.应用浮游植物群落结构指数评价海域富营养化[J]. 中国环境科学, 1999,19(6):548-551.
[32]Warwick R M. A new method for detecting pollution effects on marine macrobenthic communities [J]. Marine Biology, 1986,92(4):557-562.
[33]宋 伦,王年斌,杨国军,等.鸭绿江口及邻近海域生物群落的胁迫响应 [J]. 生态学报, 2013,33(9):2790-2802.
[34]Yemane D, Field J G, Leslie R W. Exploring the effects of fishing on fish assemblages using Abundance Biomass Comparison(ABC) curves [J]. ICES Journal of Marine Science, 2005,62(3):374-379.
[35]刘子琳,蔡昱明,陈中元,等.1998/1999年南极夏季普里兹湾及北部海区叶绿素a和初级生产力的分布特征 [J]. 极地研究,2002,14(1):12-21.
[36]江雪娇.北黄海微微型浮游植物的丰度及微微型真核浮游生物分子多样性研究 [D]. 青岛:中国海洋大学, 2009.
[37]焦念志,海洋微型生物生态学 [M]. 科学出版社, 2006.
[38]Anthony J R, Climate lmpact on Plankton Ecosystems in the Northeast Atlantic [J]. Science, 2004,305:1609-1612.
[39]张玉凤,田 金,杨 爽,等.大连湾海域营养盐时空分布、结构特征及其生态响应 [J]. 中国环境科学, 2015,35(1):236-243.
Ecological stability of plankton biomass size structure in Liaodong Bay.
SONG Lun1,2*, SONG Guang-jun1,2, WANG Nian-bin1,2(1.Liaoning Ocean and Fisheries Science Research Institute, Dalian 116023, China;2.Liaoning Ocean Environment Monitoring Station, Dalian 116023, China). China Environmental Science, 2015,35(10):3117~3126
Based on net collection and analyzing of plankton samples over all consecutive seasons during 2012~2014, we investigated the characteristics of plankton population size and structure in northern and southern region of Liaodong Bay by microscope micrometer and biomass size spectrum theory. A stability assessment model of the plankton communities was also established. The results showed that energy transfer efficiencies of plankton in different trophic levels were approximately equal, but the conversion efficiency decreased with increasing trophic level. The stability factor of southern Liaodong Bay was 0.53, while it was 0.47 in northern region. Plankton communities in southern area of the Bay were more stable than those of northern areas and it was more apparent in summer season, which indicated that environmental stress was less for southern area. The average of eutropher coefficient (E) was 1.69 in northern area, suggesting that it was at a high eutropher level, while southern area was at a light eutropher level with the average of E 0.42. The seawater nutritional status analysis contributed that eutrophication was a potential cause of the deviation from steady state in these communities. The stability assessment model developed in this study would also be useful for comparing the health of plankton communities in different bays.
plankton;size structure;size spectra;ABC curves;communities stability;Liaodong Bay
X171.1;Q89;P735
A
1000-6923(2015)10-3117-10
宋 伦(1980-),男,辽宁大连人,副研究员,硕士,主要从事海洋生物生态学研究.发表论文30余篇.
2015-02-13
辽宁省自然科学基金资助项目(2014020182);辽宁省海洋与渔业科研项目(201415);国家自然科学基金资助项目(31400406)
* 责任作者, 副研究员, songlun@lnshky.com
