草甘膦对同源假单胞基因工程菌代谢活性的影响
2015-11-19姜新舒北京科技大学环境与工程系北京100083
姜新舒,姚 俊(北京科技大学环境与工程系,北京 100083)
草甘膦对同源假单胞基因工程菌代谢活性的影响
姜新舒,姚 俊*(北京科技大学环境与工程系,北京 100083)
基于微量热法,研究两株基因缺失型斯氏假单胞杆菌对草甘膦的耐受毒性和降解作用,结果表明:草甘膦可以作为菌株的能量来源;草甘膦对P.stutzeri WM 581和P.stutzeri WM 567的半抑制浓度分别为47.47,43.26mg/L.两菌株对草甘膦均有较快的降解速率,其降解的半衰期约为9~17h,而草甘膦作为2类菌株生长过程中可以代谢的营养物质,其作为唯一碳源时的降解率(64%)要高于作为磷源时的降解率(43%).pH值与盐度对两菌株的生长有较大影响,草甘膦降解的较佳条件为:pH值为6,盐度低于0.5g/L.
微量热法;草甘膦;斯氏假单胞杆菌
目前,有机磷农药为应用最广、品种最多的农药品种[1].其中草甘膦作为广谱灭生性、内吸传导型有机磷除草剂[2],在世界上应用最广、产量最大,其在土壤中的残留积累给环境(包括土壤、水体、大气)安全带来了一定风险[3-4].
自然界中草甘膦等有机磷农药的降解主要包括光解、化学降解和微生物降解[5].其中,微生物降解因为其能耗低,不易造成二次污染而成为研究热点.目前,国内外报道的可降解草甘膦的细菌有节杆菌[6]、假单胞菌[7]、产碱杆菌、无色杆菌[8]、产黄菌[9]、节细菌[10]等,真菌有胶红酵母菌[11]、米曲霉菌[12]、假丝酵母菌和解脂亚罗酵母菌等[13].目前,国内对微生物降解草甘膦的研究主要集中在降解菌的筛选鉴定、微生物降解草甘膦的动力学研究和最优降解条件的探索,而农药与微生物作用过程中的微生物新陈代谢活动的影响研究较少,缺乏从代谢热力学角度研究微生物和草甘膦的相互影响.
微量热仪能够灵敏地监测微生物生长代谢过程中伴随的产热量,作为细胞代谢的重要生理参数,可以通过产热量的差异探究活细胞代谢强度及与环境要素的相关性.剖析细菌实时生长热谱图,可以获得细菌生长的热力学参数,如生长速率常数、总代谢热.对这些热力学参数进行分析,可从代谢热角度揭示外源物质对细菌的影响程度,并且是实时在线原位的监测细菌的产热量变化.而常规生物学方法是特异性的、间断、非原位的测定细菌的生化指标,这可能导致部分关键作用过程的缺失.基于微量热测定的非特异性的优点,近年来,微量热仪已经广泛地应用于各种污染物对细菌生长、代谢的影响以及大分子功能或细胞之间的相互作用等研究[14-17].
本研究从细菌代谢热角度研究2株斯氏假单胞菌(Pseudomonas stutzeri WM 567和Pseudomonas stutzeri WM 581)在草甘膦作用下代谢活性差异,明确由基因差异而引起的活性的变化;另外,通过降解实验,证明2株斯氏假单胞菌对草甘膦也具有一定的降解能力,以证明环境中具有有机污染物降解功能的微生物也受到所降解物质的抑制,为进一步了解降解微生物的生理代谢提供参考.
1 材料与方法
1.1 材料
1.1.1 农药 草甘膦(北京盐化永乐农药有限公司,商品名美安达,草甘膦异丙胺盐含量41%,草甘膦含量30%)
1.1.2 菌株 P.stutzeri WM 567,P.stutzeri WM 581(由美国耶鲁大学地学系环境地球化学课题组提供).所用到的斯氏假单胞菌是Pseudomonas stutzeri WM 567和Pseudomonas stutzeri WM 581,它们是通过改造能够利用有机磷化合物为磷源的野生菌株Pseudomonas stutzeri WM 88基因而得到的.Pseudomonas stutzeri WM 567是通过基因工程技术将2种不同质粒pWM238、pWM 239克隆到野生菌株Pseudomonas stutzeri WM 88的质粒pWM 95中构建的突变菌株,此菌株对链霉素具有抗性,对次磷酸和亚磷酸呈阳性反应(能够将其氧化为膦酸).Pseudomonas stutzeri WM 581是通过改造Pseudomonas stutzeri WM 567而得到的突变菌株,该菌株对次膦酸和亚膦酸呈阴性反应(不能够将其氧化为膦)[18-19].
1.1.3 培养基 LB固体培养基(g/L):胰蛋白胨10, 酵母提取物5, NaCl 10, 琼脂粉15.牛肉汤营养培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5.无机盐葡萄糖培养基:(NH4)2SO4375mg/L,MgSO475mg/L,CaCO330mg/L, FeSO4.7H2O 1mg/L,H3BO31×10-3mg/L, MnSO41×10-3mg/L, KH2PO42g/L, Na2HPO46g/L,葡萄糖1g/L.
1.1.4 实验仪器 紫外可见光分光光度计(岛津UV-1800,日本),十二通道微量热仪(TAMIII Multi-channel Thermal Activity Monitor,美国TA仪器).
1.2 方法
1.2.1 菌种的接种活化 将低温保存的菌种转接到LB固体培养基上划线培养,37 ℃恒温培养箱中培养5d.将LB固体培养基上的菌株转接到150mL牛肉汤营养培养基中进行一次活化,30℃、150r/min摇床培养3d.按2%接种量转接到150mL无机盐葡萄糖培养基中进行2次活化,30℃、150r/min摇床培养3d.
1.2.2 草甘膦对菌株生长的影响 按2%的接种量在150mL无机盐葡萄糖培养基中接种菌株,P.stutzeri WM 567中草甘膦浓度依次为0,50,200,600,1000,2500mg/L,P.stutzeri WM 581中草甘膦浓度依次为0,26,50,100,200,400,600mg/L,30℃、150r/min摇床培养,每隔2h用紫外分光光度计测量其在600nm波长下的吸光度值(OD),绘制OD600—时间曲线.草甘膦对菌株生长影响实验设置3个重复,取其平均值.
1.2.3 微量热测量草甘膦对菌株代谢活性的影响 不锈钢安瓿瓶先后用自来水、超纯水冲洗,放入35℃超声波清洗机清洗30min,重复3次,再次用超纯水冲洗并烘干、灭菌.向不锈钢安瓿瓶中加入2mL无机盐葡萄糖液体培养基(根据草甘膦对菌株生长影响实验,选取草甘膦浓度梯度值为0,50,100,200,400mg/L),再用移液枪向安瓿瓶中接种菌液,设置无菌空白对照.将安瓿瓶置于微量热仪中,并记录28℃条件下的热功率-时间曲线.
1.2.4 草甘膦标准曲线的绘制 草甘膦标准液的配制:称取0.30g草甘膦(30%水剂)置于200mL烧杯中,加入60mL水溶解.转移至250mL容量瓶中定容并摇匀(使用时间不得超过20d),得到360mg/L的草甘膦标准液.精确吸取0.00,0.05,0.125,0.25,0.5,0.75mg草甘膦标液于5个10mL容量瓶中定容,将样品进行亚硝基化反应[20].使用紫外可见光分光光度计测量上述溶液在243nm[20]处的吸光度,设置空白对照,绘制标准曲线.
1.2.5 菌株对草甘膦降解作用的测定 分别以草甘膦为唯一磷源、唯一碳源及碳源和磷源,配制无机盐培养基(以草甘膦替代无机盐葡萄糖培养基中的相应营养物质,草甘膦浓度为80mg/L).按2%的接种量接种P.stutzeri WM 567、P.stutzeri WM 581,30℃、150r/min摇床培养,分别在6,9,12,17h取2mL草甘膦降解菌液,13000r/min离心取上层清液,亚硝基化紫外分光光度法[20]测量草甘膦含量.定时取样测定菌液OD600值.每个降解实验设置3个重复.
1.2.6 环境因素对2株菌降解草甘膦的影响用盐酸和氢氧化钠调节无机盐葡萄糖培养基pH值分别为4、6、8、10、12.盐度分别为0,533,1000,3000,5000mg/L.17h后取样,测定不同pH值和盐度下草甘膦的最终含量.每个环境因素对2株菌降解草甘膦的影响实验设置3个重复.
2 结果与讨论
2.1 草甘膦对菌株生长的影响

图1 草甘膦对菌株生长的影响Fig.1 The effects of glyphosate on the growth of strain
如图1所示,随着草甘膦浓度的增加,P.stutzeri WM 581、P.stutzeri WM 567 2株菌生长的适应期延长,对数期缩短,稳定期的峰值降低.当草甘膦浓度达400mg/L以上,2株菌的生长完全被抑制,为微量热实验的草甘膦浓度选取提供依据.
2.2 草甘膦对2株菌代谢活性的影响
通过热力学动力方程:

计算获得微生物生长速率常数k.式中:Pt为时间t时所测得的细菌总热功率,P0为时间t0时的细菌总热功率,微生物活性越高、生长越快,则k值越大.
草甘膦对细菌生长代谢过程的抑制率I为:

式中:k0为微生物未受到抑制时生长代谢的速率常数,kc为微生物受到浓度为c的草甘膦抑制作用时的速率常数.当抑制率I为50%时所对应的草甘膦浓度为半抑制浓度.
微量热谱图显示,草甘膦对P.stutzeri WM 581、P.stutzeri WM 567两株菌的毒性影响基本一致,说明,所改造的基因del3(Bsi WI)∷aph[18,19]并未改变菌株对草甘膦的耐受性.在较低浓度(50mg/L)时草甘膦对菌株生长起到了促进作用,随着浓度的增高,其对菌株的抑制作用才逐渐显现出来.从功率-时间曲线参数中可以看到(图2):草甘膦使功率曲线出峰时间后移,当其浓度为50mg/L时,k值降低,而最大热功率和总放热量增加,说明虽然较低浓度的草甘膦使微生物的生长速率降低,但菌株的活性增大;随着浓度继续增加,最大热功率和总放热量降低,说明草甘膦对微生物的毒性增大,菌株活性被抑制.陶波等[21]报道低浓度草甘膦对镰刀菌产生激活作用,高浓度草甘膦对镰刀菌具有抑制作用.当草甘膦浓度达到400mg/L时,最大热功率值和总放热量均有小幅回升,这说明此时微生物产生了应急反应,这与在400mg/L时检测到微生物基本不生长的实验现象相符.
P.stutzeri WM 581和P.stutzeri WM 567均为P.stutzeri WM88的突变衍菌株.William等[18]已经证明P.stutzeri WM88的染色体上存在编码C-P裂解酶的基因,并且这种C-P裂解酶可以在还原态含P化合物中起到一定作用.该报道推测P.stutzeri WM88的染色体上还存在另外一种未知的编码C-P裂解酶的基因.本研究所用的P.stutzeri WM 567是自发对链霉素产生抗性的平滑型P.stutzeri WM88衍生菌株,它能够氧化低价态的P化合物.P.stutzeri WM 581相对于P.stutzeri WM 567缺失基因片段del3(Bsi WI)∷aph,致使其不能够氧化低价态的P化合物.对比这两株同源假单胞基因工程菌,草甘膦对其代谢活性的影响基本一致.因此,从菌株代谢角度提出两种猜测:(1)对于已知的编码C-P裂解酶的基因,P.stutzeri WM 581缺失的基因片段并不影响其合成C-P裂解酶;(2)P.stutzeri WM 581缺失的基因片段致使其不能正常合成C-P裂解酶,但是其染色体上另外一种未知的编码C-P裂解酶的基因在代谢中起到了作用,从而使草甘膦对其代谢活性的影响与P.stutzeri WM 567基本一致,而这种未知的编码C-P裂解酶的基因需要进一步通过分子生物学方法去研究、证实.
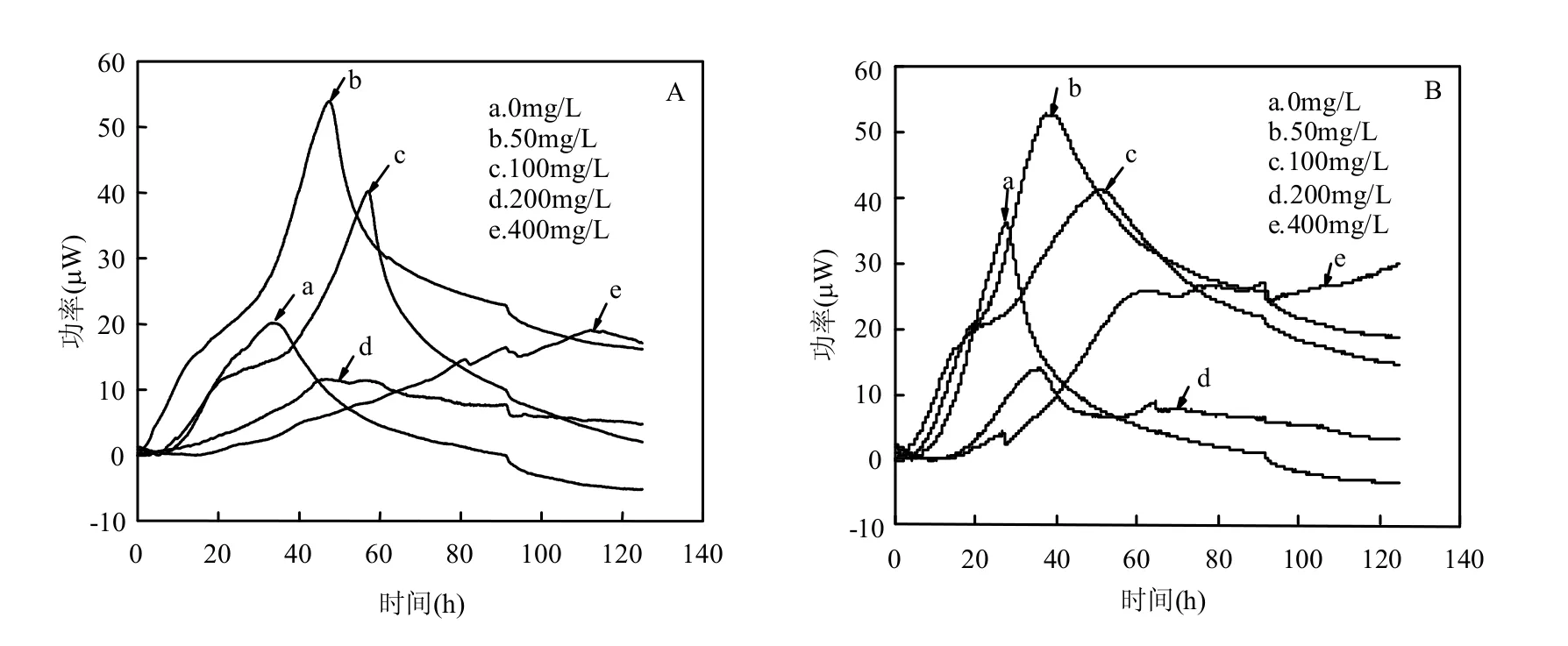
图2 P.stutzeri WM 567与P.stutzeri WM 581在不同草甘膦浓度下的功率-时间曲线Fig.2 Power-time curves of P.stutzeri WM 567 and P.stutzeri WM 581 at a series of concentrations of glyphosate
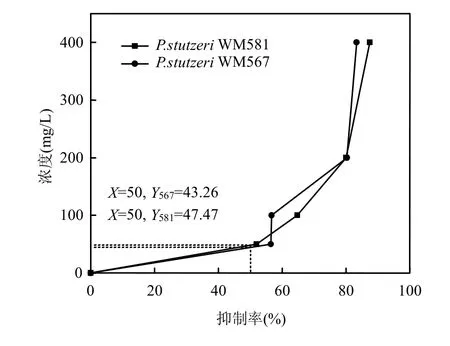
图3 草甘膦对菌株的半抑制浓度Fig.3 The half inhibitory concentration of glyphosate on strains
如图3所示,随草甘膦浓度增加,对P.stutzeri WM 567和P.stutzeri WM 581抑制率增大.草甘膦对两株基因工程菌的抑制程度基本保持一致,具有相同的上升趋势,草甘膦对P.stutzeri WM 581的半抑制浓度为47.47mg/L,对P.stutzeri WM 567的半抑制浓度为43.26mg/L.说明P.stutzeri WM 581菌株对草甘膦的抗性比P.stutzeri WM 567稍强,进一步说明P.stutzeri WM 567能够氧化草甘膦为磷酸,降低草甘膦的胁迫,尤其表现在低浓度下(100mg/L),而去除基因片段del3(Bsi WI)∷aph的P.stutzeri WM 581由于没有显著的氧化作用,表现出完全的胁迫,导致其细胞释放更多的热量来维持其自身的新陈代谢,释放更多的热量.如表1所示,在50,100mg/L草甘膦作用下,P.stutzeri WM 581分别释放12.13,10.2J的热量,高于P.stutzeri WM 567释放的热量(分别为10.8,5.86J).但在高浓度作用下(>100mg/L),草甘膦的胁迫作用加强,导致毒性加大,细胞的新陈代谢受到强烈的抑制或者停滞,导致释放的热量进一步减少.在高浓度下,具有氧化功能的P.stutzeri WM 567由于正常的新陈代谢活动的抑制,其潜在的氧化能力也相应减弱,释放热量也进而降低.上述结果证明了在低污染物浓度下,具有降解功能的微生物在降解污染物的过程中释放较低的热量,而不具备降解功能或弱降解功能的微生物在胁迫作用下释放更多的热量,这为了解污染物与降解菌的作用机制提供了良好的基础.

表1 微量热监测草甘膦对菌株的毒性参数Table 1 Calorimetric parameters of glyphosate toxicity for strains
2.3 两株菌对草甘膦的降解作用
如图4、图5所示,以草甘膦为唯一磷源的培养液中,细菌明显比以草甘膦为唯一碳源、以草甘膦为磷源和碳源时生长的更为迅速,但是草甘膦的降解率并没有其他2种情况高.与草甘膦作为碳源的培养基相比,草甘膦为磷源的培养基中有葡萄糖作为碳源和能源物质,为细菌生长提供了营养,使细菌生长更为迅速.说明微生物生长优先利用葡萄糖作为碳源和能源物质,而草甘膦是细菌在污染胁迫情况下可以利用的营养物质.这与石成春等[22]报道的在草甘膦和葡萄糖组成的共基质底物系统中,微生物优先利用葡萄糖作为碳源和能源物质相符.此外,以草甘膦为磷源的培养基中,葡萄糖的初始浓度(1g/L)相对于草甘膦的初始浓度(80mg/L)较高,由于共基质代谢过程中不同底物之间存在竞争抑制作用,高浓度的葡萄糖反而会抑制草甘膦的共代谢降解速率[23].
本部分实验表明P.stutzeri WM 581和P.stutzeri WM 567对草甘膦具有一定的降解作用,微量热实验表明菌株生长被高浓度草甘膦抑制,证明环境中具有有机污染物降解功能的微生物也受到所降解物质的抑制.产生这种现象可能是因为草甘膦浓度较低时,可以激发降解酶催化活性,草甘膦作为营养物质被利用,从而增大了菌株的活性;当底物浓度超过临界值后,草甘膦与降解酶形成多元络合物,从而抑制了酶的降解活性[24],草甘膦难以被微生物利用,因此菌株的活性降低.

图4 草甘膦作为不同营养物质时对菌株生长的影响Fig.4 The effects of glyphosate serving as different nutrients on the growth of strains
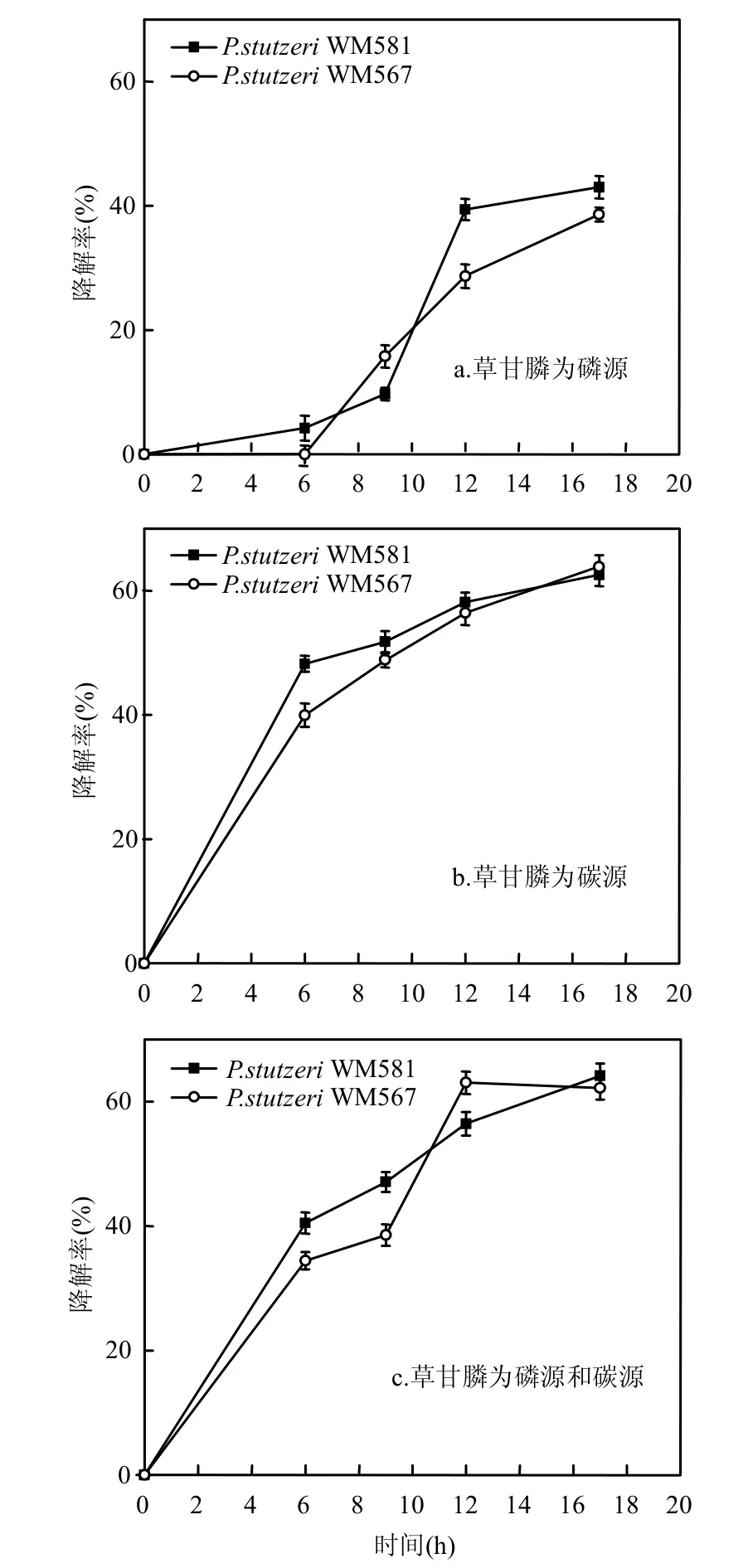
图5 P.stutzeri WM 581和P.stutzeri WM 567对草甘膦的降解效率Fig.5 The degradation rate of glyphosate by P.stutzeri WM 581和P.stutzeri WM 567
2.4 环境因素对两株菌降解草甘膦的影响
如图6所示,当pH值增大接近6时,对草甘膦的降解率达到最大值44% (P.stutzeri WM 567)和48%(P.stutzeri WM 581).pH值继续增大,草甘膦的降解率随之降低,菌株降解草甘膦的pH最适值均为6.不同微生物降解草甘膦的最优pH值均6.5~7.5[6,12,25].随着NaCl浓度的升高,草甘膦的降解率增加,当NaCl浓度达到0.5g/L时,草甘膦的降解率最高达到51%(P.stutzeri WM 567)、53%(P.stutzeri WM 581).但当NaCl浓度继续升高,草甘膦的降解率降低.菌株降解草甘膦的NaCl最适浓度为0.5g/L,与叶明等[25]的研究一致.
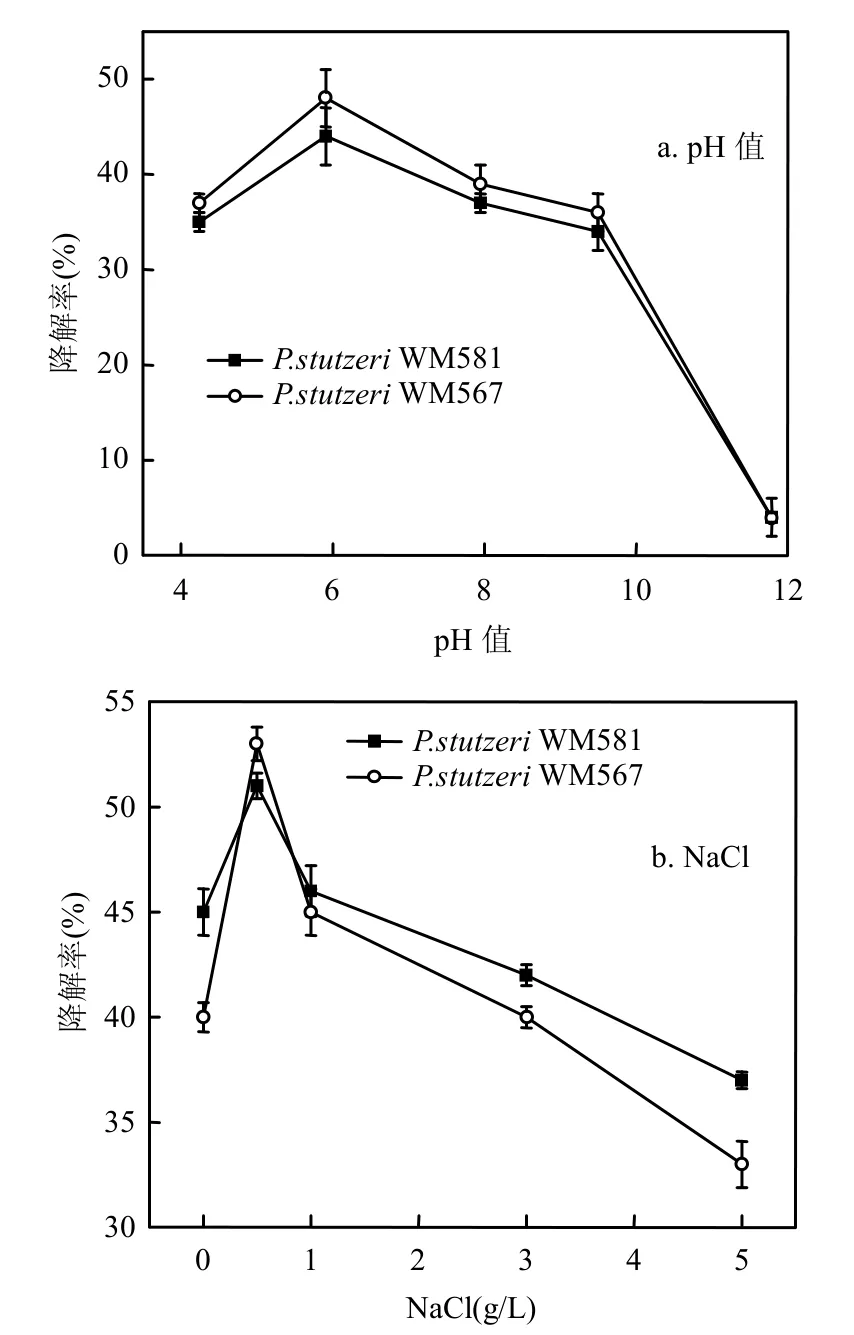
图6 pH值与NaCl浓度对草甘膦降解率的影响Fig.6 The effects of pH and NaCl concentration on degradation rate of glyphosate
3 结论
3.1 草甘膦对2株同源假单胞基因工程菌P.stutzeri WM 581、P.stutzeri WM 567的毒性影响基本一致:低浓度促进生长、高浓度抑制生长.所改造的基因del3(Bsi WI)∷aph并未改变菌株对草甘膦的耐受性.为P.stutzeri染色体上存在另外一种未知的编码C-P裂解酶基因提供证据.
3.2 草甘膦对P.stutzeri WM 581、P.stutzeri WM 567的半抑制浓度分别为47.47,43.26mg/L.说明P.stutzeri WM 581对草甘膦的抗性比P.stutzeri WM 567稍强.微量热实验表明,低污染物浓度下,具备降解功能的微生物在降解污染物的过程中释放较低的热量,而不具备降解功能或弱降解功能的微生物在胁迫作用下释放更多的热量.
3.3 菌株生长被高浓度草甘膦抑制,证明环境中具有有机污染物降解功能的微生物也受到所降解物质的抑制.两菌株对草甘膦均有较快的降解速率,其降解半衰期约为9~17h,而草甘膦作为菌株生长过程中可以代谢的营养物质,其作为唯一碳源时的降解率(64%)要高于作为磷源时的降解率(43%).pH值与盐度对菌株的生长有较大影响,草甘膦降解的较佳条件为:pH6,盐度低于0.5g/L.
[1]葛会林,刘树深,苏冰霞.通用浓度加和模型预测有机磷与三嗪农药对绿藻的联合毒性 [J]. 中国环境科学, 2014,34(9):2413-2419.
[2]夏 爽,赵砚彬,杨鸣琦,等.草甘膦对青鳉鱼卵黄蛋白原的诱导及其潜在分子机理 [J]. 中国环境科学, 2013,33(9):1656-1663.
[3]裴 亮,张体彬,赵 楠,等.有机磷农药降解方法及应用研究新进展 [J]. 环境工程, 2011,(S1):273-277.
[4]周垂帆,李 莹,张晓勇,等.草甘膦毒性研究进展 [J]. 生态环境学报, 2013,(10):1737-1743.
[5]Van Eerd L L, Hoagland R E, Zablotowicz R M, et al. Pesticide metabolism in plants and microorganisms [J]. Weed Science,2003,51(4):472-495.
[6]Kryuchkova Y V, Burygin G L, Gogoleva N E, et al. Isolation and characterization of a glyphosate-degrading rhizosphere strain,Enterobacter cloacae K7 [J]. Microbiological Research, 2014,169(1):99-105.
[7]吴 翔,康纪婷,甘炳成,等.菌株BR13降解有机磷农药的特性研究 [J]. 环境科学与技术, 2011(11):54-58.
[8]Forlani G, Mangiagalli A, Nielsen E, et al. Degradation of the phosphonate herbicide glyphosate in soil: evidence for a possible involvement of unculturable microorganisms [J]. Soil Biology and Biochemistry, 1999,31(7):991-997.
[9]Terry M B, Hallas. Glyphosate-degrading microorganisms from industrial activated sludge [J]. Applied and Environmental Microbiology, 1986,51(2):432-434.
[10]Pipke R, Amrhein N. Isolation and characterization of a mutant of Arthrobacter sp. strain GLP-1which utilizes the herbicide glyphosate as its sole source of phosphorus and nitrogen [J]. Applied and Environmental Microbiology, 1988,54(11):2868-2870.
[11]Kambiranda D M, Asraful-Islam S M, Cho K M, et al. Expression of esterase gene in yeast for organophosphates biodegradation [J]. Pesticide Biochemistry and Physiology, 2009,94(1):15-20.
[12]Bhalerao T S, Puranik P R. Microbial degradation of monocrotophos by Aspergillus oryzae [J]. International Biodeterioration and Biodegradation, 2009,63(4):503-508.
[13]Cristina R M, Enso H, Reinoso A, et al. Biodegradation of glyphosate by wild yeasts [J]. Revista Mexicana De Micologia,2004(19):45-50.
[14]Braissant O, Bachmann A, Bonkat G. Microcalorimetric assays for measuring cell growth and metabolic activity: Methodology and applications [J]. Methods, 2015, in press.
[15]佘文文,姚 俊,王 飞,等.等温微量量热法研究石油污染对土壤微生物活性的影响 [J]. 环境工程学报, 2013,(9):3624-3628.
[16]Chen H, Yao J, Wang F, et al. Study on the toxic effects of diphenol compounds on soil microbial activity by a combination of methods[J]. Journal of Hazardous Materials, 2009,167(1-3):846-851.
[17]陈小娟,沈韫芬,刘 义,等.利用微量热法研究Cd2+和Cu2+对嗜热四膜虫(Tetrahymena thermophila)的毒性效应 [J]. 应用与环境生物学报, 2004,10(6):745-749.
[18]William W, Metcalf, Ralph S Wolfe. Molecular genetic analysis of phosphiteand hypophosphite oxidation by Pseudomonas stutzeri WM88 [J]. Journal of Bacteriology, 1998,180(21):5547-5558.
[19]White A K, Metcalf W W. Two c--p lyase operons in Pseudomonas stutzeri and their roles in the oxidation of phosphonates, phosphite, and hypophosphate [J]. Journal of Bacteriology, 2004,186(14):4730-4739.
[20]汪海萍,邵 燕,王志良,等.分光光度法测定废水中草甘膦的探讨 [J]. 环境监测管理与技术, 2012,(3):56-59.
[21]陶 波,蒋凌雪,沈晓峰,等.草甘膦对土壤微生物的影响 [J]. 中国油料作物学报, 2011,(2):162-168.
[22]石成春,郭养浩,王大奈,等.草甘膦曲霉生物降解的动力学研究[J]. 中国环境科学, 2005,35(3):361-365.
[23]Ziagova M, Liakopoulou-Kyriakides M. Comparison of cometabolic degradation of 1,2-dichlorobenzene by Pseudomonas sp. and Staphylococcus xylosus [J]. Enzyme and Microbial Technology, 2007,40(5):1244-1250.
[24]夏凤毅,臧荣春.微生物动力学模型 [M]. 北京:化学工业出版社, 2004:164-172.
[25]叶 明,陈九山,姚晓庆.一株草甘膦降解菌分离鉴定及其降解特性研究 [J]. 环境科学与技术, 2009,32(3):39-41.
Metabolic activity effects of glyphosate on homologous gene engineering bacteria of Pseudomonas.
JIANG Xin-shu,YAO Jun*(Department of Environmental Science and Engineering, University of Science and Technology Beijing,Beijing 100083, China). China Environmental Science, 2015,35(10):3078~3084
On the basis of microcalorimetric technology, we investigated the effect of glyphosate on metabolic activity of two homologous gene engineering bacteria of Pseudomonas. Glyphosate can serve as nutrients of these two strains.The half inhibitory concentration of glyphosate for P.stutzeri WM 581 and P.stutzeri WM 567 were 47.47mg/L and 43.26mg/L respectively. Both of strains can degrade glyphosate rapidly, and the half-life was approximate 9~17 hours. And as metabolism nutrients of these two strains, the degradation rate of glyphosate as carbon source (64%) is higher than as phosphorus source (43%). Salinity and pH impacted the growth of these two strains remarkably, the relatively optimal condition to degrade glyphosate is: pH = 6, NaCl < 0.5g/L.
microcalorimetry;glyphosate;Pseudomonas strains
X172
A
1000-6923(2015)10-3078-07
姜新舒(1991-),女,辽宁本溪人,北京科技大学硕士研究生,主要从事微生物修复有机磷农药污染的研究工作.
2015-03-19
国家杰出青年科学基金资助项目(40925010)
* 责任作者, 教授, yaojun@ustb.edu.cn
