沸石负载对叔丁基杯[4]芳烃乙酸对铀的吸附行为
2015-11-19张晓峰陈迪云莫扬之广州大学环境科学与工程学院广东广州50006广东省放射性核素污染控制与资源化重点实验室广东广州50006
张晓峰,陈迪云*,彭 燕,莫扬之,郝 娇(.广州大学环境科学与工程学院,广东 广州 50006;2.广东省放射性核素污染控制与资源化重点实验室,广东 广州 50006)
沸石负载对叔丁基杯[4]芳烃乙酸对铀的吸附行为
张晓峰1,2,陈迪云1,2*,彭 燕1,2,莫扬之1,郝 娇1(1.广州大学环境科学与工程学院,广东 广州 510006;2.广东省放射性核素污染控制与资源化重点实验室,广东 广州 510006)
以对叔丁基杯[4]芳烃与溴乙酸乙酯为主要反应底物合成了对叔丁基杯[4]芳烃乙酸,然后将其负载在沸石上,红外光谱显示合成物具有杯[4]芳烃乙酸的特征结构,扫描电镜分析表明对叔丁基杯[4]芳烃乙酸成功负载于沸石之上,且分布均匀,分散性良好.通过静态吸附实验,结果表明在pH值 4,对叔丁基杯[4]芳烃乙酸/沸石的负载比0.025/1,吸附剂用量0.5g,铀初始质量浓度10mg/L,吸附时间30min时,沸石在负载了对叔丁基杯[4]芳烃乙酸后,对溶液中铀的吸附率从30%左右提高到93%.沸石和负载沸石吸附动力学行为均符合准二级动力学模型,但负载沸石对铀的吸附速率明显高于沸石.沸石和负载沸石吸附等温式都符合Langmuir吸附等温线,说明都为单分子层吸附;由此推导出的最大吸附量Qm从16.8919提高到32.5733mg/g,这主要是因为沸石负载了对叔丁基杯[4]芳烃乙酸增加了吸附点位.吸附铀前后的红外光谱表明,负载沸石对铀的去除主要依靠对叔丁基杯[4]芳烃乙酸与铀的强络合作用和Si—O和Al—O的吸附作用,两种作用的协同加快了吸附速率,增加了吸附容量.
对叔丁基杯[4]芳烃乙酸;负载;沸石;铀;协同吸附
随着核电的快速发展,对铀的需求日益加剧,铀矿山、铀冶炼厂等单位中含铀废水的排放量也日益增多.由于铀元素具有化学毒性和辐射危害,对含铀废水的处理越来越受到人们的重视[1-4].传统的单一吸附剂对含铀废水处理时,往往存在处理效率较低等缺陷[5-6].杯芳烃的π体系洞穴结构中电子量丰富,能通过强烈的静电作用吸引阳离子,并对对配位数较高的铀、钍和稀土等金属元素具有很强的络合能力[7-10].对叔丁基杯[4]芳烃经化学修饰转化为杯[4]芳烃乙酸后,电负性乙酸根的引入增强了其络合能力、极性和在特定的化学条件下的选择识别性.然而,对叔丁基杯[4]芳烃乙酸固体的颗粒直径较大,密度小于水,反应时浮于溶液表面,分散效果不好,与溶液接触不充分,严重影响了反应效率.同时,杯[4]芳烃乙酸为粉末状物质,若直接应用于水处理,较难进行固液分离[9-14].
沸石的表面积丰富,是常用的金属离子去污剂[15-16];但是单一的沸石材料,一般吸附速度慢且吸附容量也不足.因此,在许多研究中沸石都被作为一种骨架材料,通过对其表面的进行修饰、组装和改性得到一系列高效的协同吸附材料[17].本研究创新性地选用沸石负载对叔丁基杯[4]芳烃乙酸,以固定对叔丁基杯[4]芳烃乙酸固体并增加与溶液的接触,以增强其去污效果.此外,沸石也具有一定的吸附性能,二者可望形成良好的协同作用[18-19].本文拟合成杯[4]芳烃乙酸并将其负载在沸石上,考察沸石负载对叔丁基杯[4]芳烃乙酸前后处理水溶液中的铀的效果,并初步探讨沸石与超分子协同吸附的机理.
1 材料与方法
1.1 主要仪器与试剂
Nexus-870傅里叶变换红外光谱仪(Nicolet公司);TESCAN VEGAS3SBU型扫描电镜(捷克TESCAN公司);激光粒度仪(HELOS德国新帕泰克有限公司)等.对叔丁基杯[4]芳烃(购于北京广文精细化工研究所 纯度99%);人造4A沸石(天津大茂化学试剂厂粒度60~100目孔径分布0.4nm 比表面积约600m2/g);U3O8(GR);溴乙酸乙酯(购于阿拉丁试剂公司98%).
1.2 对叔丁基杯[4]芳烃乙酸的合成与表征[20]
1.2.1 对叔丁基杯[4]芳烃乙酸的合成 取350mL丙酮、20g无水K2CO3、15g对叔丁基杯[4]芳烃和20mL溴乙酸乙酯于500mL四口瓶中,加热回流4d,冷却,过滤,用二氯甲烷反复洗涤固体,再过滤,取滤液减压蒸发至油状,加入适量甲醇于0℃下静置24h,沉淀得到晶体,再用乙醇重结晶,烘干晶体,即得对叔丁基杯[4]芳烃乙酸乙酯,产率80%.取10g对叔丁基杯[4]芳烃乙酸乙酯、25g KOH、22mL水和22mL乙醇于250mL三口瓶中加热搅拌,回流2d后,以70mL浓盐酸中和,过滤,以大量水冲洗,烘干,即得对叔丁基杯[4]芳烃乙酸的白色固体.合成反应方程式如下:
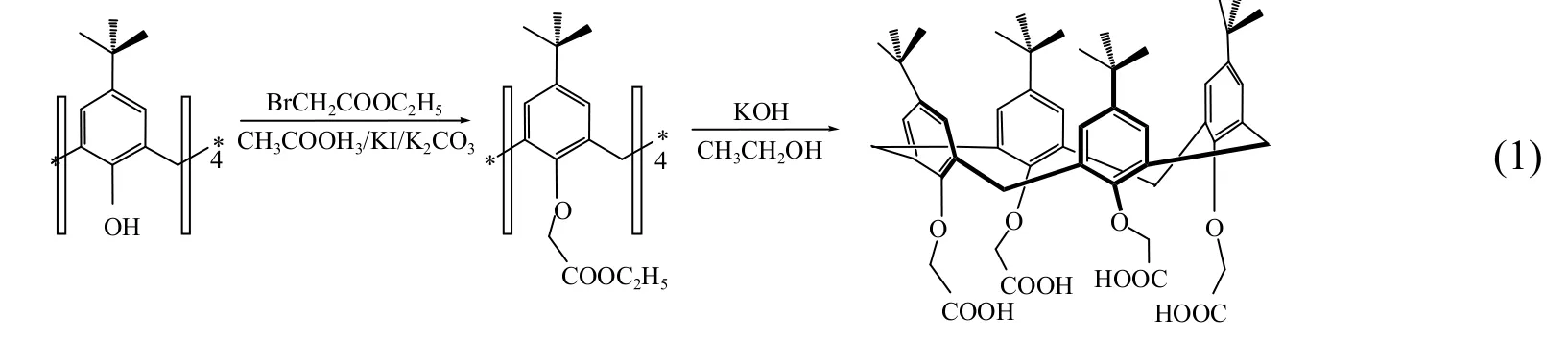
1.2.2 对叔丁基杯[4]芳烃乙酸的表征 由于中间产物对叔丁基杯[4]芳烃乙酸乙酯与目标产物对叔丁基杯[4]芳烃乙酸都是由对叔丁基杯[4]芳烃为骨架合成而来,那么只需由红外分析其官能团即可确定这两种产物了.
从图1可知,在1600~1700cm-1内为酯C=O结构的特征峰,说明通过取代反应乙酸乙酯基团已被链接至杯芳烃骨架上;在1040cm-1处和1240cm-1处各有一尖锐的强峰说明有醚类物质的C—O—C结构存在,即可说明生成了对叔丁基杯[4]芳烃乙酸乙酯.且酚羟基的吸收峰已近消失,说明该羟基已被全部取代,符合反应方程式1.
从图2可知,在1735cm-1处的吸收峰为羧酸C=O基团的特征峰,在1200和1236cm-1处的吸收峰为羧酸C—OH结构的特征峰,在1391和721cm-1处的吸收峰为羧酸COO结构的特征.说明对叔丁基杯[4]芳烃乙酸乙酯已成功水解生成了对叔丁基杯[4]芳烃乙酸.

图1 对叔丁基杯[4]芳烃乙酸乙酯的红外光谱Fig.1 IR parameter of p-calix[4]arene-ethyl tert butyl acetate

图2 对叔丁基杯[4]芳烃乙酸红外光谱Fig.2 IR parameter of p-tert-butyl calix[4]arene
1.3 对叔丁基杯[4]芳烃乙酸在沸石上的负载与表征
取一定质量的对叔丁基杯[4]芳烃乙酸于烧杯中,加入适量CH2CCl2将其溶解,再按比例加入适量沸石;将烧杯置于47℃的恒温水浴锅中加热搅拌使CH2CCl2挥发,待干燥后,便得到负载对叔丁基杯[4]芳烃乙酸的沸石.对沸石负载对叔丁基杯[4]芳烃乙酸前后的材料的扫描电镜分析结果如图3所示.

图3 沸石(a)和负载沸石(b)的扫描电镜图Fig.3 SEM of zeolite(a)and loaded zeolite(b)
从图3(a)(b)的SEM图可知,沸石在负载超分子前其表面为层状物矿物结构,而在负载超分子后其表面出现了颗粒状物质,且在沸石表面分布状况比较均匀,说明对叔丁基杯[4]芳烃乙酸在沸石的表面分布均匀、分散良好.
1.4 吸附实验与计算方法
吸附实验: 在一系列500mL具塞锥形瓶中,加入300mL用去离子水配制的不同浓度的铀溶液;鉴于我国铀矿山废水多成酸性其pH值在3~5,本次实验将溶液的pH值调为4;然后称取一定量60~100目的沸石或负载了对叔丁基杯[4]芳烃乙酸的沸石加入铀溶液中,在140/min振荡频率的恒温水浴振荡器中进行分组吸附实验;待反应适当时间后,进行固/液过滤分离,分析过滤液中的铀含量.
溶液中U(Ⅵ)含量的测定方法(Br-PADAP分光光度法),见文献[21].
铀吸附率:
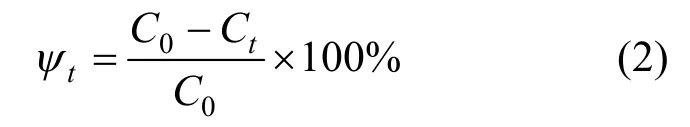
式中:C0为初始铀浓度,mg/L;Ct为t时的铀浓度mg/L.
铀的吸附容量:
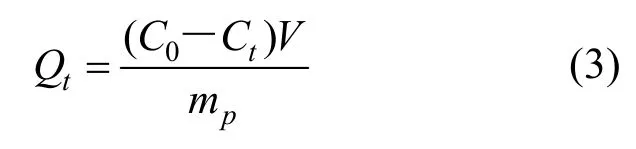
式中:C0为初始铀浓度mg/L;Ct为t时的铀浓度mg/L;V为溶液体积mL;mP为加入吸附剂的总质量,g.
2 结果与讨论
2.1 不同对叔丁基杯[4]芳烃乙酸负载量的沸石对去除铀的影响
取负载了不同质量的对叔丁基杯[4]芳烃乙酸的沸石0.5g,在振荡频率140r/min,初始铀浓度10mg/L,含铀溶液体积300mL,初始pH值为4的条件下做静态吸附平衡实验,结果见图4.

图4 对叔丁基杯[4]芳烃乙酸用量对协同吸附铀的影响Fig.4 Effects of p-tert-butyl calix[4]arene dosage on cooperative adsorption of uranium
从图4可知,随着超分子用量的增加,负载沸石吸附铀的吸附率和吸附容量都呈现先上升后下降的趋势.这是因为当对叔丁基杯[4]芳烃乙酸/沸石的负载比例<0.025/1时,对叔丁基杯[4]芳烃乙酸用量不够,增加超分子的用量可提高去除效果;当当对叔丁基杯[4]芳烃乙酸/沸石的负载比例>0.025/1时,对叔丁基杯[4]芳烃乙酸过量,会造成超分子间彼此黏结成块反而减小当对叔丁基杯[4]芳烃乙酸与铀溶液的接触面积,甚至结块后与沸石脱离浮于液面.因此,对叔丁基杯[4]芳烃乙酸/沸石的负载比例为0.025/1效果最好,以下的实验都是以该负载比进行的.
2.2 吸附反应时间对沸石和负载沸石吸附铀的影响
对叔丁基杯[4]芳烃乙酸/沸石的负载比例为0.025/1,其他实验条件同2.1节.考察不同反应时间下沸石在负载前后对溶液中铀的吸附效果,结果图5、6所示.

图5 反应时间对吸附铀的影响Fig.5 Effects of reaction time on absorption of uranium
从图5可知,在前15min沸石对铀去除率随时间迅速增加,随后铀的去除率增长速度下降,至120min时基本达到平衡,吸附率为29%.负载沸石在初始阶段对铀的去除率迅速增大到70%以上,随反应时间的进行,铀的去除率不断增加至90min基本达到平衡,且吸附率高达90%以上.负载沸石与沸石相比对铀去除率有明显升高,从29%提高到93%,表明沸石负载对叔丁基杯[4]芳烃乙酸后对铀的吸附速率大大增强.同时,30min 至100min时间段内,负载沸石的去除率的增加仍然较大,而沸石对铀的去除率的基本不变,说明此时去除率大幅度增加主要是对叔丁基杯[4]芳烃乙酸作用的结果.

表1 吸附铀的准二级动力学常数Table 1 Kinetic parameters for the adsorption of uranium
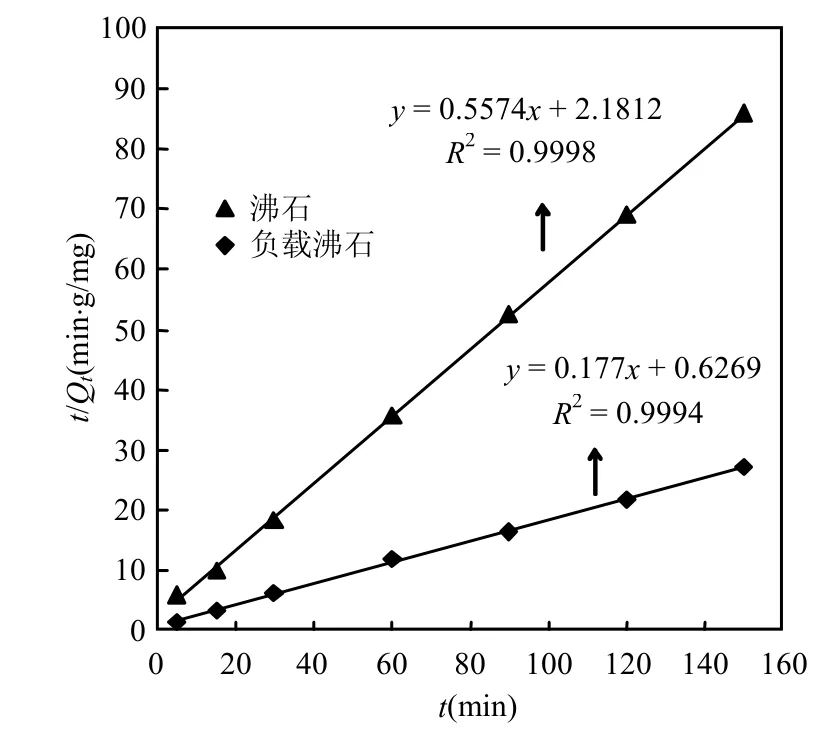
图6 沸石和负载沸石对铀吸附的准二级动力学拟合曲线Fig.6 Pseudo-second-order kinetic profile for the adsorption of uranium onto zeolite and the loaded zeolite
从图6可知,沸石和负载沸石对铀的吸附符合准二级动力学方程(相关系数分别为0.9998和0.9994).而准二级动力学方程[22]:

式中:t为反应时间,min;Kf为二级吸附率常数,g/(min·mg);Qe为在10mg/L 的铀浓度下的平衡吸附容量,mg/g;Qt为t时刻的吸附容量,mg/g.根据2相关方程,y=0.5574x + 2.1812,y=0.177x + 0.6269,和Qt的值,Qe和Kf的值可以被推导出来,见表1.从表1可知,沸石负载了对叔丁基杯[4]芳烃乙酸后,其Qe值由1.7940增大到5.6497mg/g;同时,其Kf值有明显变化说明沸石负载了对叔丁基杯[4]芳烃乙酸后协同吸附体系的动力学特性发生显著改变.
2.3 沸石和负载沸石的用量对去除铀的影响
鉴于2.2节实验显示出反应时间为30min时,铀的吸附已达到较高的水平,因此本节反应时间选为30min,其他实验条件同2.2节,考察沸石和负载沸石的用量对其溶液中的铀的吸附行为,结果见7.
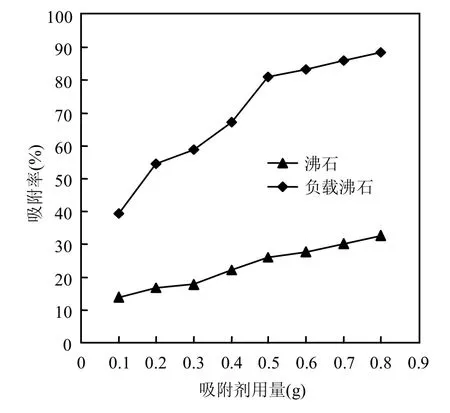
图7 沸石和负载沸石用量对铀吸附的影响Fig.7 Effects of dosage of zeolite and the loaded zeolite on absorption of uranium
从图7可知,随着沸石与负载沸石用量的增加,对溶液中铀的去除率不断增加,但用量超过0.5g后有减缓的趋势,从实际应用方面考虑,用量为0.5g时既能达到较好的处理效率又能达到较高经济效果.同时,负载沸石的吸附率最高可达90%,远远超过为负载的沸石,说明负载对叔丁基杯[4]芳烃乙酸确有利于大大提高沸石的吸附效果.
2.4 吸附等温线
沸石和负载沸石在pH=4下吸附铀的Langmuir吸附等温线.结果见图7、8和表2.
从图8和图9可知,沸石和负载沸石的吸附等温线均符合Langmuir吸附等温方程,说明沸石和负载沸石对铀的吸附为单分子层吸附.而Langmuir吸附等温方程[23]:
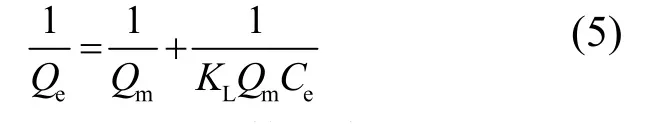
式中:Qe表示在各个浓度下的平衡吸附量,mg/g;Qm表示最大吸附量,mg/g;KL表示Langmuir平衡常数,L/mg;Ce表示在各个浓度下的吸附平衡浓度,mg/L.根据两相关方程,y=0.8066x + 0.0307 和y=1.4905x + 0.0592,Qm和KL可以被推导出来,见表2.同时由表2可知,沸石负载对叔丁基杯[4]芳烃乙酸前后吸附铀的KL明显变化,说明二者的吸附反应的热力学动力规律发生了改变;而沸石负载对叔丁基杯[4]芳烃乙酸后Qm由16.8919增加至32.5733mg/g,说明沸石负载对叔丁基杯[4]芳烃乙酸后,吸附位点的数量明显增加,吸附性能明显增强.
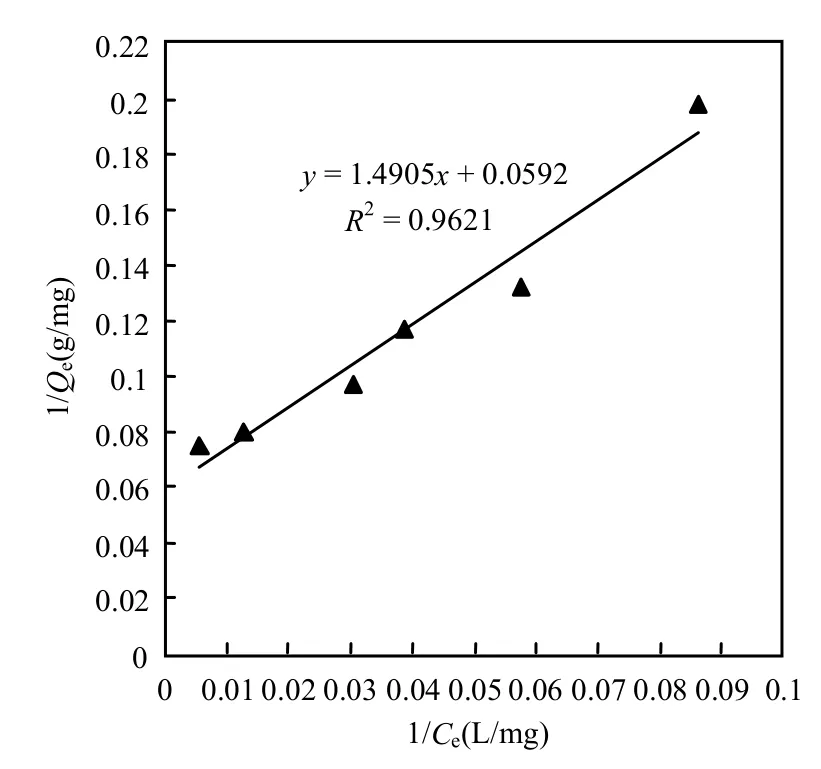
图8 沸石吸附铀的Langmuir吸附等温线Fig.8 Langmuir adsorption isotherm of zeolite on adsorption of uranium

图9 负载沸石对铀的Langmuir吸附等温线Fig.9 Langmuir adsorption isotherm of the loaded zeolite on adsorption of uranium
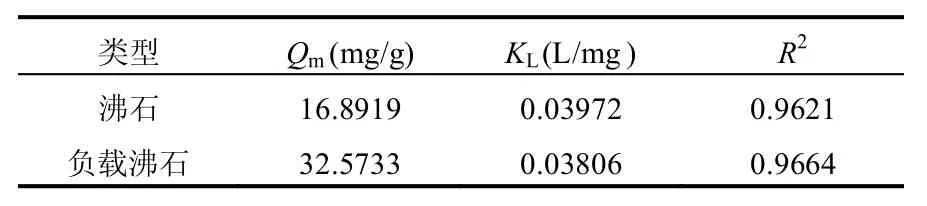
表2 吸附铀的Langmuir热力学常数Table 2 Langmuir parameters for the adsorption ofuranium
2.5 沸石吸附铀前后的红外光谱分析
从图10可知,在450~800cm-1间有5个峰,它们分别是450、696和799cm-1处SiO2的吸收峰,618和746cm-1处为Al2O3的吸收峰;1000~1100cm-1间有1个宽吸收峰是Al2O3的吸收峰.这些吸收峰在沸石吸附铀后皆有所减弱,说明沸石对铀的吸附与离子交换主要依靠Si—O和Al—O的吸附作用.从图11可知,对叔丁基杯[4]芳烃乙酸在吸附铀之后,在1735、1200、1236、1391和721cm-1处羧酸结构的特征峰都有所减弱,说明对叔丁基杯[4]芳烃乙酸通过其乙酸根与铀的络合作用去除铀.综合图10、11可知,负载对叔丁基杯[4]芳烃乙酸后的沸石对铀的去除了依靠Si—O和Al—O的吸附作用,还利用其对叔丁基杯[4]芳烃乙酸与铀的强络合作用,两种作用的协同加快了吸附速率,增加了吸附容量.
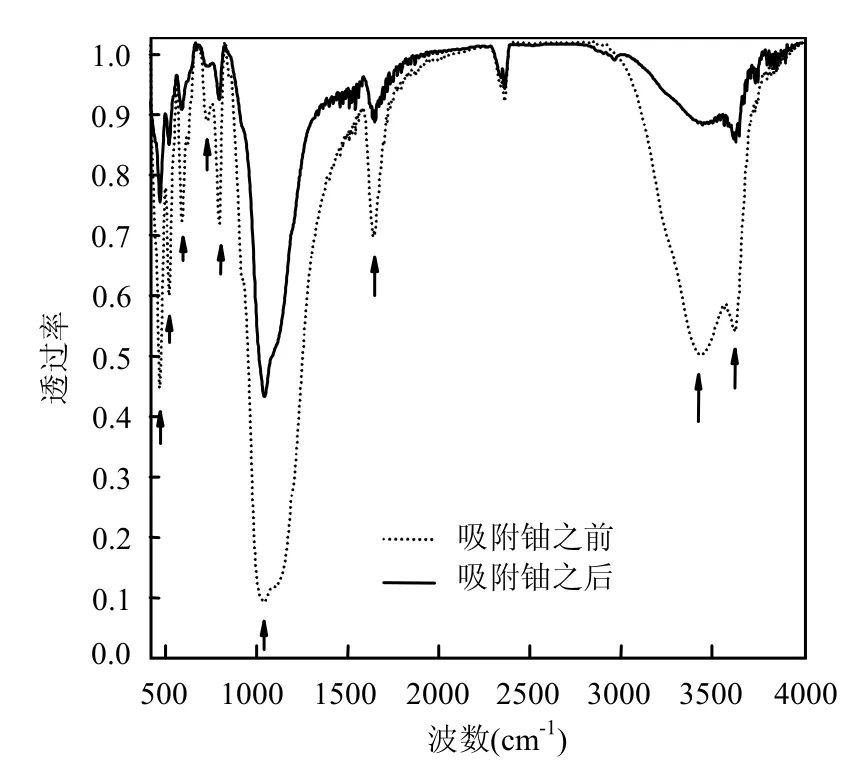
图10 沸石吸附铀前后的红外图谱Fig.10 IR of zeolite before and after absorption of uranium
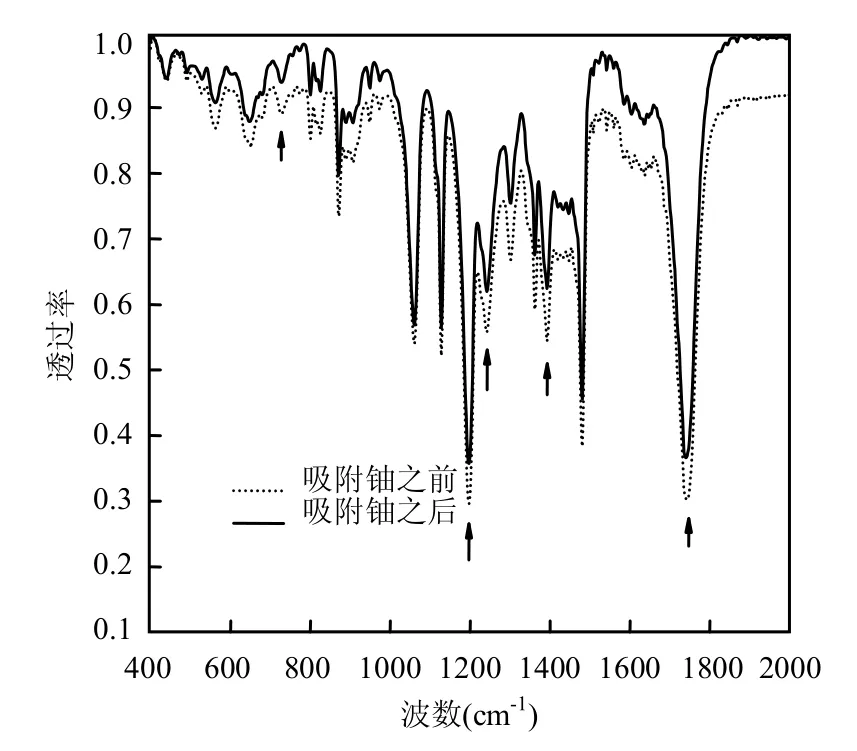
图11 对叔丁基杯[4]芳烃乙酸吸附铀前后的红外图谱Fig.11 IR of p-calix[4]arena acetate before and after absorption of uranium
3 结论
3.1 在溶液的pH值为4的条件下,沸石对UO22+的吸附率为29%.沸石负载对叔丁基杯[4]芳烃乙酸后,其对铀的效果大大增强,吸附率提高到92%.
3.2 沸石及负载沸石对UO22+的吸附都遵循Langmuir吸附等温线,表明都为单层吸附,但负载沸石的最大吸附量相对于负载前大大升高,说明沸石负载对叔丁基杯[4]芳烃乙酸后,吸附点位明显增加.沸石和负载沸石对UO22+的吸附动力学行为均符合准二级动力学方程,负载沸石比负载前的吸附速率显著提高.
3.3 沸石在负载对叔丁基杯[4]芳烃乙酸后,其对溶液中的铀吸附效果显著提高,沸石和对叔丁基杯[4]芳烃乙酸的结合具有良好的协同吸附作用,表明这类超分子材料对含铀废水处理的巨大潜力.
[1]夏良树,张晓峰,黄 欣.凹凸棒石与硫酸亚铁协同吸附铀[J].原子能科学技术,2013,47(11):1944-1950.
[2]周书葵,曾光明,刘迎九,等.改性羧甲基纤维素对铀吸附机理的试验研究[J].中国环境科学,2011,31(9):1466-1471.
[3]岳玉美,宋 刚,张志强,等.广州市北部土壤天然放射性水平研究[J].中国环境科学,2011,31(4):657-661.
[4]冯颖思,宋 刚,祝秋萍,等.某铀矿下游水系沉积物剖面的放射性核素分布特征[J].中国环境科学,2013,33(8):442-1446.
[5]王卫星,杨亚新,王雷明.广东下庄铀矿田土壤的天然放射性研究[J].中国环境科学,2005,25(1):120-123.
[6]Li X L,Ding C C,Liao J L,et al.Biosorption of uranium on Bacillus sp.dwc-2: preliminary investigation on mechanism[J].Environ.Radioact.,2014,135:6-12.
[7]Kundrat O,Kas M,Tkadlecova M,et al.Thiacalix[4]areneporphyrin conjugates with high selectivity towards fullerene C70[J].Tetrahedron Letters,2007,48:6620-6623.
[8]王 月,熊振湖,周建国.杯[4]芳烃修饰Amberlite XAD-4树脂去除水中双氯芬酸[J].中国环境科学,2012,32(1):81-88.
[9]赵邦屯,张衡益,刘 育.基于杯芳烃主体的分子自组装研究进展[J].有机化学,2005,25(9):913-925.
[10]Sayin S,Ozcan F,Yilmaz M,et al.Synthsis of calyx[4]arene bearing pyridinium units supported silica gel for sorption of arsenate and dichromate anions[J].Desakination,2010,262:99-105.
[11]Stankovic V,Outarra L,Zonnevijlle F,et al.Solvent extraction of silver from nitric acid solutions by calyx[4]arene amide derivatives[J].Separation and Purification Technology,2008,61(3):366-374.
[12]Wang Z L,Ding H J,Yang Y X,et al.Preparation of calixarene grafting ultrafine silica and study on their txtraction ability for Cu2+and Ag+[J].Chinese J.Inorganic.Chem.,2011,27(6):1033-1040.
[13]羊衍秋,罗顺忠,杨通在,等.杯芳烃衍生物萃取剂分离An(Ⅲ)/Ln(Ⅲ)[J].化学进展,2001,23(7):1345-1354.
[14]Luo J H,Li J,Zhong B,et al.Research on the extraction of Mg2+from ammonium dihydrogen phosphate solution with p-tert-butylcalix[4]arene [J].Journal of Chemical Engineering of Chinese Universities,2009,2(23):205-209.
[15]张新艳,王起超,张少庆,等.天然和巯基改性沸石吸附水溶液中重金属Hg2+的特征研究[J].环境工程学报,2009,3(3):455-460.
[16]彭晓丽,张蔚霞,徐 芳.磁性Fe304/Beta沸石复合材料制备及其水体磷污染物吸附行为研究[J].化学世界,2013,3:145-151.
[17]周 明,张宝泉,刘秀凤.沸石分子筛的表面定向生长与组装[J].科学通报,2008,53(3):257-270.
[18]王春峰,李健生,王连军.粉煤灰合成NaA型沸石对重金属离子的吸附动力学[J].中国环境科学,2009,29(1):36-41.
[19]Hrenovic J,Rozic M,Sekovanic L,et al.Interaction of surfactant-modified zeolites and phosphate accumulating bacteria[J].Journal of Hazardous Materials,2008,156(1-3):576-582.
[20]杜慧芳,林默颖,张安有.对叔丁基杯[4]芳烃乙酸对铀(Ⅵ)的萃取研究[J].核技术,1999,22(1):32-36.
[21]张 燮.工业分析化学[M].北京:化学工业出版社,2002.
[22]Haloi N,Sarma H P,Chakravarty P.Biosorption of lead(II)from water using heartwood charcoal of Areca catechu: equilibrium and kinetics studies[J].J.Appl.Water Sci,2013,3:559-565.
[23]Khani M H,Keshtkar A R,Ghannadi M,et al.Equilibrium kinetic and thermodynamic study of the biosorption of uranium onto cystoseria indica algae[J].J.Hazardous Materials,2008,150:612-618.
Adsorption behavior of uranium by zeolite loaded with p-calix[4]arene acetate.
ZHANG Xiao-feng1,2,CHEN Di-yun1,2*,PENG Yan1,2,MO Yang-zhi1,HAO Jiao1(1.School of Environmental Science and Engineering,Guangzhou University,Guangzhou 510006,China;2.Guangdong Province Key Laboratory of Radioactive Pollution Control and Resource,Guangzhou 510006,China).China Environmental Science,2015,35(6):1686~1692
P-calix[4]arene acetate was synthetized by the main reaction substrates,p-tert-butyl-calix[4]arene and ethylbromoacetate,subsequently loaded onto zeolite.Infrared spectra demonstrated that the synthetized compound had the structure characteristics of p-calix[4]arene acetate;Scanning electron microscope analysis indicated that p-calix[4]arene acetate was loaded on zeolite successfully,evenly and dispersedly.By the static experiments,the results showed that when the pH=4,absorbent dosage was 0.5g,initial uranium concentration was 10mg/L,p-calix[4]arene acetate/zeolite=0.025/1,and the reaction time was 30min,the adsorption efficiency of zeolite increased from about 30%to 93%after loadeding p-calix[4]arene acetate.Besides,the adsorption reactions of uranium by zeolite and zeolite loaded with p-calix[4]arene acetate(Referred to as the loaded zeolite)could be both described by pseudo-second-order kinetic model,while the absorption rate of loaded zeolite was faster than that of zeolite.Moreover,both of the 2 absorption reactions followed the Langmuir adsorption isotherm,whereas the maximum adsorption amount inferred by Langmuir model ascended from 16.8919 to 32.5733mg/g,which was due to fact that zeolite had increased the absorption sites on its surface after loading p-calix[4]arene acetate.In addition,infrared spectra analyses before and after adsorbing uranium demonstrated that the loaded zeolite mainly depended on the strong complexion of p-calix[4]arene acetate and the sorption of Si-O and Al-O to remove uranium,and these 2kinds of functions affected synergistically to speed up the rate of adsorption and increase adsorption amount.
p-calix[4]arene acetate;load;zeolite;uranium;synergistic adsorption
X703
A
1000-6923(2015)06-1686-07
张晓峰(1987-),男,湖南益阳人,广州大学硕士研究生,主要从事放射性污染控制与防治研究.发表论文4篇.
2014-10-26
国家自然科学基金项目(41372364);羊城学者首席科学家项目(12A007S);广东省放射性核素污染控制与资源化重点实验室建设项目(2012A061400023)
* 责任作者,教授,cdy@gzhu.edu.cn
