新鲜冰冻血浆对脑损伤合并失血性休克大鼠的治疗作用
2015-11-18范超勇李东朋郭德伟田毅姚宁齐伟杨波
范超勇 李东朋 郭德伟 田毅 姚宁 齐伟 杨波
(1.郑州大学第一附属医院 神经外科 河南 郑州 450052;2.郑州大学 生命科学学院 河南 郑州 450051)
创伤性脑损伤(traumatic brain injury,TBI)合并失血性休克(hemorrhagic shock,HS)病情较严重、死亡率高[1],早期液体复苏对于挽救患者生命尤为重要。目前常用的输注大量晶体液复苏易引起细胞外水肿、酸中毒[2]。有研究发现,普通胶体液会引起凝血机制障碍,对脑组织的保护作用不明显[3-4]。Hwabejire 等[5]采用新鲜冰冻血浆(fresh frozen plasma,FFP)复苏TBI合并HS 猪模型,发现FFP 通过改善脑灌注,减少谷氨酸盐介导的神经毒性从而发挥脑保护作用。但FFP作为复苏液体,对TBI 合并HS 的治疗作用尚不明确。本研究通过采用FFP 给予TBI 合并HS 大鼠早期复苏,观察其对大鼠脑水肿、血脑屏障、神经功能、神经细胞生存状况的影响。
1 材料与方法
1.1 一般资料 133 只健康雌性SD 大鼠,体质量240~280 g,购自河南省实验动物中心,合格证号:SCXK(豫)2010-0002。25 只采用Aghaloo 法制备新鲜冰冻血浆,余108 只随机分为3 组:sham(假手术组)组(18 只),vehicle(生理盐水复苏组)组与FFP(新鲜冰冻血浆复苏组)组(各45 只)。10%水合氯醛与4%多聚甲醛(天津登科),0.5%伊文氏蓝染液(LEAGENE,DK0001)与尼氏染色液(碧云天,C0117),大鼠脑立体定位仪,低温离心机(Eppendorf AG22331Hamburg)、多通道生理信号记录仪(成都泰盟BL-420E +)、美国哈希DR3900 分光光度计。
1.2 新鲜冰冻血浆的制备及检测 SD 大鼠用10%水合氯醛腹腔麻醉(4 ml/kg),无菌条件下每只大鼠心室内采血10.0 ml,加10%枸橼酸钠抗凝,低温离心机中3 838 ×g 离心15 min 后分离血浆,-80 ℃冰箱迅速冰冻为FFP,用时37 ℃水浴箱摇床融化。
1.3 动物模型制作及分组干预 SD 大鼠麻醉后Feeney 改良法[6]制作颅脑损伤模型,用一重20 g 砝码自40 cm 高处自由落下。术毕参照Wiggers 改良法[7]制作失血性休克大鼠模型。sham 组仅打开骨窗;vehicle、FFP 组制作创伤性脑损伤和失血性休克模型,休克期间维持MAP 于40 mm Hg 水平,持续60 min 后vehicle 组给予3 倍失血量的生理盐水,FFP 组给予等于放血量的新鲜冰冻血浆,均30 min 输注完毕,持续监测MAP、HR 至苏醒。
1.4 大鼠神经运动功能评价 采用mNSS 对大鼠的神经功能行为进行评定。对各组大鼠在损伤前及复苏后1、3、7 d 进行神经功能测定,分值越高,损伤越重。
1.5 脑水肿水平评估及血脑屏障通透性检测 实验各组术后1、3、7 d 麻醉处死,干湿重法测量脑组织含水量;各组术后2、6、12、24、72 h 麻醉处死,溴化乙锭(EB)染色法定性定量检测血脑屏障完整性。分光光度计检测样品光密度值。四参数法制作标准曲线,计算各样本EB 含量(μg/g)。
1.6 取材尼氏染色 伤后7 d 生理盐水和4%多聚甲醛心脏灌注取脑,脱水后石蜡包埋,冠状位石蜡切片,片厚4 μm,甲苯胺蓝染色法染色。于显微镜下观察DG 区、CA1 区、CA3 区细胞变化并对染色细胞进行计数,采用Imaging-Pro-Plus (LEIKADMLB)软件对切片进行定量分析。
1.7 统计学处理 采用SPSS 17.0 统计学软件对数据进行统计学分析。实验数据采用均数±标准差(±s)表示,多组数据间比较采用单因素方差分析,两组间比较采用LSD 法,P <0.05 为差异具有统计学意义。
2 结果
2.1 新鲜冰冻血浆理化检测情况 外观黄色澄清液体,无色泽异常,无蛋白析出、重度乳糜,血浆蛋白含量≥50 g/L,Ⅷ因子≥0.7 IU/ml,无细菌污染。
2.2 脑水肿程度及血脑屏障通透性的检测 1、3、7 d时vehicle 组与FFP 组较sham 组脑组织含水量明显升高(P <0.05),1、3、7 d 时FFP 组脑水肿程度均高于vehicle 组(P <0.05)(图1)。EB 染色法测定脑组织EB 含量,2、6、12、24、72 h 时vehicle 组与FFP 组血脑屏障通透性较sham 组显著增加(P <0.05);2 h 及6 h时vehicle 组与FFP 组EB 含量差异无统计学意义(P >0.05);12、24、72 h 时各组EB 含量差异有统计学意义(P <0.05),且12、24、72 h 时FFP 组与vehicle 组EB 含量差异有统计学意义(P <0.05)(图2)。

图1 各组1、3、7 d 时脑组织含水量的变化
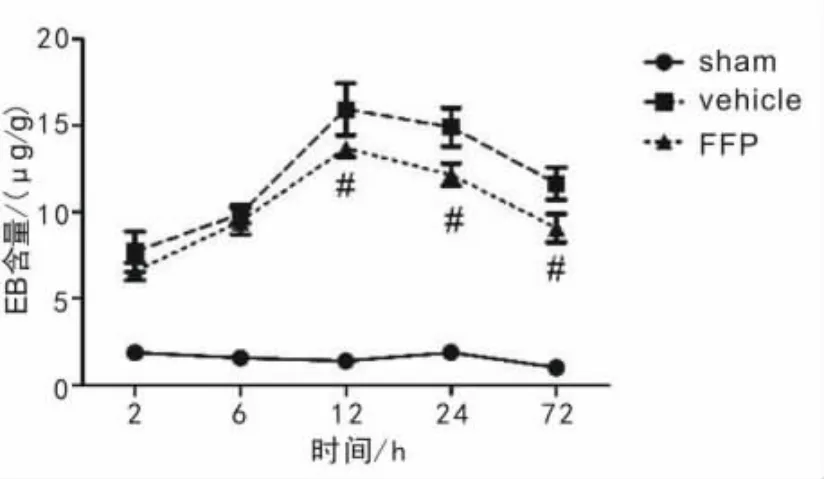
图2 各组2、6、12、24、72 h 时脑组织EB 含量变化
2.3 mNSS 神经功能评分结果 mNSS 评分越高说明大鼠的神经功能障碍越严重,越低说明损伤越轻。FFP 组与vehicle 组在1 d 时mNSS 神经功能评分显著增高,3 d 后下降。3、7 d 时FFP 组评分均低于vehicle组(P <0.05)(图3)。
2.4 DG 区、CA1 区、CA3 区神经元细胞生存情况sham 组Nissl 染色可见DG 区、CA1 区、CA3 区较多排列紧密锥体细胞,细胞形态结构完整、染色质均匀分布,胞浆内含大量的尼氏小体。与sham 组相比,vehicle 组及FFP 组各区神经元大量脱失、排列疏松,轮廓模糊、界限不清,差异有统计学意义(P <0.05);vehicle 组与FFP 组相比,神经元数目更少,排列更加疏松,差异有统计学意义(P <0.05)(表1)。
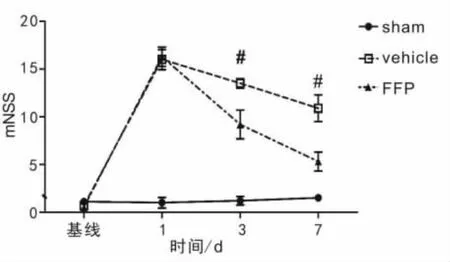
图3 各实验组在1、3、7 d 时mNSS 神经功能评分情况
表1 FFP 对脑损伤大鼠皮质及海马区域神经元存活的影响(±s)

表1 FFP 对脑损伤大鼠皮质及海马区域神经元存活的影响(±s)
注:与sham 组比较,aP <0.05;与vehicle 组比较,bP <0.05。
组别 DG 区 CA1 区 CA3区sham 组2 585±142 1 931±134 1 786±86 vehicle 组 1 362±111a 1 090±210a 951±63a FFP 组 1 933±158ab 1 522±179ab 1 255±97 ab
3 讨论
脑损伤合并失血性休克将加剧创伤患者的总体死亡率和致残率[8]。有效的液体复苏可以恢复并保持全身和脑循环,支持组织灌注和氧输送,并减少诱发低血压和脑缺氧长期神经损伤[9]。目前,临床上常用的复苏液体主要有晶体液和胶体液,晶体液包括生理盐水、乳酸林格氏液及高渗盐液等;胶体液主要分为人工胶体(白蛋白)和天然胶体(右旋糖酐、明胶、羟乙基淀粉)。最近的研究指出,在重大创伤休克患者的救治过程中,晶体液应尽量减少应用,因为大量的晶体复苏与炎症反应和组织水肿、肿胀相关,主张选用血液制品,如浓缩红细胞(PRBC)和FFP 的控制复苏[10-11]。给予HS 患者大量生理盐水输注虽能够暂时性维持血压,但快速扩容造成自身血管内细胞及血浆成分稀释,晶体液快速渗透到组织间隙,损伤血管内皮细胞并引起组织间隙水肿,导致二次损伤[8],对生理盐水与白蛋白休克复苏进行比较,表明采用生理盐水复苏的死亡率更高[12]。一些研究表明,胶体复苏可以维持和增加血浆胶体渗透压,减少血管内流体外渗进入脑间质,减轻脑肿胀,改善脑功能[13-14]。但有研究采用白蛋白进行复苏,患者死亡率增加,可能原因是胶体液穿透破坏的血脑屏障,到达损伤区域,降解产物的形成促进组织水肿,加重脑损伤[5]。
创伤性脑损伤(traumatic brain injury,TBI)在不可逆性原发性损伤之后,海马神经元进行性死亡是颅脑外伤后的重要病理特征。研究证实TBI 后海马CA1、CA3 和齿状回等部位神经细胞丢失,突触传递功能的改变是造成认知记忆障碍的原因。有学者发现,采用FFP 液体复苏可以增加血浆及脑组织血小板活性,改善脑血流灌注,减少谷氨酸介导的兴奋毒性继发性脑损伤,降低线粒体功能障碍,从而发挥神经保护作用[14]。因此,改善脑外伤后脑组织灌注、减轻脑水肿、改善血脑屏障通透性可以保护神经细胞,促进神经功能的恢复。
本实验结果证明,脑损伤合并失血性休克发生后应用新鲜冰冻血浆复苏较普通晶体液可有效减轻大鼠脑组织的水肿,改善血脑屏障的通透性。应用FFP 复苏组大鼠的神经功能改善情况优于生理盐水复苏组,并且DG 区、CA1 区、CA3 区神经元数量、形态结构较生理盐水复苏组有明显改善。
综上所述,对脑损伤合并失血性休克大鼠,新鲜冰冻血浆有减轻脑水肿、降低血脑屏障通透性、改善神经功能作用,为临床救治此类重大创伤患者提供了一个新的思路,具体机制有待进一步探讨。
[1] Kauvar D S,Lefering R,Wade C E.Impact of hemorrhage on trauma outcome:an overview of epidemiology,clinical presentations,and therapeutic considerations[J].J Trauma,2006,60(6 Suppl):S3-S11.
[2] Martini W Z.Coagulopathy by hypothermia and acidosis:mechanisms of thrombin generation and fibrinogen availability[J].J Trauma,2009,67(1):202-209.
[3] Alam H B,Bice L M,Butt M U,et al.Testing of blood products in a polytrauma model:results of a multi-institutional randomized preclinical trial[J].J Trauma,2009,67(4):856-864.
[4] Ertmer C,Kampmeier T,Rehberg S,et al.Fluid resuscitation in multiple trauma patients[J].Curr Opin Anaesthesiol,2011,24(2):202-208.
[5] Hwabejire J O,Imam A M,Jin G,et al.Differential effects of fresh frozen plasma and normal saline on secondary brain damage in a large animal model of polytrauma,hemorrhage and traumatic brain injury[J].J Trauma Acute Care Surg,2013,75(6):968-975.
[6] 张荣军,游潮,蔡博文,等.Feeney 法建立大鼠闭合性脑损伤模型及评估[J].中国修复重建外科杂志,2005,19(12):1015-1018.
[7] 周俊,姚尚龙,杨承祥,等.6%羟乙基淀粉130/0.4 液体复苏对创伤性脑损伤合并失血性休克大鼠的脑保护作用[J].中华麻醉学杂志,2009,29(19):1030-1033.
[8] Dekker S E,Sillesen M,Bambakidis T,et al.Treatment with a histone deacetylase inhibitor,valproic acid,is associated with increased platelet activation in a large animal model of traumatic brain injury and hemorrhagic shock[J].J Surg Res,2014,190(1):312-318.
[9] Baker A J,Park E,Hare G M,et al.Effects of resuscitation fluid on neurologic physiology after cerebral trauma and hemorrhage[J].J Trauma,2008,64(2):348-357.
[10] Joseph B,Zangbar B,Pandit V,et al.The conjoint effect of reduced crystalloid administration and decreased damage- control laparotomy use in the development of abdominal compartment syndrome[J].J Trauma Acute Care Surg,2014,76(2):457-461.
[11] Campion E M,Pritts T A,Dorlac W C,et al.Implementation of a military-derived damage control resuscitation strategy in a civilian trauma center decreases acute hypoxia in massively transfused patients[J].J Trauma Acute Care Surg,2013,75(2 Suppl 2):S221-S227.
[12] Myburgh J,Cooper D J,Finfer S,et al.Saline or albumin for fluid resuscitation in patients with traumatic brain injury[J].N Engl J Med,2007,357:874-884.
[13] King D R,Cohn S M,Proctor K G.Changes in intracranial pressure,coagulation,and neurologic outcome after resuscitation from experimental traumatic brain injury with hetastarch[J].Surgery,2004,136:355-363.
[14] Jin G,Duggan M,Knightly T,et al.Traumatic brain injury and hemorrhagic shock:evaluation of different resuscitation strategies in a large animal model of combined insults[J].Shock,2012,38(1):49-56.
