HHMHC对Cu2+、Ni2+的萃取性能
2015-11-18王劲松方丰荣谢水波蔡萍莉南华大学城市建设学院湖南衡阳41001南华大学污染控制与资源化技术湖南省高校重点实验室湖南衡阳41001
周 洁,王劲松*,李 霞,方丰荣,谢水波,蔡萍莉(1.南华大学城市建设学院,湖南 衡阳 41001;.南华大学,污染控制与资源化技术湖南省高校重点实验室,湖南 衡阳 41001)
HHMHC对Cu2+、Ni2+的萃取性能
周 洁1,2,王劲松1,2*,李 霞1,2,方丰荣2,谢水波2,蔡萍莉1,2(1.南华大学城市建设学院,湖南 衡阳 421001;2.南华大学,污染控制与资源化技术湖南省高校重点实验室,湖南 衡阳 421001)
以对羟基苯甲酸为原料,通过化学修饰合成得到上沿羧基化的杯[6]芳烃羟肟衍生物,即5,11,17,23,29,35-六羧基-37,38,39,40,41,42-六羟肟酸甲氧基杯[6]芳烃(HHMHC),采用IR对其结构性能进行表征,并探讨了溶液初始pH值、初始重金属离子(Cu2+、Ni2+)浓度、萃取时间、温度等因素对HHMHC萃取重金属离子的影响.结果表明,在温度为30℃时HHMHC萃取Ni2+和Cu2+的最佳pH值分别为5.0、6.0,萃取平衡时间均为30min.用准二级动力学模型(R2>0.99)和Freundlich等温模型(R2>0.999)均可较好的拟合其萃取过程,通过计算萃取过程的热力学参数,得到Gibbs自由能(ΔG0)和焓变(ΔH0)均小于0,表明萃取反应是一个自发的放热反应.通过红外光谱图分析和考察溶液pH值对萃取分配比的影响,探讨HHMHC萃取Cu2+、Ni2+的机理,结果表明此萃取过程除了存在阳离子交换机理外,还存在与冠醚萃取相同的离子配位萃取,参与配位作用的主要是羟肟基团(-CONHOH).
5,11,17,23,29,35-六羧基-37,38,39,40,41,42-六羟肟酸甲氧基杯[6]芳烃(HHMHC);萃取;重金属离子;机理
随着工业的发展,矿山开采、机械加工、钢铁及有色金属冶炼和化工企业等排放的重金属工业废水量也越来越大[1],而重金属毒性大、在环境中不易降解、且容易被生物富集,产生生物放大效应,这不仅会对生态环境造成极大破坏,同时也对人类的生产和生活构成了极大的威胁[2].
溶剂萃取具有适应性强、选择性高和分离效果好等优点,萃取可在常温或较低温度下进行,相比其他方法,萃取法能耗低,处理能力大,在工业废水处理、有价金属分离和提纯等方面具有一定的优势.有报道认为,溶液萃取方法是较为适宜的永久去除重金属的技术之一[3-5],因此发展适宜的螯合剂萃取技术就迫在眉睫[6].杯芳烃作为继冠醚和环糊精之后的第3代大环超分子主体化合物,其空腔大小可调,拥有多个活泼的酚羟基和易发生亲电取代的苯环.随着杯芳烃化学研究的深入,设计合成出具有特定官能团结构的杯芳烃衍生物,并进一步研究其特定识别性能是当前超分子化学研究的热点之一,特别是对重金属离子进行高度配位和有效识别的化合物备受关注[7-10].为此,本研究通过在5,11,17,23,29,35-六羧基-37,38,39,40,41,42-六羟基杯[6]芳烃(HHHC)的酚羟基上衍生羟肟基团羟肟合成HHMHC,通过IR表征分析揭示化合物结构,考察不同pH值、初始重金属离子浓度、萃取时间,温度下HHMHC对重金属离子(Ni2+、Cu2+)的萃取效果,揭示杯芳烃分子中衍生的羧基和羟肟基团对重金属离子的萃取的机理,为开发适用于重金属离子选择性分离的萃取剂提供新的方法.
1 材料与方法
1.1 主要试剂与仪器
主要试剂:对羟基苯甲酸、浓盐酸、甲醛、邻二甲苯、丙酮、石油醚、溴乙酸乙酯、无水乙醇、甲苯、无水碳酸钾、盐酸羟胺、二氯甲烷、氯仿、甲醇、氨水、硝酸铜、硝酸镍、氢氧化钾等均为分析纯.
主要仪器:傅里叶变换红外光谱仪(Nicolet 380,美国);原子的收分光光度计,AA6300,苏州普今生物科技有限公司;定时电动搅拌器,JJ-1,江苏省金坛市正基仪器有限公司;真空冷冻干燥箱,Fd-1a-50,上海比朗仪器有限公司;电热鼓风干燥箱,DF205,北京科委永兴一起有限公司;酸度计(pHS-3C,上海雷磁);JJ-1型定时电动搅拌器,HZP-C空气浴振荡器等.
1.2 化合物的合成
1.2.1 HHHC的合成 参考文献[11],称取69g(0.5mol)对羟基苯甲酸到1000mL圆底烧瓶中,再取276mL(0.1mol)甲醛、100mL(37%)浓盐酸和100mL邻二甲苯至烧瓶中,装上迪安斯塔克装置,加热至70℃,回流8h,趁热过滤,用热蒸馏水洗涤固体除去酸性杂质的干扰,经丙酮-石油醚在60~80℃下结晶、重结晶得到HHHC.
1.2.2 HHMHC的合成 在参考文献[12-14]基础上,课题组开发了HHMHC的制备新方法[15-17].图1、图2分别为HHMHC的合成示意和结构示意.
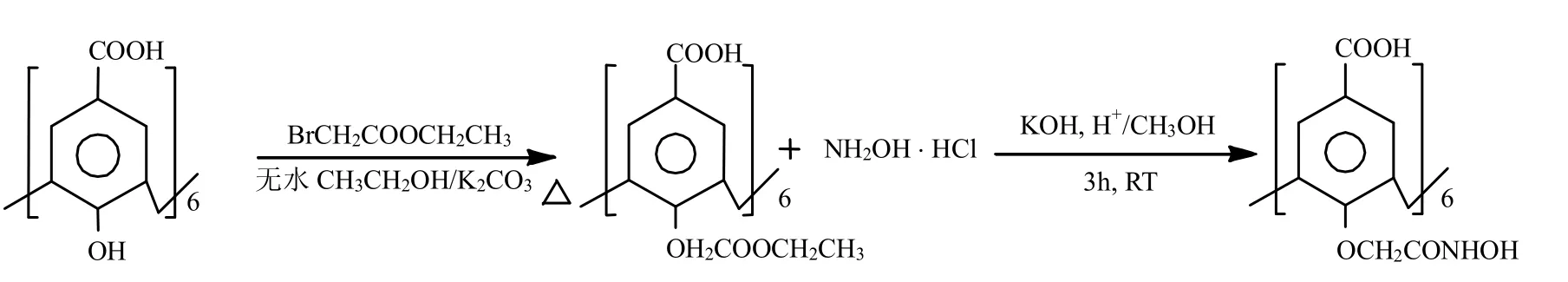
图1 HHMHC的合成示意Fig.1 Schematic diagram of the synthesis of HHMHC

图2 HHMHC的结构Fig.2 Structure of HHMHC
1.3 萃取实验
以HHMHC的氯仿溶液为重金属离子的萃取剂,配成2×10-4mol/L的标准溶液,用二次蒸馏水配置5mg/L的重金属离子(Ni2+、Cu2+)溶液.用移液管各取20mL配体的氯仿溶液和重金属离子水溶液混合于50mL的锥形瓶中.以220r/min的速度在恒温摇床中振荡,静置,待分层后,取出一定体积的水相,用原子吸收法测定重金属离子的剩余浓度,根据萃取前后溶液中重金属离子的浓度,计算萃取剂对重金属离子的萃取效果(E),试验重复3次,取平均值计算剩余重金属离子的浓度.计算式如下:

式中:E为重金属离子的萃取率,%;C0为重金属离子的初始浓度,mg/L;C为水相中重金属离子的剩余浓度,mg/L.
2 实验结果与讨论
2.1 IR分析
HHHC、5,11,17,23,29,35-六羧基-37,38,39,40,41,42-六乙酯基甲氧基杯[6]芳烃(HHMEC)及HHMHC的红外光谱如图3所示.从图3可以看出,HHHC红外谱图3442.94cm-1为酚上的-OH伸缩振动峰;1678.07cm-1为羧基的C=O伸缩振动峰;1606.70cm-1、1595.13cm-1和1510.26cm-1处为芳环的骨架振动峰;1400.32cm-1为羧基上的-OH的振动峰;2850.25cm-1为亚甲基CH2的振动峰.由此可知,该物质具备HHHC的基本官能团,与文献[11]报道一致.

图3 化合物HHHC,HHMEC,HHMHC的红外光谱Fig.3 The IR spectra of HHHC,HHMEC and HHMHC
与HHHC相比,HHMEC在3442.94cm-1附近的峰消失,说明酚羟基已被其他基团取代,HHMEC的红外谱图中化合物在1278.81cm-1处出现了一个新峰,即为芳香族酯基C-O-C形成的酯基的振动吸收峰,说明取代酚羟基的为酯基;HHMHC的红外谱图中在对应1678.07cm-1出现了一个新的振动吸收峰,通过参照红外图谱可知此吸收峰为肟(C=N)的吸收峰,其他基本官能团(亚甲基、苯环、羧基上的-OH、C=O的吸收峰)都存在,说明它是图2所示的结构,即是需要的目标产物.
2.2 pH值的影响
在温度为30℃,HHMHC的初始浓度为2× 10-4mol/L,Ni2+、Cu2+的初始浓度为5mg/L,萃取时间为30min的条件下,探讨溶液初始pH值在2.0~8.0时HHMHC萃取Ni2+、Cu2+的影响,结果如图4所示.
由图4可知,当pH2.0~5.0时,随着溶液pH值的升高,对Ni2+的萃取率迅速增大,而当pH2.0~6.0时,随着溶液pH值的升高,对Cu2+的萃取率迅速增大.因为溶液pH值过低时,大量存在的H3O+和H+与金属离子发生竞争,同时大量存在的H+会使HHMHC中的羟肟基团质子化,增加羟肟基团对金属阳离子的静电斥力,因而萃取率较低;随着pH值的升高,大量的羟肟基团逐渐暴露,这种基团上的氢键容易丢失,表现出电负性,增强了官能团与金属阳离子之间的结合能力和反应机率,萃取率增大.在pH=5时,Ni2+的萃取率最高,在pH=6时,Cu2+的萃取率最高;当Ni2+的pH在5.0~8.0,Cu2+的pH值在6.0~8.0时,HHMHC对金属离子的萃取率反而下降,这是由于溶液中的金属离子发生水解,形成复杂的水解产物,不利于HHMHC对金属离子的萃取作用.因此本试验条件下HHMHC萃取Ni2+的最佳pH值是5.0,萃取Cu2+的最佳pH值是6.0.

图4 pH值对HHMHC萃取重金属离子的影响Fig.4 Effect of pH on the extraction of heavy metal ions with HHMHC
2.3 萃取动力学分析
在温度为30℃,Cu2+溶液pH6.0,Ni2+溶液pH5.0,Ni2+、Cu2+的初始浓度均为5mg/L,HHMHC的初始浓度2×10-4mol/L的条件下探讨萃取时间对HHMHC萃取Ni2+、Cu2+效果的影响,试验结果如图5所示.

图5 反应时间对HHMHC萃取重金属离子的影响Fig.5 Effect of reaction time on the extraction of heavy metal ions with HHMHC
结果表明,HHMHC对Ni2+、Cu2+的萃取可分为快速萃取(0~15min)、慢速萃取(15~30min)、萃取平衡(30~90min)3个阶段.在5~15min时,HHMHC对Ni2+、Cu2+的萃取率分别从60.83%、54.14%增长到90.90%、88.72%,随着萃取时间的延长,在萃取时间为15~30min时,其萃取率增加幅度明显减少,萃取曲线逐渐平缓,大约在30min后萃取都基本趋于平衡,因此,本试验最佳萃取时间选为30min.这可能是因为HHMHC中的羟肟官能团刚接触到金属离子时,结合位点多,速率快.随着萃取时间的延长,HHMHC官能团上的结合位点接近饱和[18-19].为了进一步研究HHMHC对重金属离子的萃取量与时间关系,采用准一级动力学模型和准二级动力学模型方程对实验数据进行拟合.由表1可知准二级动力学方程比准一级动力学方程的相关性更高,因此HHMHC对重金属离子的萃取过程符合二级动力学方程[20].
2.4 萃取热力学分析
在温度为30℃,在Cu2+溶液pH6.0,Ni2+溶液pH5.0,萃取时间为30min,HHMHC的初始浓度为2×10-4mol/L的条件下,Ni2+、Cu2+初始浓度对萃取效果的影响结果如图6所示.从图6可以看出,在重金属初始质量浓度小于5mg/L时,Cu2+去除率在92%以上,Ni2+去除率在93%以上,说明HHMHC对低浓度Ni2+、Cu2+废水具有较强的萃取作用.随着Ni2+、Cu2+浓度(2.5~80mg/L)的升高,HHMHC对Ni2+、Cu2+的萃取量增大,但萃取率却下降.这是因为Ni2+、Cu2+初始浓度较高时,浓度梯度较大,产生了较强的驱动力,促进Ni2+、Cu2+向萃取剂表面和内部扩散,从而使萃取容量增大;而萃取率降低是因为单位质量的萃取剂的配位点是有限的[21].因此,在实际Ni2+、Cu2+废水处理中,HHMHC可用于处理低浓度Ni2+、Cu2+废水.

图6 Ni2+、Cu2+初始浓度对萃取效果的影响Fig.6 Effect of initial concentration of Ni2+、Cu2+on the extraction of heavy metal ions with HHMHC
从表2中的相关系数可以看出,Freundlich方程拟合的更好,表明HHMHC对Ni2+、Cu2+的萃取为多层萃取;Freundlich方程中的特征常数n表示HHMHC与金属离子的亲和力.Ni2+、Cu2+的n分别为1.022和1.021,一般认为n值为1~10时易于萃取[22].Cu2+、Ni2+理论饱和萃取容量(qmax)分别为215.22mg/g、279.59mg/g,从Langmuir方程中可定义一个无量纲的分离因子RL,用以说明萃取平衡的属性,当RL=0,表示不可逆萃取;0<RL<1,表示处于线性平衡状态;RL>1表示萃取平衡利于反萃取的进行,本实验RL分别为0.438~0.961,0.499~0.970同样表明HHMHC对Ni2+、Cu2+的萃取易于进行[23].

式中:KL表示Langmuir萃取平衡常数,L/mg;C0表示萃取平衡浓度mg/L.
不同初始浓度重金属离子萃取反应的lnKD和1/T的关系见图7,KD表示萃取分布系数(KD=qe/Ce),萃取热力学参数计算结果见表3.由表3可知,焓变ΔH0<0,反应为放热反应,不同温度下Gibbs自由能变ΔG0<0,说明反应可自发进行.
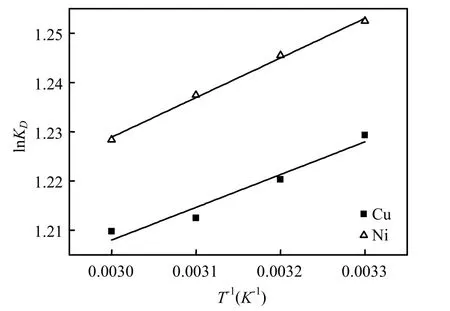
图7 HHMHC萃取Ni2+、Cu2+的lnKD和1/T的关系Fig.7 Plot of lnKDvs 1/T for Ni2+、Cu2+extraction with HHMHC

表1 萃取动力学参数Table 1 Kinetic parameters of heavymetal ions extraction on HHMHC

表2 等温萃取模型拟合参数Table 2 Simulation of isotherm models and corresponding parameters
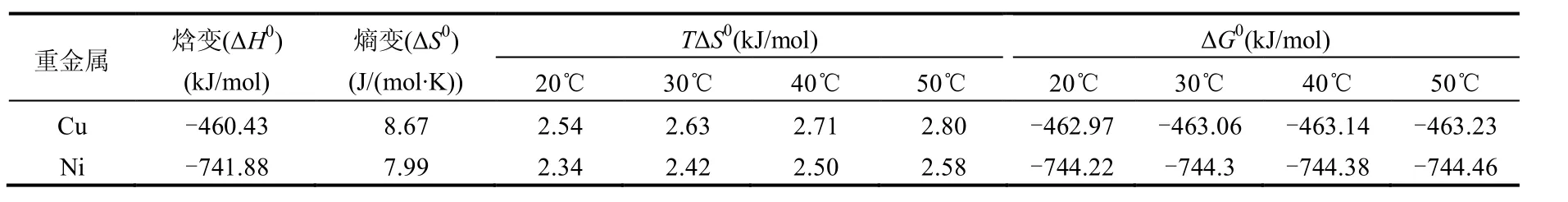
表3 萃取热力学参数Table 3 Thermodynamic parameters for the extraction at different temperatures.
2.5 机理分析
从图2可知,HHMHC含有可离解的氢离子,其对金属离子的萃取机理表现为阳离子交换机理[24],故HHMHC对Ni2+, Cu2+的可能萃取机理为如下反应方程式[3~7]:

萃取常数K:

分配比D:

此处,


式中:HnL(o)表示有机相中可离解的氢离子化合物;M2+(w)表示水相中的2价金属离子;分配比D是指水相中的金属离子浓度与有机相中的金属离子浓度比.

图8 Ni2+、Cu2+平衡分配比随初始pH值的变化Fig.8 Effect of extraction distribution ratios of Ni2+、Cu2+on initial pH

图9 HHMHC与Ni2+, Cu2+的配位Fig.9 The coordination of HHMHC with heavy metals(Ni2+, Cu2+)
当Cu2+的pH值2.0~6.0,Ni2+的pH值2.0~5.0时,pH值与lgD呈线性关系,如图8所示,将得到的数据进行拟合,得到线性相关系数R2分别为0.971和0.973,直线斜率分别为0.138、0.289,此时,HHMHC对重金属离子(Ni2+、Cu2+)的萃取机理符合阳离子交换机理,随着溶液初始pH值的增加,重金属离子的分配比增加,萃取率增加,促进了萃取反应向正向进行[25].而当pH>6时,pH值与lgD不再是线性关系,表明HHMHC的萃取较为复杂,当其萃取金属离子时,除阳离子交换机理外,还存在与冠醚萃取相同的离子缔合萃取,由于HHMHC的杯底有羟肟基团(-CONHOH),上沿有-COOH基团,-COOH中的H也可能被金属交换,下沿的羟肟基团(-CONHOH)可与金属离子进行配位[26],考虑-CONHOH存在两种异构,因此可能配位结构如图9所示.
3 结论
3.1 HHMHC对Ni2+、Cu2+具有较好的萃取效果.当温度为30℃时,对Ni2+的萃取的最佳pH值为5.0,对Cu2+的萃取的最佳pH值为6.0;萃取过程存在阶段萃取的特征,表现为快速的表面萃取,在15min时,HHMHC对Ni2+、Cu2+的萃取率分别达90.898%、88.722%,在30min时达到平衡.
3.2 HHMHC萃取Ni2+、Cu2+的过程符合准二级动力学模型(R2>0.99)和Freundlich等温模型(R2>0.999),是一个自发的放热反应过程.
3.3 萃取过程既有阳离子交换作用,也存在与冠醚萃取相同的离子配位作用,参与配位作用的主要是羟肟基团(-CONHOH).
[1]张 华.污泥中重金属的萃取及分离技术研究 [D]. 上海:同济大学, 2006.
[2]马 前,张小龙.国内外重金属废水处理新技术的研究进展 [J].环境工程学报, 2007,1(7):10-14.
[3]Hu P Z, Qian L J, Zhou X, et al. Solvent extraction of uranyl by N,N,N',N'-tetraoctylsuccinylamide from nitric acid solution [J]. Journal of Radioanalytical and Nuclear Chemistry, 2013,295: 1209-1213.
[4]彭 馨,袁兴中,黄华军,等.漆酶的逆胶束萃取条件优化的研究[J]. 中国环境科学, 2013,33(5):904-909.
[5]Hu P Z, Qian L J, He Y X, et al. Solvent extraction of uranium(VI) and thorium (IV) by N,N0-di-ptolylpyridine-2, 6-dicarboxamide from nitric acid solution. [J]. Journal of Radioanalytical and Nuclear Chemistry, 2013,297:133-137.
[6]曾清如,廖柏寒,杨仁斌,等.EDTA溶液萃取污染土壤中的重金属及其回收技术 [J]. 中国环境科学, 2003,23(6):597-601.
[7]Adhikari B B, Gurung M, Kawakita H, et al. Methylene crosslinked calyx [6]arene hexacaarboxylic acid resin:A highly efficient solid phase extractant for decontamination of lead bearing effluents [J]. Journal of Hazardous Materials, 2011,193:200-208.
[8]Zaghbani A, Tayeb R, Fontas C, et al. Thiacalixarene derivatives incorporated in iptical-sensing membranes for metal ion recognition [J]. Analytical Letters, 2011,44(7):1241-1253.
[9]Tyagi S, Agarwal H, Ikram S. Potentiometric polymeric membrane electrodes for mercury detection using calixarene ionophores [J]. Water Science and Technology, 2010,61(3):693-704.
[10]Torma F, Grun A, Bitter I, et al. Calixarene/Nafion-modified bismuth-film electrodes for adsorptive stripping voltammetric determination of lead [J]. Electroanalysis, 2009,21(17/18):1961-1969.
[11]Trivedi U V, Menon S K, Agrawal Y K. Polymer supported calix[6]arene hydroxamic acid, a novel chelating resin [J]. Reactive & Functional Polymers, 2002,50:205-216.
[12]杨发福,陈希磊,郭红玉,等.杯[4]芳烃黄原酸酯衍生物的合成与阳离子萃取性能 [J]. 有机化学, 2005,25(1):86-89.
[13]黄赛金,易健民,唐课文.对叔丁基杯[8]芳烃酯类衍生物的合成方法改进及其对酯型儿茶素的萃取性能 [J]. 合成化学,2009,17(3):327-329.
[14]Jiang Y R, Zhao B N, Zhou X H, et al. Flotation of diaspore and aluminosilicate minerals applying novel carboxyl hydroxamic acids as collector [J]. Hydrometallurgy, 2010,104:112-118.
[15]张春春.杯芳烃一异羚肪酸的设计合成及其过渡金属配合物的仿酶功能研究 [D]. 成都:四川大学, 2003.
[16]Zhang B Y, Zhong H. Determination of hydroxamic acids by direct spectrophotometry of coloured complex in acidic solution[J]. Research on Chemical Intermediates, 2010,36(5):495-501.
[17]王劲松,周 洁,李 霞,等.一种杯芳烃衍生物的合成方法:中国,201410245671.4 [P]. 2014-06-05.
[18]陈月芳,曹丽霞,林 海,等.中药渣和麦麸对模拟矿山酸性废水中Cu2+的吸附 [J]. 中国有色金属学报, 2013,23(6):1775-1782.
[19]包汉峰,杨维薇,张立秋,等.污泥基活性炭去除水中重金属离子效能与动力学研究 [J]. 中国环境科学, 2013,33(1):69-74.
[20]Hu X J, Wang J S, Liu Y G, et al. Extraction of chromium (VI) by ethylenediamine-modified cross-linked magnetic chitosan resin: Isotherms, kinetics and thermodynamics [J]. Journal of Hazardous Materials, 2011,185:306-314.
[21]彭国文,丁德馨,胡 南,等.纳米 Fe3O4负载啤酒酵母菌对铀的吸附性能与机理 [J]. 中国有色金属学报, 2012,22(2):604-610.
[22]Zou W H, Zhao L, Zhu L. Efficient uranium (VI) biosorption on grapefruit peel: kinetic study and thermodynamic parameters [J]. Journal of Radioanalytical and Nuclear Chemistry, 2012,292(3):1303-1315.
[23]张金丽,孙道华,景孝廉,等.Au(III)离子在黑曲霉菌上的吸附热力学和动力学特性 [J]. 化工学报, 2013,64(4):0438-1157.
[24]罗建洪,李 军,钟本和,等.对叔丁基杯[4]芳烃乙酸萃取磷酸二氢铵溶液中Mg2+的研究 [J]. 高校化学工程学报, 2009,23(2):1003-9015.
[25]朱志良,叶 剑,顾金英,等.杯[8]芳烃羧酸衍生物对铁、镧的萃取研究 [J]. 核化学与放射化学, 2000,22(3):0253-9950.
[26]于欣伟,乐秀毓.Cu2+,Ni2+,Zn2+与异羟肟酸赘合物配位方式的研究 [J]. 鞍山钢铁学院学报, 1992,15(4).
Extraction of Cu2+and Ni2+with HHMHC.
ZHOU Jie1,2, WANG Jing-song1,2*, LI Xia1,2, FANG Feng-rong2, XIE Shui-bo2, CAI Ping-li1,2(1.School of Urban Construction, University of South China, Hengyang 421001, China;2.Key Laboratory of Pollution Control and Resource Reuse of Hunan Province, University of South China, Hengyang, 421001,China). China Environmental Science, 2015,35(3):770~776
5,11,17,23,29,35-hexacarboxy-37,38,39,40,41,42-hexa-methoxy-hydroxamic calyx[6]arene (HHMHC) was synthesized by modifying p-hydroxybenzoic acid, and characterized by IR. The effects of pH, Cu2+and Ni2+initial concentration, extraction time and temperature on the calixarenes extraction behavior of Cu2+and Ni2+were investigated. The results showed that the maximum extraction were observed under the experiment conditions of 30℃ with a contact time of 30min, a pH of 6.0(Cu2+), 5.0(Ni2+), when the initial concentration of Cu2+and Ni2+was 5mg/L. The extration of Cu(II) and Ni(II) onto HHMHC had a close agreement with the pseudo-second-order model (R2>0.99) and the Freundlich model (R2>0.999). In the extraction process, the negative values of Gibbs free energy (ΔG0) revealed this extraction was spontaneous. Meanwhile, the value of enthalpy(ΔH0) was negative, indicating that the extraction reaction was exothermic progress. Based on the analysis of IR spectra and the effect of pH on the extraction distribution ratio (D), it was found that the extraction mechanism of Cu2+and Ni2+with HHMHC not only followed the ion exchange mechanism, but also included the coordination effect, on which the functional group -CONHOH played an important role.
5,11,17,23,29,35-hexacarboxy-37,38,39,40,41,42-hexa-methoxy-hydroxamic calyx[6]arene (HHMHC);extraction;heavy metal ions;mechanism
X701.3
A
1000-6923(2015)03-0770-07
周 洁(1988-),女,湖南株洲人,南华大学硕士研究生,主要从事水处理方面的研究.发表论文2篇.申请专利2项.
2014-06-11
国家自然科学基金(21177053,11175081);湖南省高校创新平台开放基金(12K091);南华大学科技创新团队(NHCXTD07)
* 责任作者, 教授, fcwrwang@126.com
