基于竞争触发滚环扩增的荧光适配体传感器高灵敏检测凝血酶
2015-11-16张松柏郑丽英胡霞沈广宇刘学文沈国励俞汝勤
张松柏+郑丽英+胡霞+沈广宇++刘学文+沈国励+俞汝勤

摘 要 利用目标蛋白、适体探针、挂锁探针和与适体探针匹配的互补序列之间的竞争反应,发展了一种基于滚环扩增的高灵敏荧光适配体传感器。在不含目标蛋白时,互补序列由于与适体探针杂交形成双链,因此不能与挂锁探针杂交以触发连接-滚环放大反应。相反,有目标蛋白存在时,由于目标蛋白与适体探针结合,使得互补序列被置换下来,从而可以与挂锁探针杂交。在DNA连接酶的作用下,挂锁探针被进一步环化并在Phi 29 DNA聚合酶的作用下发生滚环扩增反应。扩增产物含有许多能与分子信标检测探针环状部分杂交的重复序列,从而分子信标被打开产生荧光信号。对互补序列的长度及挂锁探针的浓度进行了考察。在优化的实验条件下,本传感系统可以实现对的凝血酶高灵敏检测,线性范围为0.067~32 nmol/L,检出限为0.03 nmol/L(约90 amol目标分子)。通过设计不同的适体探针和相关核酸序列,本传感系统可以作为一种通用型方法用于其它目标物的分析。
关键词 核酸适配体; 滚环扩增; 分子信标; 荧光; 凝血酶
1 引 言
临床上对恶性肿瘤进行快速灵敏筛查常以肿瘤标志物作为检测的目标分子。肿瘤标志物是一类由肿瘤组织和细胞产生的与肿瘤形成、发生相关的物质,主要是肿瘤抗原、激素、酶及其同工酶等。例如凝血酶是一种由凝血酶前体形成的丝氨酸蛋白质水解酶,具有催化纤维蛋白元变成纤维蛋白,促进血液凝固和调控凝血等作用,在解释肿瘤的发生机制及作为早期诊断、疗效及预后判断等方面均具有重要意义[1,2]。发展可以高灵敏检测这些肿瘤标志物蛋白质的生物传感器是恶性肿瘤早期诊断的一个非常有效的方法。
近年来,核酸适配体技术的发展为肿瘤标志物蛋白质的检测提供了新的契机。核酸适配体是通过配体指数富集系统进化技术在体外筛选得到的单链DNA或RNA寡核苷酸片段[3,4],可高特异性结合蛋白质、小分子,甚至细胞。核酸适配体作为一种新型分子识别元件,具有独特的优势,如适体合成简单、特异性强、稳定性好、容易标记和修饰等, 被广泛应用于蛋白质分析、药物筛选、疾病诊断、生物传感器和分子识别元件的设计等方面。已报道的利用核酸适配体检测蛋白质的技术和方法包括比色法[5]、荧光法[6]、电化学法[7]等。相比于电化学方法需要多步的界面反应及繁琐的操作,荧光法具有操作方便、响应快速、重现性好等优点,但其检测灵敏度低于电化学方法。因此,荧光适配体传感器中常需要进行信号放大。
滚环扩增作为一种恒温下进行的扩增反应,常用于蛋白质分析的生物传感方法[8]。本研究基于竞争触发滚环扩增反应,利用适体探针、目标蛋白、互补序列和挂锁探针之间的竞争反应发展了一种高灵敏检测凝血酶的荧光适配体传感方法。当样品中含有待测目标分子凝血酶时,凝血酶与其适配体序列特异性结合形成独特的空间三维结构,则互补序列只能与挂锁探针杂交,并在E.coli DNA连接酶的作用下使挂锁探针环化形成环状DNA。进而在phi 29 DNA聚合酶的作用下进行滚环扩增,得到大量与挂锁探针模板互补的长链DNA产物。使用分子信标作为信号探针与所得长链DNA进行杂交反应,分子信标荧光基团的荧光恢复,荧光强度大小与目标分子凝血酶的浓度相关,基于此建立了高灵敏检测肿瘤标志物凝血酶的荧光适配体传感器。此生物传感系统的构建策略具有普适性,通过改变适配体探针的序列,可用于其它目标分子的检测。
2 实验部分
2.1 仪器与试剂
Hitachi F-2500 荧光分光光度计(日本Hitachi公司),150 W氙灯光源,检测器为R928F红敏光电倍增管。激发光和发射光狭缝宽度均为5.0 nm。激发波长为495 nm,发射波长采集范围为505~650 nm,其中520 nm处的荧光强度用于评价本检测方法的分析性能。如无特殊说明,所有检测均在室温(20℃)下进行
实验所用到的寡核苷酸序列均由生工生物(上海)有限公司合成,其序列如表1所示。核酸适配体探针的双下划线部分为凝血酶的核酸适配体,能与凝血酶特异性结合,也能与互补序列(CDNA)的一段序列(下划线部分)互补。挂锁探针的5′端进行了磷酸化,5′端和3′端下划线且斜体部分能与CDNA完全互补。作为检测探针的分子信标其5′端和3′端分别修饰了荧光基团FAM和猝灭基团DABCYL,斜体部分为茎干序列,黑体部分为与滚环扩增产物杂交的序列。
凝血酶购自上海源叶生物科技有限公司。E. coli DNA连接酶试剂盒(包括E. coli DNA连接酶,10×E. coli DNA连接酶反应缓冲液和10×BSA(0.5%))购自大连宝生物有限公司。Phi 29 DNA聚合酶购自Fermentas公司(包括10×Phi 29反应缓冲液)。其它化学试剂均为分析纯,实验中直接使用。实验所用水均为3次蒸馏水,阻抗≥18 MΩ·cm。
2.2 连接反应
将凝血酶用储存缓冲液稀释,取不同浓度的凝血酶3 μL与等体积的适配体探针(60 nmol/L)混合,反应30 min;加入相同体积的互补序列CDNA(60 nmol/L)再反应30 min, 然后再加入90 nmol/L挂锁探针3 μL与游离的CDNA进行杂交反应30 min。向所得反应液中相继加入10×E. coli DNA连接酶反应缓冲液2 μL,10×BSA溶液2 μL 及1 U/μL E. coli DNA连接酶4 μL,37℃下温育60 min进行连接反应,得到20 μL连接反应液。
2.3 滚环扩增及蛋白质分析
向2.2节中所得到的20 μL连接反应液中相继加入10×Phi 29反应缓冲液4 μL,dNTPs溶液(含A, T, G, C各10 mmol/L)4 μL,灭菌水10 μL,最后加入10 U/μL Phi29 DNA聚合酶2 μL,所得聚合反应液总体积为40 μL,其中4种dNTPs浓度均为1 mmol/L,Phi29 DNA聚合酶浓度为0.5 U/μL。将所得溶液于37℃温育30 min进行滚环扩增反应。反应完成后将溶液在65℃水浴中加热10 min,使Phi29 DNA聚合酶失活,终止扩增反应,然后将溶液冷却至室温。最后加入分子信标检测探针溶液60 μL与滚环扩增产物反应30 min后,测量所得溶液的荧光光谱。endprint
3 结果与讨论
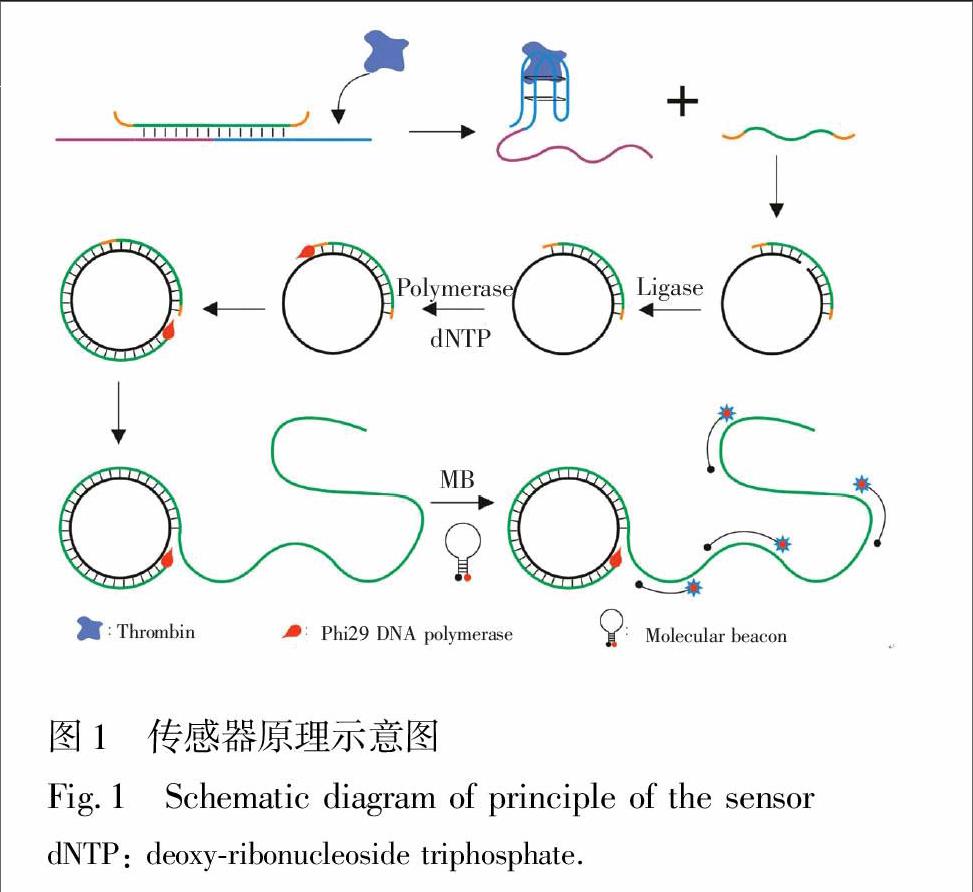
3.1 传感器构建原理
在典型的滚环扩增反应中,当有环状DNA模板、引物和聚合酶时,通过DNA聚合酶的作用,以环形DNA为模板进行复制,引物被延伸并最终形成一条与环状DNA模板互补的具有成千上万重复序列的线状单链DNA,由此可以实现对靶核酸的检测信号的放大,该方法灵敏度高,理论上可以检测到一个拷贝的核酸分子[9]。本实验利用滚环扩增的原理,设计了一种利用核酸适配体竞争反应触发滚环放大检测蛋白质的新方法。本方法的关键在于竞争反应相关核酸序列的设计。本研究通过专业的DNA分析软件mfold设计各核酸的序列,使适体探针的3′端包含15个碱基的凝血酶的适配体序列。互补DNA序列(CDNA)既能与适体探针的一段互补也能与挂锁探针的5′和3′端互补。当样品中没有目标蛋白时,CDNA与适体探针互补杂交形成稳定的双链DNA,因此挂锁探针不能与CDNA杂交,无法成环和扩增。相反,在有目标蛋白存在的条件下,由于目标蛋白与适体探针高特异性结合,使得CDNA不能与适体探针杂交,未反应的CDNA则能与挂锁探针的5′和3′端杂交。在大肠杆菌DNA连接酶的作用下,挂锁探针5′和3′端连接成环。形成的环状挂锁探针以CDNA作为引物在Phi29 DNA聚合酶作用下进行滚环扩增反应,得到如图1所示长链单链DNA扩增产物。该扩增产物含有成千上万与环状挂锁探针互补的重复序列,而每段重复序列又包含能与分子信标检测探针环状部分互补的序列,
分子信标与其杂交反应后,发夹结构被打开,荧光基团信号得以恢复,其荧光强度大小与目标蛋白含量相关,基于此构建了可以对超微量样品中的目标蛋白快速灵敏检测的荧光适配体传感器。该传感方法将适体与蛋白质的特异反应转化为相应核酸的扩增反应,从而实现目标蛋白的信号放大和灵敏检测,检测速度快,操作简单易行。通过改变适体探针、挂锁探针和CDNA的序列,还可以将该方法应用于其它目标分子的检测,具有通用性。
3.2 CDNA序列的考察
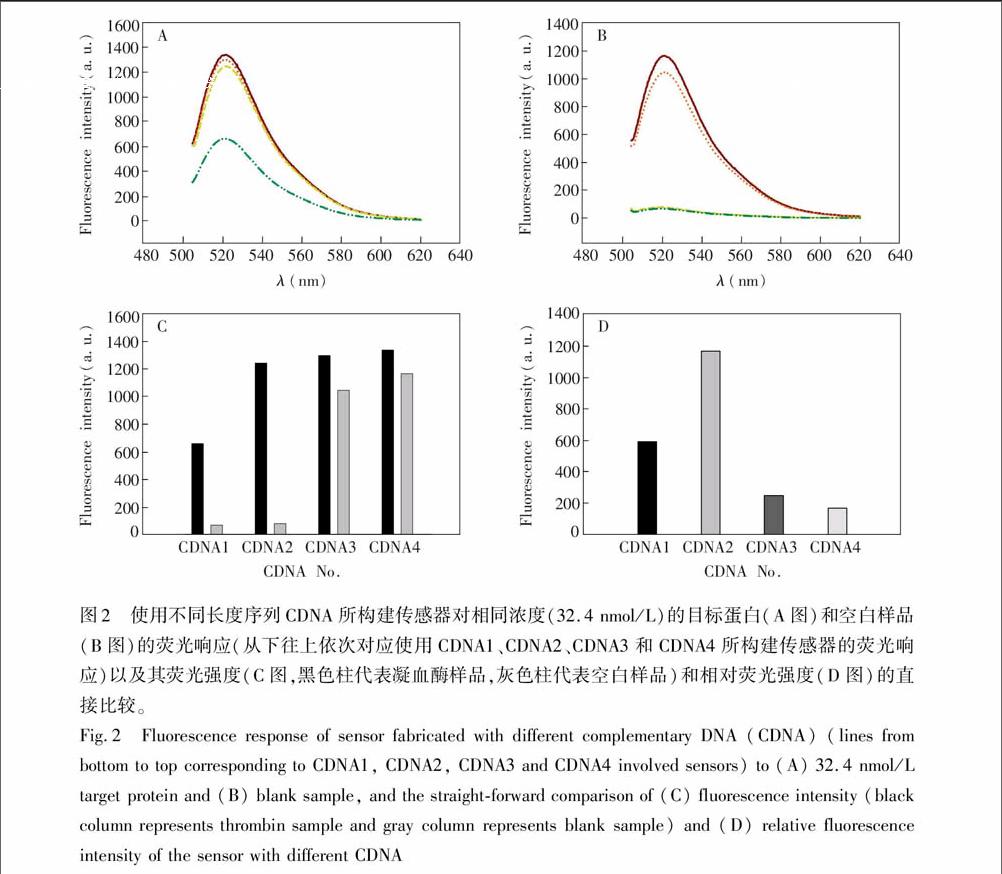
本研究采用的基于滚环扩增的荧光适配体传感方法包含两组反应,即目标蛋白和CDNA均能与适体探针反应,而适体探针和挂锁探针又竞争结合CDNA,其中CDNA同时参与了两组反应,其序列的长短直接影响两组反应的程度,因此实验中考察了不同长度的CDNA序列对传感器响应性能的影响。设计了4条不同长度的CDNA,序列如表1所示。其下划线部分能与适体探针互补杂交,5′端和3′端分别延伸不同数量的T碱基以依次增加CDNA和挂锁探针杂交的碱基对数。将此4条不同长度的CDNA分别按照实验部分的步骤构建荧光适配体传感器,考察传感器在有无目标蛋白时的荧光响应,结果如图2所示。
图2A中4条曲线从下往上依次为使用CDNA1, CDNA2, CDNA3和CDNA4构建的适配体传感器对32.4 nmol/L凝血酶的荧光响应。可见,CDNA1引起的荧光响应相对较小,这可能是CDNA1序列较短,与挂锁探针杂交不够稳定所致;而当CDNA序列延长后,传感器荧光响应急剧升高(如CDNA2);但继续延长序列,荧光升高不够明显(如CDNA3和CDNA4),这可能是因为CDNA序列延伸到一定长度后,已经可以与挂锁探针稳定杂交,继续延长序列对其稳定性影响较小。
图2B图中4条曲线从下往上依次对应使用CDNA1, CDNA2, CDNA3和CDNA4构建的适配体传感器对空白样品的荧光响应。可见,对于空白样品,CDNA1和CDNA2引起的荧光响应均很小,说明当待测样品中没有目标蛋白时,适体探针仍然与CDNA稳定杂交,导致CDNA没有与挂锁探针反应,进而没有后续的滚环扩增反应发生。这可能是因为CDNA1和CDNA2与适体探针杂交后,挂锁探针与适体探针竞争时不足以将CDNA竞争置换下来。而当CDNA的序列延长到一定程度后,例如CDNA3和CDNA4,其与挂锁探针的杂交稳定性要高于与适体探针杂交的稳定性,从而即使没有目标蛋白存在,挂锁探针也可将部分CDNA竞争置换下来,引发后续的滚环扩增反应,进而与检测探针反应后可以检测到较强的荧光。
图2 使用不同长度序列CDNA所构建传感器对相同浓度(32.4 nmol/L)的目标蛋白(A图)和空白样品(B图)的荧光响应(从下往上依次对应使用CDNA1、CDNA2、CDNA3和CDNA4所构建传感器的荧光响应)以及其荧光强度(C图,黑色柱代表凝血酶样品,灰色柱代表空白样品)和相对荧光强度(D图)的直接比较。
将图2A和图2B中不同CDNA构建的传感系统对有无目标分子的荧光响应进行直接对比,发现随着互补探针序列的增长,传感系统的荧光响应也均呈增加趋势,如图2C图所示。对比发现CDNA1和CDNA2在有无目标分子时其荧光强度有较大的差值(相对荧光强度),而CDNA3和CDNA4的相对荧光强度较小,其中采用CDNA2时的信噪比最大。因此,后续实验中均使用CDNA2用于构建本传感系统。
3.3 挂锁探针浓度的考察
挂锁探针与适体探针竞争结合CDNA,其浓度对竞争反应有一定的影响。实验考察了挂锁探针与CDNA浓度在不同的比例关系下传感系统的荧光响应,结果如图3所示。随着挂锁探针和CDNA摩尔浓度比增大,传感器荧光响应也相应地增加,在比例关系为3∶2时有最大的荧光响应。比例关系继续增加,系统荧光响应反而降低。这可能是因为挂锁探针超过一定浓度后,其浓度越大,越容易导致CDNA的两端分别连接一分子挂锁探针。这种情况下挂锁探针不能被环化,因而也不能发生后续的滚环扩增反应。因此,为了获得最佳检测性能,实验中选择挂锁探针与CDNA的摩尔浓度之比为3∶2。
3.4 传感器分析性能
本研究利用滚环扩增的基本原理结合核酸适配体对目标蛋白的特异性识别发展了一种有效的荧光适配体传感方法,将适体探针对目标蛋白的识别转化为核酸的扩增从而实现信号放大,理论上可以实现对单分子目标蛋白的检测。传感器对不同浓度的凝血酶溶液的荧光响应如图4所示。图4A为此荧光适配体传感器对不同样品溶液的荧光响应曲线。随着凝血酶浓度的增大,荧光信号逐渐增强。在0.067 ~32.4 nmol/L的范围内,520 nm处荧光峰强度与目标分子凝血酶浓度的对数呈线性关系,线性方程为F=396.5lgC+625.1,相关系数为0.9934,以3倍信噪比计算其检出限为0.03 nmol/L。endprint
图4 传感器对空白样品和不同浓度(从a到h: 0.067 nmol/L, 0.2 nmol/L, 0.6 nmol/L, 1.8 nmol/L, 5.4 nmol/L, 16.2 nmol/L和32.4 nmol/L)凝血酶的荧光响应(A图)以及传感器的线性相关曲线(B图)。
Fig.4 (A) Fluorescence response of the sensor to blank sample and thrombin with different concentrations (0.067 nmol/L, 0.2 nmol/L, 0.6 nmol/L, 1.8 nmol/L, 5.4 nmol/L, 16.2 nmol/L and 32.4 nmol/L); (B) Linear regression curve of the proposed biosensor
与文献报道的检测凝血酶的适配体传感器相比,本研究提出的基于竞争触发滚环扩增的荧光适配体传感方法其检测灵敏度要高于大多数光学[10,11]和电化学[12,13]检测方法,可与一些应用了其它信号放大方法的适体传感方法相媲美。例如,Giusto等[14]基于邻近延伸信号放大发展的荧光适配体传感器对凝血酶的检出限为30 pmol/L,Deng等[15]利用金纳米颗粒信号放大发展的阻抗型适体传感器对凝血酶检出限达20 pmol/L。但由于本实验中凝血酶样品的用量仅为3 μL,换算成摩尔量后仅为90 amol,远低于其它信号放大方法的实际用量。而且,本方法很容易通过修改适体探针及其对应的CDNA和挂锁探针的序列实现对其它目标分子的检测,具有普适性,在肿瘤标志物蛋白或小分子等检测领域具有潜在的应用价值。
3.5 特异性和重现性
本方法的选择性主要取决于传感系统的特异性。如图5所示,32.4 nmol/L凝血酶(约1 μg/mL)引起的传感器荧光响应约为1220 a.u.,而1 mg/mL IgG、10 mg/mL anti-IgG和10 mg/mL BSA引起的荧光响应非常小,接近分子信标的背景荧光,表明本传感系统具有良好的选择性,这主要是由核酸适配体对其对应目标分子的高亲和力、高特异性识别。
考察了传感器的重现性。实验中对线性范围内不同浓度(0.2, 0.6和5.4 nmol/L)的凝血酶样品进行3次平行实验,相对标准偏差为2.1%~5.7%,表明本传感系统对凝血酶的检测具有较好的重现性。
3.6 回收率测定
为考察所构建传感器的实用性,在稀释10倍的人血清样品中进行了凝血酶的回收率测定,结果见表2。平均回收率为98.8%,说明通过本检测方案构建的传感系统可用于血液样品中凝血酶的测定。
图5 传感器特异性考察。32.4 nmol/L凝血酶、1 mg/mL IgG、10 mg/mL anti-IgG和10 mg/mL BSA。
Fig.5 Specificity of the sensor. Conditions: 32.4 nmol/L thrombin, 1 mg/mL IgG, 10 mg/mL anti-IgG and 10 mg/mL BSA.
4 结 论
建立了一种利用竞争反应触发连接和滚环放大以检测凝血酶的荧光适配体传感方法。使用背景荧光低的分子信标作检测探针,此方法对模型目标蛋白凝血酶可实现高灵敏检测,检出限可低至0.03 nmol/L。通过设计不同的适体探针、CDNA及挂锁探针,可实现对不同目标蛋白质的检测,具有普适性。
References
1 TUYong-Hua, CHENG Gui-Fang, LIN Li. Chem. J. Chinese Universities, 2006, 27(12): 2266-2270
徒永华, 程圭芳, 林 莉. 高等学校化学学报, 2006, 27(12): 2266-2270
2 YUAN Tao, LIU Zhong-Yuan, HU Lian-Zhe, XU Guo-Bao. Chinese J. Anal. Chem., 2011, 39(7): 972-977
袁 涛, 刘中原, 胡连哲, 徐国宝. 分析化学, 2011, 39(7): 972-977
3 FENG Ya-Juan, YANG Yun-Hui. Chinese J. Anal. Chem., 2014, 42(8): 1137-1142
冯亚娟, 杨云慧. 分析化学, 2014, 42(8): 1137-1142
4 Ho H A, Leclerc M. J. Am. Chem. Soc., 2004, 126(5): 1384-1387
5 Alsager O A, Kumar S, Zhu B C, Travas-Sejdic J, McNatty K P, Hodgkiss J M. Anal. Chem., 2015, 87(8): 4201-4209
6 Yang C, Spinelli N, Perrier S, Defrancq E, Peyrin E. Anal. Chem., 2015, 87(6): 3139-3143
7 Zhang S B, Hu X,Yang X H, Sun Q L, Xu X L, Liu X W, Shen G Y, Lu J L, Shen G L, Yu R Q. Biosens. Bioelectron., 2015, 66: 363-369
8 Wu Z S, Zhang S B, Zhou H, Shen G L, Yu R Q. Anal. Chem., 2010, 82(6): 2221-2227
9 Frank B D, John R N, Theresa L G, Roger S L. Genome Res., 2001, 11(6): 1095-1099
10 Hamaguchi N, Ellingtion A, Stanton M. Anal. Biochem., 2001, 294(2): 126-131
11 Choi J H, Chen K H, Strano M S. J. Am. Chem. Soc., 2006, 128(49): 15584-15585
12 Radi A, Snchez J L A, Baldrich E, O′Sulivan C K. J. Am. Chem. Soc., 2006, 128(1): 117-124
13 Xiao Y, Piorek B D, Plaxco K W, Heeger A J. J. Am. Chem. Soc., 2005, 127(51): 17990-17991
14 Giusto D A D, Wlassoff W A, Gooding J J, Messerle B A, King G C. Nucleic Acids Res., 2005, 33(6): e64
15 Deng C Y, Chen J H, Nie Z, Wang M D, Chu X C, Chen X L, Xiao X L, Lei C Y, Yao S Z. Anal. Chem., 2009, 81(2): 739-745endprint
