基于磁场诱导纳米金聚集的表面增强拉曼散射传感器用于细菌DNA的检测
2015-11-16马群李艳乐龚年春江西宦双燕
马群 李艳乐 龚年春 江西 宦双燕
摘 要 以5,5′-二巯基-双(2-硝基苯甲酸)( NB)为拉曼标记分子,利用磁珠的分选富集作用以及完全互补的两条DNA链间的杂交作用力,构建了一种基于表面增强拉曼技术检测细菌DNA的超灵敏方法。链霉亲和素包裹的磁珠通过生物素-亲和素连接上捕获探针,与目标细菌DNA序列部分互补杂交,目标链的另一端与拉曼染料和纳米金功能化的报告探针DNA链互补杂交。此设计利用磁球的聚集作用诱使颗粒间距离缩短,产生了等离子体共振耦合效应,从而使得检测的SERS信号显著增强。结果表明,在优化条件下,DNA浓度在5 pmol/L~5 nmol/L范围内,拉曼强度与DNA浓度的对数呈现较好的线性关系,检出限约为5 pmol/L。该方法设计简单,花费低廉,能用于细菌DNA灵敏且有选择性的检测。
关键词 表面增强拉曼; 纳米金; 5,5′-二巯基-双(2-硝基苯甲酸); 细菌DNA; 磁聚集
1 引 言
表面增强拉曼散射(Surface-enhanced raman scattering, SERS)作为一种振动光谱,不仅能够提供分子内结构信息,具有指纹识别特征;并且SERS借助贵金属纳米结构的局域电磁场增强[1,2],其增强因子可高达1014~1015[3,4]。此外SERS光谱与其它光谱相比具有稳定、不易猝灭、可用红光激发、对生物样品损坏小、不受生物样品自身荧光及水的干扰等特点,已广泛用于蛋白质[5,6]、DNA[7,8]、组织细胞[9]、小分子[10]、有机物[11,12]等的检测。
在20世纪80年代初期磁分离技术就已被提出[13],磁性纳米颗粒因具有良好的磁响应性,高的分离效率和表面负载效率,较好的生物相容性和易生物降解等特点,可结合抗体、酶、细胞、DNA等功能分子,在生物分离、靶向给药、免疫测定和酶及细胞的固定等方面具有广泛的应用前景[14~18]。Jin等[19]合成了Fe2O3@AuNP的核壳结构的磁性纳米材料,并基于电化学方法检测大肠杆菌的DNA,从而进一步检测水样中的大肠杆菌;Choo等[20]利用磁球适配体传感器发展了一种高灵敏度检测凝血酶的SERS方法。
本实验以拉曼染料功能化的纳米金为识别元件,构建了一种新型磁珠分选富集和特异性捕获的SERS传感器,用于细菌DNA的检测。拉曼染料和DNA序列双修饰在纳米金上作为报告探针,通过目标细菌DNA互补杂交被捕获到磁珠上,通过磁珠的分离和富集,检测其SERS信号。这种方法不是将体系固定在二维的平面基底上,而是以磁珠为支撑材料,大大提高了捕获DNA的负载量,同时简化了分离、富集和洗脱程序。此外,通过磁场诱使纳米金聚集,产生等离子体耦合效应,在很大程度上提高了检测的灵敏度。因此,本方法能简便、快速地用于细菌DNA的分析检测,且具有较高的灵敏度和选择性。
2 实验部分
2.1 仪器与试剂
拉曼检测采用激光共聚焦倒置显微拉曼光谱仪(英国Renishaw公司)。激发波长为633 nm,激光功率为10 mW,镜头为100倍长焦,光谱采集间隔时间为10 s,积累次数1次。
链霉亲和素包裹的磁珠(SA-MB, 200 nm,河南惠尔科技有限公司);5,5′-二巯基-双(2-硝基苯甲酸)(5,5′-Dithio-bis(2-nitrobenzoic acid), NB)、4-对硝基苯硫酚(4-Nitrothiophenol, NTP)、4-对巯基苯甲酸(4-Mercaptobenzoic, MBA)、4-对巯基苯硼酸(4-Sulfanylphenylboronic acid, MPBA),购于Sigma-Aldrich公司;氯金酸(HAuCl4· 2O)、柠檬酸钠等其它试剂均为分析纯(上海国药试剂有限公司),无需进一步处理或纯化直接使用。实验用水经Millipore系统纯化(电阻系数>18.2 MΩ·cm)。实验室所用缓冲溶液和超纯水均需灭菌处理。实验所用核酸链均由TaKaRa生物技术(大连)合成,序列见表1。
2.2 金纳米颗粒的制备[21]
根据经典的柠檬酸钠还原法制备实验所用粒径为13 nm的金纳米颗粒(Au nanoparticles, AuNPs),步骤如下:将150 mL 0.01%氯金酸(HAuCl4· 2O)溶液边搅拌边加热到沸腾,然后迅速加入4.5 mL 1%柠檬酸钠溶液。溶液颜色由浅黄色逐渐变成酒红色后,继续加热沸腾 15 min。撤去热源,慢慢冷却至室温,将制备好的金纳米颗粒溶液置于4℃保存。
2.3 拉曼染料和报告DNA功能化的金纳米颗粒的制备[22,23]
参照文献,首先,取1 mL金纳米颗粒溶液以12000 r/min离心10 min,去除上层溶液,将底部沉淀重新分散在500 μL灭菌水中,然后,加入5 μL 1 mmol/L 拉曼染料溶液。室温放置30 min后,加入20 μL 100 μmol/L SH-DNA溶液,混合均匀,室温放置10 min。然后,每隔5 min加入1 μL Citrate-HCl 缓冲液(500 mmol/L,pH 3),使其终浓度为10 mmol/L。再加入HEPES 缓冲液(500 mmol/L, pH 7.6),将溶液的pH值调回中性,其用量为Citrate-HCl 缓冲液加入量的3倍,室温培养30 min。所得溶液于12000 r/min下离心10 min,并用5 mmol/L HEPES 缓冲液(pH 7.6)清洗两次,以充分除去未结合的拉曼染料和DNA。最后,悬浮在500 μL HEPES 缓冲液(5 mmol/L, pH 7.6),4℃储存备用。
2.4 捕获探针的固定
磁珠使用前, 先洗去其表面的防腐剂。然后加入略过量的生物素修饰的DNA溶液,室温下放置,时而轻敲离心管混合,孵育10 min,磁珠此时被覆了生物素化的DNA片段,用磁力架分离磁珠,操作如上,用缓冲液清洗2~3次。endprint
2.5 传感器的制备过程
8 μL固定了捕获探针的磁珠加入到100 μL结合缓冲液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH 8.0),再加入不同浓度的细菌DNA探针,混合液在45℃温育2 min,冷却至室温,磁力架分离,吸弃上清液后,再悬浮在100 μL结合缓冲液中,最后加入8 μL拉曼染料和报告DNA功能化的纳米金溶液,37℃下孵育30 min,冷却到室温,用结合缓冲液清洗2~3次,并悬浮在10 μL结合缓冲液中,备用。
2.6 拉曼检测
取上述制备好的溶液置于干燥洁净的玻璃片上,用磁力架聚集,吸弃上清液,稍干后置于拉曼仪检测。
3 结果与讨论
3.1 实验设计
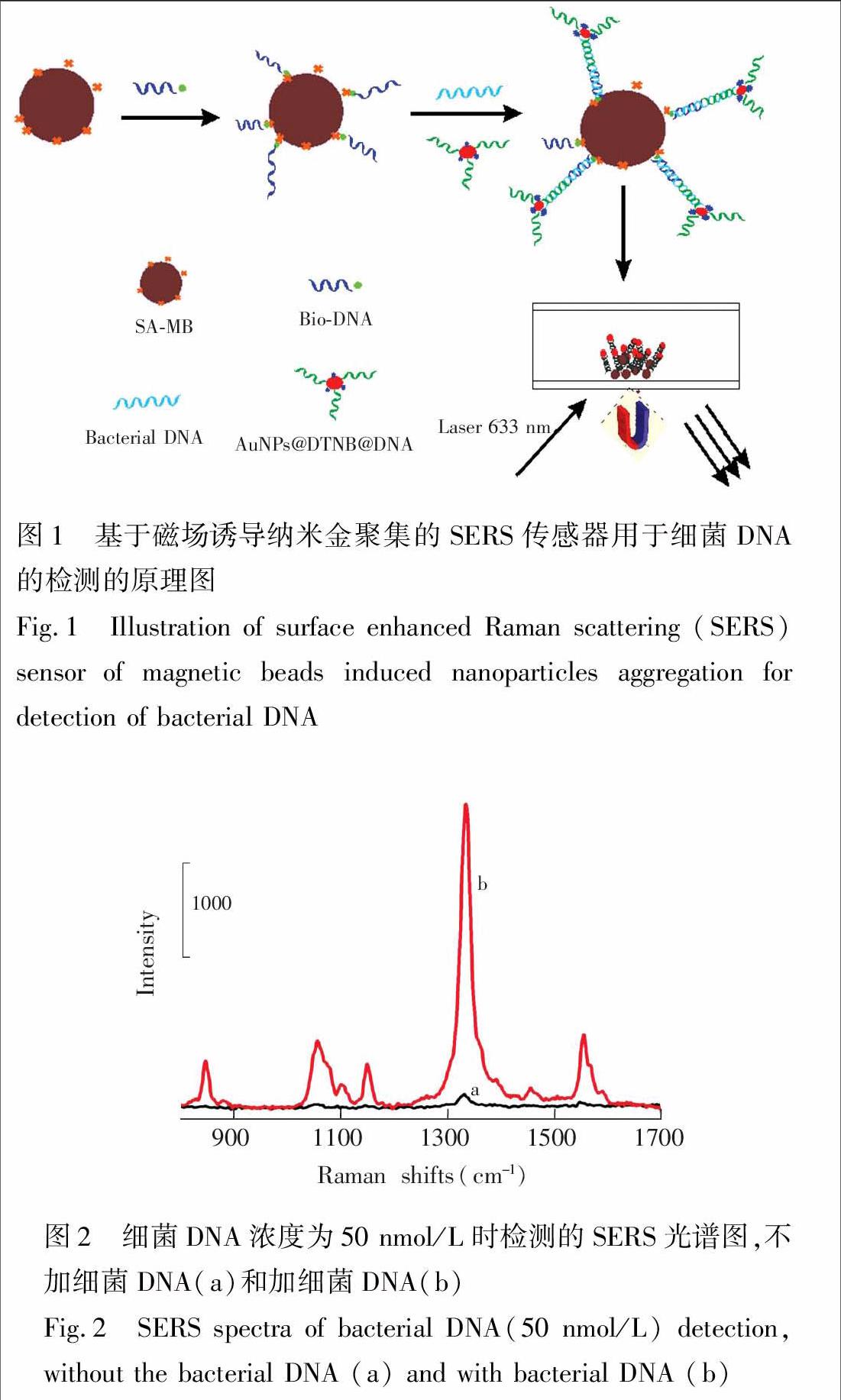
本实验中构建的SERS传感器的原理如图1所示,在链霉亲和素包裹的磁性微球(SA-MB)上,通过亲和素-生物素之间强的非共价作用力,将一端修饰生物素的捕获探针(Bio-DNA)固定在磁性微球表面,捕获DNA链的碱基与细菌DNA的部分碱基互补杂交,余下的碱基将与拉曼染料和纳米金功能化的报告DNA探针互补杂交,通过磁珠的分离富集诱导纳米金聚集,产生显著的SERS增强信号。当细菌DNA不存在时,则无法在磁性微球上组装纳米金功能化的报告探针,从而无法产生显著的SERS增强信号。
图2 细菌DNA浓度为50 nmol/L时检测的SERS光谱图,不加细菌DNA(a)和加细菌DNA(b)
Fig.2 SERS spectra of bacterial DNA(50 nmol/L) detection, without the bacterial DNA (a) and with bacterial DNA (b)
3.2 DNA检测的现象验证
为了最小化荧光背景和提高信噪比,选择非荧光型的染料分子5,5′-二双(2-硝基苯甲酸)作为拉曼信标。图2是此传感器用于细菌DNA检测所得到的SERS光谱。对于空白组,光谱呈现非常弱的SERS信号,拉曼位移在1333 cm
处的特征峰的峰强为1.53×103 counts/cm(图2a),说明不存在细菌DNA链时,报告探针无法组装在磁珠的表面;对于实验组,光谱则呈现显著增强的SERS信号,拉曼位移在1333 cm
处的特征峰的峰强2.68×103 counts/cm (图2b),具有比较理想的信噪比17.6。
3.3 报告探针的表征
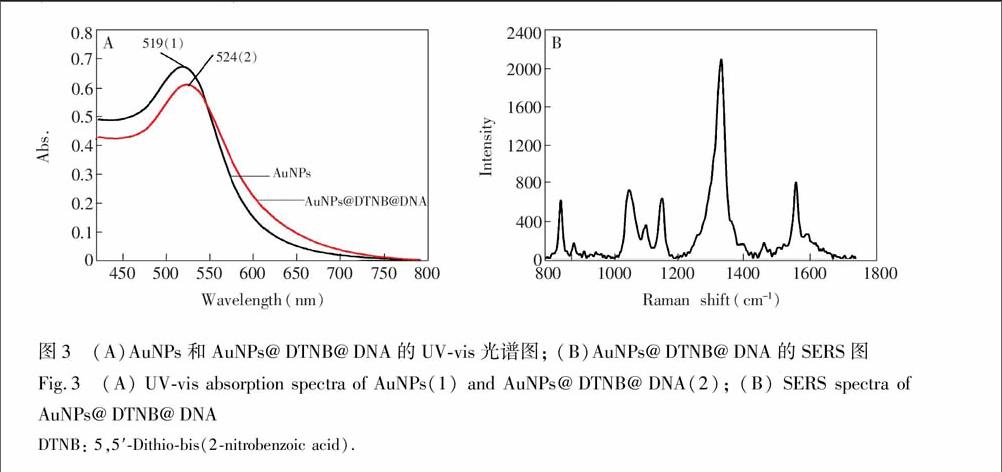
贵金属纳米颗粒具有较强的局域表面等离子体共振效应,在紫外可见波段有很强的吸收,图3A是采用柠檬酸三钠还原法制备的纳米金颗粒,测得其溶液的UV-Vis最大吸收波长为519 nm,可以推测其粒径约为13 nm[24]。纳米金颗粒表面同时修饰巯基DNA和拉曼分子 NB后,测得溶液的最大吸收波长为524 nm,与未修饰的纳米金溶液最大吸收波长相比红移了5 nm,这可能是由于纳米金颗粒表面通过Au-SH键修饰DNA和 NB后所引起的;图3B显示的是修饰在金颗粒表面的拉曼信标 NB的SERS光谱图,这说明了拉曼信标 NB和巯基DNA都被成功修饰在了金颗粒的表面。
3.4 报告探针浓度的优化
报告探针AuNPs@ NB@DNA的浓度对方法的信背比有一定的影响,对其进行了优化。在固定细菌DNA的浓度为50 nmol/L时,检测了报告探针AuNPs@ NB@DNA浓度分别为2, 4, 6, 8和10 μmol/L (以拉曼染料 NB的浓度为基准)体系的SERS光谱,获得了5组空白组和实验组的光谱图。分别计算了实验组和空白组的SERS
光谱的特征峰(拉曼位移为1333 cm
处的特征峰)的峰强,由此得到了不同报告探针浓度所对应的信背比,如图4所示。
3.5 多种不同的拉曼染料验证实验现象
为了进一步对实验现象进行验证,选定了多种非荧光型的拉曼染料,如对巯基苯甲酸(4-MBA)、对硝基苯硫酚(NTP)、对巯基苯硼酸(MPBA),进行了相同的实验。制备了3种不同的金纳米颗粒探针(表面修饰不同的拉曼活性染料),分别将其用于细菌DNA的检测,得到了3组空白样品和实验样品。图5是3组样品的SERS光谱图,对于3个不同的空白样品,所得到的拉曼光谱均呈现较弱的SERS响应;而对于3个不同的实验样品,均获得了显著增强的SERS信号,并且不同的染料具有特征的拉曼指纹图谱。
图5 3种金纳米颗粒探针(表面修饰有不同的拉曼活性染料)用于细菌DNA检测的SERS光谱图。(A)对巯基苯甲酸(MBA);(B)对硝基苯硫酚(NTP);(C)对巯基苯硼酸(MPBA)。其中,空白样品(a),实验样品(b)
Fig.5 SERS spectroscopy of 3 kinds nanoparticle probes (different Raman active dye modified on the surface) for detection of bacterial DNA. (A) 4-mercaptobenzoic acid (MBA); (B)4-nitrothiophenol (NTP); (C)4-sulfanylphenylboronic acid (MPBA). a, blank sample; b, experimental sample.
图6 浓度为50 nmol/L时,完全互补、单错配、四错配和非互补序列(A,B,C,D)经过相同实验操作后,位于1333 cm
谱峰峰强归一化后的柱状图
Fig.6 Comparison for Raman intensity normalization of sensors hybridized with complementary target (A), single base mis-matched (B), four base mis-matched (C) and non-complementary sequence (D) under the same conditions and concentration 50 nmol/L)endprint
3.6 碱基错配的检测
图6所示为相同实验条件下的单碱基错配、四碱基错配、以及完全不互补错配的对照实验。虽然错配序列比空白都显现出了正信号,但是完全不互补错配的寡核苷酸的信号明显来源于背景信号,完全互补的序列产生的信号大于单碱基错配序列的3倍,说明此检测DNA的传感器具有较好的特异性和选择性。
3.7 定量检测
在优化了实验条件后,对不同浓度的细菌DNA的SERS响应进行了考察,图7a是目标探针浓度分别为0,0.005,0.05,0.5,5和50 nmol/L(从下往上)时所得到的SERS谱图。虽然在优化条件下,空白样由于磁珠的非特异性吸附而存在的SERS信号,但是,这样的背景信号对检测并没有产生影响,而且也可以观察到了样品的SERS信号随着细菌DNA浓度的增加而显著增强。图7b是细菌DNA浓度与拉曼位移1333 cm
处的特征峰强度的动态响应曲线,其中每个点均代表在不同的区域10次测量的平均值。图7c是细菌DNA浓度与拉曼位移1333 cm
处的特征峰强度线性关系图,本方法中,DNA浓度在5 pmol/L~5 nmol/L范围内,拉曼强度与细菌其浓度的对数呈现较好的线性关系,线性方程为I=1.919 lgCDNA+1.3907(I为拉曼强度,lgCDNA为细菌DNA浓度的对数),其相关系数为0.9887。
图7 (a)不同细菌DNA浓度所对应的SERS光谱图;(b)拉曼位移1333 cm
处特征峰的峰强度与细菌DNA浓度之间的关系;(c)拉曼位移1333 cm
处特征峰的峰强度与细菌DNA浓度之间的线性关系。
4 结 论
本实验将表面增强拉曼(SERS)传感技术与磁珠分选富集技术相结合,利用纳米金比表面积大、具有良好生物相容性以及表面核酸高负载量的特点,构建一种基于纳米金聚集信号放大的新型SERS传感器。采用三维的磁珠作支撑材料,并通过磁性分离使纳米金聚集,产生“热点”,提高了检测的灵敏度。本方法设计简单,快速,费用低,由于互补DNA链间的杂交特性而具有较高的特异性和选择性,为DNA及其它生物分子的检测提供了一个简单实用的方法。
References
1 Cialla D P, Etschulat J, Popp J. Chem. Phys. Chem., 2010, 11: 1918-1924
2 LUO Zhi-Xun, FANG Yan. Spectroscopy and Spectral Analysis, 2006, 26(2): 358-364
骆智训, 方 炎. 光谱学与光谱分析, 26(2): 358-364
3 Nie S, Emory S R. Science, 1997, 275(5303): 1102-1106
4 Kneipp J, Kneipp H, Kneipp K. Chem Soc. Rev., 2008, 37(5): 1052-1060
5 Hu J, Zheng P C, Jiang J H, Shen G L, Yu R Q, Liu G K. Anal.Chem., 2009, 81 (1): 87-93
6 Wang Y L, Lee K, Irudayaraj J. Chem. Commun., 2010, 46(4): 613-615
7 Qian X, Zhou X,Nie S. J. Am. Chem. Soc., 2008, 130(45): 14934-14935
8 Zhang H, Harpster H M, Park H J, Johnson P A. Anal. Chem., 2011, 83: 254-260
9 Qian X, Peng X H,Nie S. Nature Biotechnology, 2008, 26(1): 83-90
11 Yoon J,Chio N, Ko J, Kim K, Lee S, Choo J. Biosens. Bioelectron., 2013, 47: 62-67
12 Kurouski D, Duyne R P V. Anal. Chem., 2015, 87 (5): 2901-2906
13 Dasary S S R, Singh A K, Senapati D, Yu H, Ray P C. J. Am.Chem.Soc., 2009, 131(38): 13806-13812
14 Ugelstad J, Berge A, Ellingsen T, Schmid r, Nilsen T N, Mork P C, Stenstad P, Olsvik O. Prog. Polym. Sci., 1992, 17(1): 87-161
15 Safarikova M, Kibrikova I, Ptackova L, Hubka T, Komarek K, Safarik I. J. Magn. Magn. Mater., 2005, 293(1): 377-381
16 Liu Y, Li H F, Lin J M. Talanta, 2009, 77(3): 1037-1042
17 Bahaj A S, James P A B, Moeschler F D. J. Magn. Magn. Mater., 1998, 177-181: 1453-1454
18 Sun X P, Du Y, Wang E K. Anal.Chem., 2005, 77(24): 8166-8169
19 Wang J, Kawde A N, Erdem A. Analyst, 2001, 1267(11): 2020-2023
20 Li K, Lai Y J, Zhang W, Jin L T. Talanta, 2011, 84(3): 607-613
21 Yoon J, Choi N, Ko J, Kim K Lee S, Choo J. Biosens. Bioelectron., 2013, 47: 62-67
22 Grabar K C, Freeman R G,Hommer M B, Natan M J. Anal.Chem., 1995, 67(4): 735-743
23 Zhang X,Gouriye T, Goeken K, Servos M R, Gill R, Liu J W. J. Phys. Chem. C, 2013, 117:15677-15684
24 Zhang X, Liu B W, Dave N, Servos M R, Liu J W. Langmuir, 2012, 28: 17053-17060
25 Storhoff J J, Elghanian R, Mucic R C, Mirkin C A, Letsinger R L. J. Am. Chem. Soc., 1998, 120: 1959-1964endprint
