抑制HIF1α表达对低氧培养SGC-7901胃癌细胞CD44表达的影响
2015-11-15柯庆华杨继元
梁 赅 杜 伟 李 爽 柯庆华 蔡 君 杨继元
胃癌细胞表面粘附分子CD44+细胞在体内外实验中表现出较强的干细胞特性,如自我更新及强致瘤能力等[1],提示CD44的表达在胃癌细胞的复发转移机制中发挥了重要的作用。低氧被认为是肿瘤干细胞赖以生存的“小生境”(niche)的重要特性之一[2],已知低氧对细胞的影响通过低氧诱导因子(hypoxia inducible factors,HIF)发挥调节作用,主要亚型有HIF1α、HIF1β、HIF2α 等。研究表明低氧对肿瘤细胞的影响主要为稳定HIF1α亚型蛋白,抑制其蛋白降解[3]。HIF1α可调节多种靶基因如血管内皮生长因子等的表达,在胃癌细胞复发转移过程中起重要作用[4],其机制目前仍未完全明确,是否参与调节表面粘附分子CD44的表达未见研究报道。
本研究拟以人胃癌细胞系SGC-7901为研究对象,研究低氧条件下对HIF1α及CD44的表达变化,并用雷帕霉素抑制SGC7901细胞的HIF1α表达,观察对CD44表达的影响,为阐明其分子机制提供实验依据。
1 材料与方法
1.1 材料
低分化人胃癌细胞系SGC7901购自武汉大学典藏中心。
1.2 试剂
RPMI-1640培养基(美国GIBCO公司),青霉素-链霉素双抗(美国GIBCO公司),小牛血清(GIBCO公司),雷帕霉素(美国 Sigma公司),二甲基亚砜(DMSO,美国sigma公司),逆转录试剂盒(大连宝生物公司);Trizol试剂(大连宝生物公司),荧光实时定量PCR试剂盒(大连宝生物公司);引物序列由上海生工生物工程技术服务有限公司合成;CD44、HIF1α多克隆抗体(Santa Cruz Biotechnology,美国);ECL试剂盒(Pierce Biotechnology,美国)。
1.3 仪器
三气培养箱(德国BINDER)、RG-3000实时定量PCR仪(Corkett,澳大利亚);低温离心机(Eppendorf公司,德国);电泳仪及电泳槽(六一仪器厂,北京)。
1.4 实验方法
1.4.1 细胞培养 胃癌细胞系 SGC7901培养于含10%小牛血清DMEM培养基中,共分4组:正常及低氧空白对照;正常及低氧雷帕霉素组。分别于正常氧压及含1%O2条件下传代培养1周。随后加入20 nm/L雷帕霉素培养72 h,观察细胞活力,及生长曲线的变化,并收获细胞,进行细胞侵袭能力实验,检测CD44及HIF1α的mRNA及蛋白表达。
1.4.2 细胞生长曲线 采用CCK8法检测细胞生长曲线。将含100 μl细胞混悬液的培养板中,加入含20 nm/L雷帕霉素溶液10 μl,在低氧和正常氧压中培养24、48、72 h,然后加入 CCK8 试剂 10 μl,混匀后培养2 h,酶标仪检测450 nm吸光度值。根据试剂盒方法计算细胞增殖活力。
1.4.3 Transwell试验 Transwell试验用于检测细胞侵袭活性。将Matrigel凝胶加入transwell小室上层,37℃孵育30 min聚合成凝胶,加入含1×105细胞悬液200 μl,放入含培养基的24孔培养板中,培养24 h。随后取出小室,去除基质胶及膜上层细胞,加入MTT试剂,采用间接计数法计算下室细胞数量。
1.4.4 实时荧光定量 PCR检测细胞CD44、HIF1α 基因mRNA的表达 Trizol法提取细胞总RNA,根据逆转录试剂盒提供方法进行逆转录,所得cDNA进行荧光实时定量PCR,反应体系见表1,引物设计及反应条件见表2,根据PCR反应的溶解曲线及曲线特征,评价引物增殖反应的特异性,记录各样本反应的阈值(Threshold cycle,Ct),参照试剂盒说明书计算目的基因mRNA表达水平。
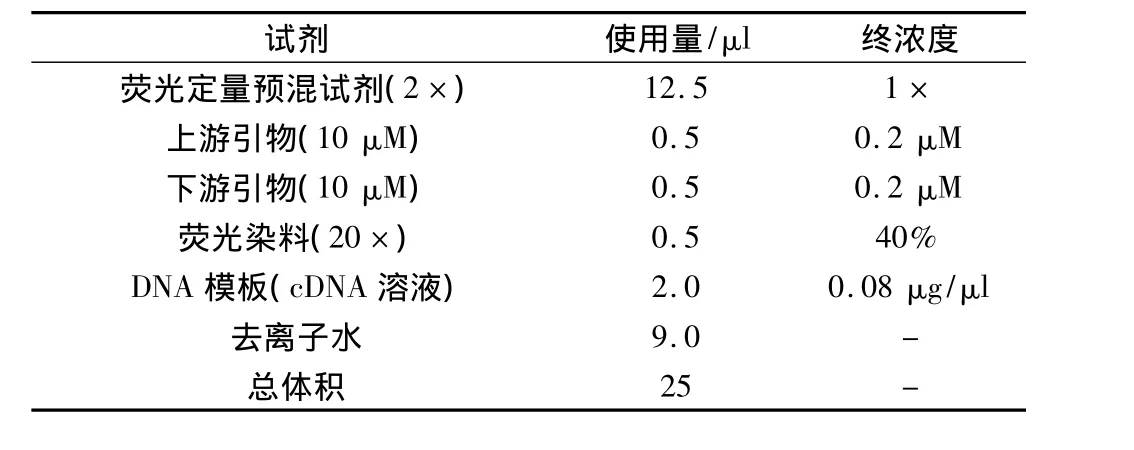
表1 实时定量PCR反应体系

表2 实时定量PCR寡核苷酸引物及扩增条件
1.4.5 Westen blot检测细胞 CD44 及 HIF1α 蛋白表达 将上述分组培养的细胞去除培养液,加入细胞裂解液,离心后取上清进行蛋白定量。随后进行SDSPAGE电泳,样品经过分离胶及浓缩胶,待溴酚蓝至分离胶下缘时停止电泳,随后进行转膜,将样品蛋白湿转至NC膜上,经过漂洗脱色后,分别加入稀释后的CD44及HIF1α抗体进行一抗封闭(CD44抗体,1∶200;HIF1α抗体,1∶100),漂洗后再加入二抗孵育,最后在暗室中进行ECL显色。显色结果拍照后采用灰度分析进行半定量分析。
1.5 统计学方法
应用SPSS 17.0软件进行统计学分析,计量资料采用均数±标准差(Mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),P<0.05表示差异具有显著性。
2 结果
2.1 低氧条件下SGC7901胃癌细胞增殖活性的变化
与正常对照组对比,低氧条件下细胞增殖活性明显升高(P<0.05)。雷帕霉素处理SGC7901胃癌细胞培养72 h后,不论在常氧及低氧条件下增殖活性都较对照组下降(P <0.05),见图1。
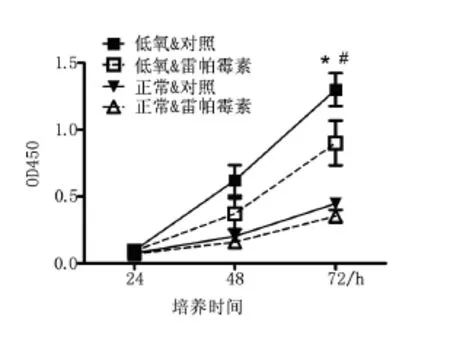
图1 低氧条件下SGC7901细胞生长曲线
2.2 低氧条件下SGC7901胃癌细胞侵袭能力的变化
与正常对照组比较,低氧条件培养后细胞侵袭活性明显增强(P<0.05),雷帕霉素处理后细胞侵袭活性明显下降(P <0.05),见图2。
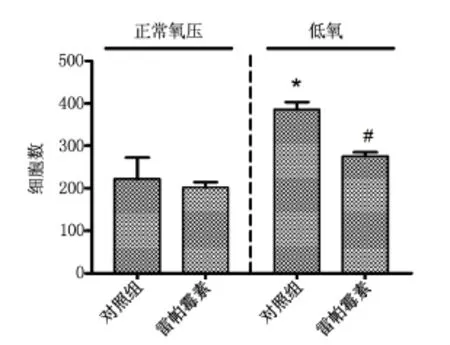
图2 低氧条件培养SGC7901细胞侵袭活性
2.3 雷帕霉素处理人 SGC7901细胞后 HIF1α及CD44的蛋白表达
与正常对照组比较,低氧条件下培养细胞HIF1α及CD44的蛋白表达水平明显升高(P<0.05),而雷帕霉素处理细胞后HIF1α和CD44表达水平均明显降低(P <0.05),见图 3。
2.4 雷帕霉素处理人 SGC7901细胞后 HIF1a及CD44的mRNA表达
与正常对照组比较,低氧条件下培养细胞HIF1α及CD44基因的mRNA表达明显升高(P<0.01),而雷帕霉素处理细胞后HIF1α和CD44表达均明显降低(P <0.01),见图4。
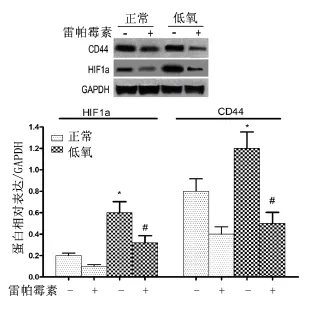
图3 低氧条件培养SGC7901细胞HIF1α及CD44的蛋白表达
3 讨论
胃癌是全世界最常见的四大肿瘤之一,虽然近几年来在美国的发生率有下降趋势,但仍是中国及西方国家常见肿瘤疾病[5]。肿瘤干细胞(Cancer Stem Cell)假说是近年来提出的1种新理论,假说认为肿瘤由肿瘤干细胞和一般肿瘤细胞组成(肿瘤的异质性),肿瘤干细胞是存在于肿瘤组织中的极少的具有自我更新、不定潜能性并促使肿瘤形成的细胞,是形成不同分化程度的肿瘤和肿瘤不断生长扩散的根源[6]。因此肿瘤干细胞理论促使我们重新审视肿瘤起始、发展和治疗中抗药性及放疗耐受的原因。
CD44是1种跨膜糖蛋白,为1种粘附分子。CD44+肿瘤细胞在无血清培养基中成球富集生长,且注射入NOD/SCID小鼠胃中及皮下,可表现出极强的成瘤能力,表现出了其自我更新及分化的干细胞潜能[7],这些提示CD44在维持其干细胞特性中起重要的作用,有学者提出将CD44作为1种胃癌肿瘤干细胞表面标记物,但其表达调控机制仍不明确。HIF1α参与调节常见肿瘤干细胞标记物CD133的表达[8],下调CD133过表达细胞系中CD133的表达。Platet等研究表明,HIF1α可介导上调人胶质瘤细胞CD133的表达[9]。
本研究结果表明,低氧条件下胃癌细胞SGC7901增殖及侵袭能力明显增强,下调细胞的HIF1α表达后,能有效降低SGC7901的增殖侵袭能力,并显著降低CD44的表达。由此可推测,低氧可能通过HIF1α调节CD44的表达,调控胃癌细胞增殖及侵袭潜能。而进一步分子信号通路机制还有待后续深入研究。

图4 低氧条件培养SGC7901细胞HIF1α及CD44的mRNA表达
[1]Xue Z,Yan H,Li J,et al.Identification of cancer stem cells in vincristine preconditioned SGC7901 gastric cancer cell line〔J〕.J Cell Biochem,2012,113(1):302-312.
[2]Keith B,Simon MC.Hypoxia-inducible factors,stem cells,and cancer〔J〕.Cell,2007,129(3):465-472.
[3]Hill RP,Marie-Egyptienne DT,Hedley DW.Cancer stem cells,hypoxia and metastasis〔J〕.Semin Radiat Oncol,2009,19(2):106-111.
[4]Wang Y,Li Z,Zhang H,et al.HIF-1α and HIF-2α correlate with migration and invasion in gastric cancer〔J〕.Cancer Biol Ther,2010,10(4):376-382.
[5]Fox JG,Wang TC.Inflammation,atrophy,and gastric cancer〔J〕.J Clin Invest,2007,117(1):60-69.
[6]Reya T,Morrison SJ,Clarke MF,et al.Stem cells,cancer,and cancer stem cells〔J〕.Nature,2001,414(6859):105-111.
[7]Takaishi S,Okumura T,Tu S,et al.Identification of gastric cancer stem cells using the cell surface marker CD44〔J〕.Stem Cells,2009,27(5):1006-1020.
[8]Matsumoto K,Arao T,Tanaka K,et al.mTOR signal and hypoxia-inducible factor-1 alpha regulate CD133 expression in cancer cells〔J〕.Cancer Res,2009,69(18):7160-7164.
[9]Platet N,Liu SY,Atifi ME,et al.Influence of oxygen tension on CD133 phenotype in human glioma cell cultures〔J〕.Cancer Lett,2007,258(2):286-290.
