桂皮醛联合伏立康唑对临床分离烟曲霉菌的体外作用研究
2015-11-15罗劲陈一强孔晋亮黄宏侯长春李冰董必英
罗劲,陈一强,孔晋亮,黄宏,侯长春,李冰,董必英
桂皮醛联合伏立康唑对临床分离烟曲霉菌的体外作用研究
罗劲,陈一强,孔晋亮△,黄宏,侯长春,李冰,董必英
目的评价桂皮醛与伏立康唑(VRC)联合应用对临床分离烟曲霉菌的体外抗菌活性。方法参照美国临床和实验室标准协会(CLSI)推荐的微量液基稀释法及棋盘法,分别测定桂皮醛、VRC单独使用及联合使用对42株临床分离烟曲霉菌的最小抑菌浓度(MIC),比较2药单用与联用的MIC50、MIC90、MIC几何均数(MICG)及MIC分布;绘制浓度-累积抑菌百分率曲线并计算分级抑菌指数(FICI),判断药物联合作用的类型。结果桂皮醛与VRC联用后,2药的MIC50、MIC90及MICG均较各自单用时明显降低(P<0.01),MIC峰值分布及浓度-累积抑菌百分率曲线较单用时左移;2药联用的FICI值为0.187 5~1.5,其中16株(38.10%)体现为协同作用,19株(45.23%)为相加作用,7株(16.67%)为无关作用,未出现拮抗作用。受试菌株对VRC的敏感性越低,2药联用的FICI均数越小。结论桂皮醛与VRC联用对临床分离烟曲霉菌的体外联合抗菌效应主要表现为协同和相加作用,且该药物组合对VRC敏感性较低的烟曲霉菌表现出较强的协同抗菌作用。
药物疗法,联合;体外研究;桂皮醛;伏立康唑;烟曲霉菌
烟曲霉菌广泛存在于周围自然环境中,是造成临床免疫力低下患者深部真菌感染的常见致病真菌之一。近年来,随着骨髓和器官移植技术的广泛开展,广谱抗生素、免疫抑制剂以及侵入性监测设备的应用,使烟曲霉菌感染呈现逐年上升趋势,其导致的侵袭性曲霉病(invasive aspergillosis,IA)病死率可高达80%~90%[1]。伏立康唑(VRC)为当前IA治疗的首选药物,其广泛应用使唑类耐药菌株不断增加,尤其是多重耐药菌株的出现,给临床IA的治疗带来极大的挑战[2]。相关研究表明,中药肉桂的单体活性成分桂皮醛具有抗烟曲霉菌作用[3],但桂皮醛与抗真菌药物联合用于抗烟曲霉菌感染少见报道。本研究旨在探讨桂皮醛在体外联合伏立康唑对烟曲霉菌临床分离株的抗菌活性,以期为IA的治疗提供新思路。
1 材料与方法
1.1菌株收集2012年10月—2014年2月于本院临床诊断为侵袭性烟曲霉菌感染的不同患者的痰、肺泡灌洗液及伤口分泌物分离的42株烟曲霉菌,其中呼吸内科28株,烧伤外科7株,重症监护病房(ICU)3株,血液科2株,内分泌科、新生儿各1株。经形态学及48℃温度实验鉴定均为经典烟曲霉菌[4]。获取标本前42株受试菌株对应患者均未接受抗真菌治疗。抗真菌治疗前严格无菌技术留取标本送检。质控菌株选用美国临床与实验室标准化协会(CLSI)M38-A2丝状真菌药敏指南(以下简称“指南”)推荐的近平滑念珠菌ATCC22019,由本院临床微生物检定中心惠赠。
1.2主要试剂与仪器桂皮醛(美国Sigma公司,批号:V900539),VRC(中国食品药品检定研究院,批号:100862-201402),马铃薯葡萄糖琼脂培养基(PDA,中国路桥技术责任有限公司),RPMI-1640粉末(Gibco公司),MOPS(美国Sigma公司),96孔板(Corning公司),二甲基亚砜(DMSO,美国Amresco公司),恒温生化培养箱(常州市伟嘉仪器制造有限公司),BHC-1300ⅡB2型生物安全柜(苏州净化设备有限公司),含0.025%Tween20的PBS液(本实验室自制)。
1.3方法
1.3.1烟曲霉菌孢子悬液及受试药物的制备将各受试菌株复苏并转种于PDA斜面,37℃孵育3~5 d,用含0.025% Tween20的PBS液冲洗斜面表面收集孢子,经MOPS缓冲后pH为7.0的RPMI-1640重悬孢子,光学显微镜下用血细胞计数板调节浓度为2×106CFU/mL。再以RPMI-1640液体培养基将其稀释100倍,得到2倍终浓度的受试孢子悬液。参照指南,将桂皮醛及VRC用100%DMSO溶解,均配制成32 000 mg/L储存液,经0.22 μm滤器滤过并分装后,于-80℃保存。
1.3.2单药最低抑菌浓度(MIC)测定参照指南推荐的微量液基稀释法分别测定桂皮醛、VRC单用对42株受试烟曲霉菌及质控菌株的MIC。其中桂皮醛的工作浓度范围为1~1 024 mg/L,VRC为0.03~16 mg/L。终点的判读:MIC定义为肉眼直接观察到的无真菌生长的最低药物浓度。实验独立重复3次。依据指南及文献[5],划分受试菌株对VRC的敏感性:VRC单用的MIC≤1 mg/L为敏感,MIC=2 mg/L为剂量依赖性敏感,MIC>2 mg/L为耐药。
1.3.3桂皮醛与VRC联合抑菌实验参照指南及2种药物单药对各受试菌株的MIC值,采用棋盘式设计法,将4× MIC~1/32×MIC 8个对倍稀释浓度的桂皮醛及VRC两两组合加入96孔板各孔中,每种药物加入量为50 μL,将100 μL制备好的孢子悬液加入各孔。生长对照孔仅含100 μL孢子悬液及100 μL RPMI-1640培养基,无菌对照孔仅含200 μL RPMI-1640培养基,35℃孵育48 h后观察结果。分别记录2药联用后产生最佳抑菌效应时各自的MIC值,作为各自联用的MIC。每个菌株均按照上述方法进行3次独立重复实验。
1.3.4联合抑菌实验结果评价(1)依据测得桂皮醛、VRC单用和联用的MIC,分别计算2药单用及联用对42株受试烟曲霉的MIC几何均数(MICG)、MIC50及MIC90,并比较MICG单用与联用的差异。(2)绘制桂皮醛、VRC单用与联用的MIC分布图,观察单用与联用MIC峰值分布情况。(3)分别统计桂皮醛、VRC单用及联用时,对所有受试菌株在各浓度点的累积抑菌百分率,以药物浓度为横坐标,累积抑菌百分率为纵坐标,绘制浓度累积抑菌百分率曲线。(4)计算桂皮醛与VRC联用的分级抑菌浓度指数(FICI):FICI=(桂皮醛联用的MIC/桂皮醛单用的MIC)+(VRC联用的MIC/VRC单用的MIC)。以FICI≤0.5为协同作用;0.5<FICI≤1为相加作用;1<FICI≤2为无关作用;FICI>2为拮抗作用,FICI值越小,协同作用越明显[5]。
1.4统计学分析采用SPSS 18.0软件进行统计分析。药物单用与联用的MICG比较采用Wilcoxon符号秩和检验,行×列表资料采用趋势卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1单药MIC测定结果桂皮醛单药对42株受试烟曲霉菌的MIC范围在64~256 mg/L;VRC单药的MIC范围在0.25~2 mg/L。每次独立实验测得VRC单药对质控菌株ATCC22019的MIC均为2 mg/L,均符合CLSI M38-A2指南的质控标准,且生长对照孔生长良好,实验结果可靠。42株受试烟曲霉菌中,4株为VRC剂量依赖性敏感株,38株为VRC敏感株。
2.2桂皮醛与VRC联合抑菌实验结果及评价
2.2.1桂皮醛、VRC单用与联用MIC及其峰值分布情况比较(1)桂皮醛与VRC联合使用对42株受试烟曲霉的MIC50、MIC90均较各自单用时低,MICG差异有统计学意义(P<0.01),见表1。(2)2药联用后的MIC峰值分布均较单用时左移,且4株VRC剂量依赖性菌株的MIC均降至<1 mg/L,即敏感范围之内,见图1。

Tab.1The MICs of Cinnamaldehyde and VRC alone or in combination against 42 iaolates of Aspergillus fumigatus表1 桂皮醛与VRC单用与联用对42株受试烟曲霉菌的MIC(mg/L)

Fig.1The MICs distribution of VRC and Cinnamaldehyde alone or in combination图1 桂皮醛、VRC单用与联用的MIC分布图(n=42)
2.2.2桂皮醛与VRC联用的浓度-抑菌百分率曲线及FICI分布(1)2药联用后的曲线与各自单用时相比,均表现为左移,即同一药物在相同浓度下,联合使用时的累积抑菌百分率比单用时高,见图2。(2)桂皮醛与VRC联用后对42株受试烟曲霉的FICI值范围在0.187 5~1.5,其中有16株(38.10%)FICI≤0.5,为协同作用;19株(45.23%)0.5<FICI≤1,为相加作用;7株(16.67%)1<FICI≤2为无关作用;未见拮抗作用。随着菌株对VRC的MIC值增高,2药联用的FICI均数越小,协同作用越明显(P<0.001),见表2。
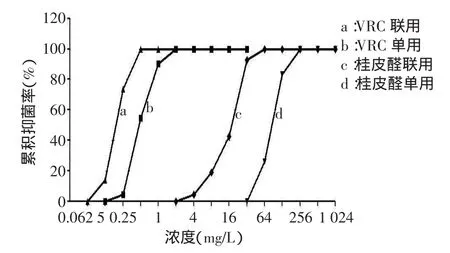
Fig.2Percentage curves of concentration-accumulative inhibition for Cinnamaldehyde and VRC alone or in combination图2 桂皮醛、VRC单用及联用的浓度-累积抑菌百分率曲线
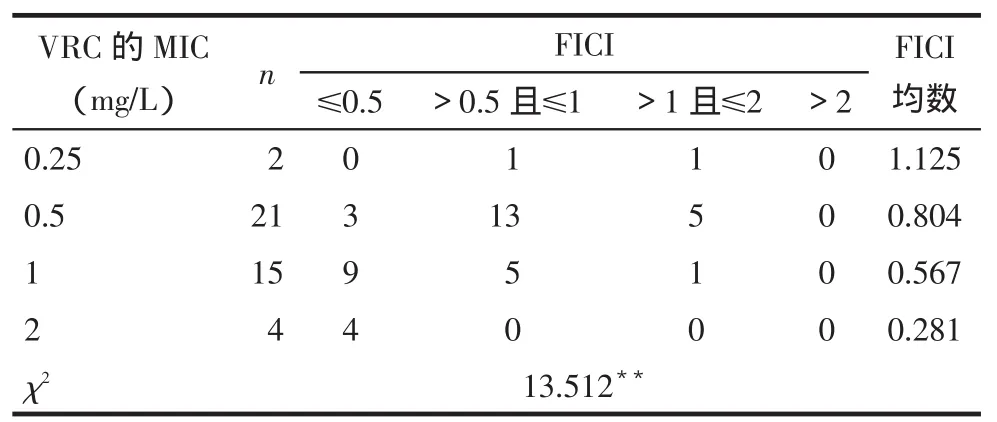
Tab.2Comparison of Cinnamaldehyde in combination with different MICs of VRC against 42 Aspergillus fumigatus iaolates表2 桂皮醛与VRC联用对VRC敏感性不同的烟曲霉菌临床分离株FICI分布
3 讨论
耐药菌株的感染是导致IA治疗失败的原因之一[2]。大剂量使用抗真菌药物,不仅无法有效杀灭耐药烟曲霉菌,还给机体带来更多的不良反应,增加患者经济负担。当前,采用联合用药的方式以及从天然中草药中寻找高效低毒的抗真菌活性成分,是解决烟曲霉菌耐药问题的理想策略。
桂皮醛是从樟科药用植物肉桂的树皮中提取的单体活性成分,属苯丙醛类化合物,且为中药复方麻黄汤的有效成分之一,具有毒性低、取材便利、价格低廉且不易诱导耐药等优点。本研究结果表明,桂皮醛单药可抑制42株来源于不同患者的烟曲霉菌,且MIC波动范围不大,证实其抗烟曲霉菌活性确切、稳定,与Khan等[3]研究结论一致。由于桂皮醛还具有挥发油特性,因此在雾化吸入型抗真菌剂的研发及呼吸道IA治疗方面具有较好的应用前景。桂皮醛与VRC联用后,2药的MIC50、MIC90、MICG均较单用时降低,MIC分布峰值左移,表明2药联用比单用抗烟曲霉菌效果更好。联用后浓度-累积抑菌百分率曲线均较各自单用时明显左移,证实联合用药具有组合效应,同一药物浓度下,联用可以抑制更多菌株的生长。由FICI分布可看出,该药物组合对绝大多数受试的烟曲霉菌均体现出协同或相加抗菌活性,提示临床上可考虑通过这两种药物的组合使用,以达到增强抗烟曲霉菌效果、提高治疗效率的目的,同时还可降低相关不良反应,防止诱导耐药的发生。进一步比较对VRC敏感性不同的菌株中FICI的分布特点发现,随着菌株对VRC的敏感性降低,FICI均值越小,协同抗烟曲霉菌作用越明显。尤其受试的4株剂量依赖性敏感烟曲霉菌,2药联用后的MIC较各自单用时下降1/4~1/8,且均表现出较强的协同作用,VRC的MIC可降低至≤1 mg/L的敏感范围之内,提示该药物组合可能具有抗VRC耐药烟曲霉菌的潜力。2药联用效果表现为无关作用主要集中在对VRC敏感性较高的菌株中。由此可见,桂皮醛与VRC联用对VRC敏感性较低的菌株比敏感性较高菌株发挥出的协同抗菌作用更强。笔者推测这一现象可能与桂皮醛在联合用药过程中发挥增敏作用,逆转菌株的耐药性有关。但由于本研究收集到VRC剂量依赖性敏感及耐药的菌株数量偏少,且分离自不同患者个体的菌株由于起源、遗传变异等因素可能会导致药物敏感性产生差异,因此证实这一推论有待今后增加样本量及对同源性VRC耐药菌株的专项研究。
VRC作为当前临床治疗IA的首选药,作用靶点相对单一,主要通过抑制烟曲霉菌细胞内14-α-去甲基酶的活性,阻断细胞色素P450介导的细胞膜主要成分麦角甾醇的合成,使菌细胞因膜缺陷而发生渗透性溶解、死亡。桂皮醛的抗真菌机制则是多途径的,不仅可以作用于细胞膜,还能破坏真菌的细胞壁,一旦与VRC联用,VRC可借助桂皮醛对细胞壁的破坏作用,更容易渗透入细胞壁内部的效应靶位[7]。桂皮醛还具有高度脂溶性,可直接穿透细胞膜,进入到菌细胞内影响菌体DNA、RNA及蛋白质的合成[8]。因此,桂皮醛与VRC联合产生协同作用的机制可能与药物作用靶点增加有关。此外,近期研究表明,烟曲霉菌对药物主动外排作用增强[9]以及形成生物被膜[10],亦为其耐药性产生的原因。目前已有文献报道,桂皮醛能抑制和破坏白色念珠菌的生物被膜,降低其耐药性[11],提示桂皮醛也有可能通过抑制和破坏烟曲霉菌生物膜,从而协同VRC发挥抗耐药烟曲霉菌的作用。目前关于桂皮醛对真菌的药物外排泵的相关作用尚少见报道,因此其联合VRC发挥协同或相加抗烟曲霉菌作用涉及的具体分子机制仍有待进一步研究。
本研究为桂皮醛联合VRC用于抗烟曲霉菌感染提供了体外实验依据,该药物组合能否真正应用于临床IA的治疗,应在后续动物体内进行药代动力学、药效学及毒理学实验加以证实。
[1]Willinger B,Lackner M,Lass-Florl C,et al.Bronchoalveolar lavage lateral-flow device test for invasive pulmonary aspergillosis in solid organ transplant patients:a semiprospective multicenter study[J]. Transplantation,2014,98(8):898-902.
[2]Lelievre L,Groh M,Angebault C,et al.Azole resistant aspergillus fumigatus:an emerging problem[J].Med Mal Infect,2013,43(4): 139-145.
[3]Khan MS,Ahmad I.In vitro antifungal,anti-elastase and anti-kera⁃tinase activity of essential oils of cinnamomum,syzygium and cym⁃bopogon species against aspergillus fumigatus and trichophyton ru⁃brum[J].Phytomedicine,2011,19(1):48-55.
[4]Balajee SA,Houbraken J,Verweij PE,et al.Aspergillus species identification in the clinical setting[J].Stud Mycol,2007,59(5):39-46.
[5]Krishnan-Natesan S,Wu W,Chandrasekar PH.In vitro efficacy of the combination of voriconazole and anidulafungin against voricon⁃azole-resistant cyp51a mutants of aspergillus fumigatus[J].Diagn Microbiol Infect Dis,2012,73(2):135-137.
[6]Espinel-Ingroff A,Diekema DJ,Fothergill A,et al.Wild-type Mic distributionsand epidemiological cutoff values for the triazoles and six aspergillus spp.for the clsi broth microdilution method(m38-a2 document)[J].J Clin Microbiol,2010,48(9):3251-3257.
[7]Khan MS,Ahmad I,Cameotra SS.Phenyl Aldehyde and propanoids exert multiple sites of action towards cell membrane and cell wall targeting ergosterol in candida albicans[J].Amb Express,2013,3(1): 54.
[8]Khan MS,Ahmad I.Antifungal activity of essential oils and their synergy with fluconazole against drug-resistant strains of aspergil⁃lus fumigatus and trichophyton rubrum[J].Appl Microbiol Biotech⁃nol,2011,90(3):1083-1094.
[9]Ramage G,Rajendran R,Sherry L,et al.Fungal biofilm resistance[J].Int J Microbiol,2012,2012(2):521-528.
[10]Kaur S,Singh S.Biofilm formation by aspergillus fumigatus[J].Med Mycol,2014,52(1):2-9.
[11]Khan MS,Ahmad I.Antibiofilm activity of certain phytocompounds and their synergy with fluconazole against candida albicans biofilms[J].J Antimicrob Chemother,2012,67(3):618-621.
(2015-02-04收稿 2015-03-25修回)
(本文编辑 陆荣展)
In vitro efficacy of the combination of Cinnamaldehyde and Voriconazole on Aspergillus fumigatus isolates
LUO Jin,CHEN Yiqiang,KONG Jinliang△,HUANG Hong,HOU Changchun,LI Bing,DONG Biying
Institute of Respiratory Disease,First Affiliated Hospital of Guangxi Medical University,Nanning 530021,China△
ObjectiveTo evaluate the in vitro antifungal activity of Cinnamaldehyde in combination with Voriconazole(VRC)against clinically isolated Aspergillus fumigatus strains.MethodsAccording to the Clinical and Laboratory Stan⁃dards Institute(CLSI)M38-A2 document,the minimal inhibitory concentrations(MIC)of Cinnamaldehyde and VRC alone or in combination against 42 clinical Aspergillus fumigatus isolates were determined by both microdillution method and check⁃board method respectively.The MIC50,MIC90,MICG and MICs distribution were compared between single drug and both in combination.The concentration-accumulative curve was drawn and fractional inhibitory concentration index(FICI)was cal⁃culated to evaluate the interaction between two test agents.ResultsThe values of MIC50,MIC90and MICG were significant⁃ly decreased(P<0.001)when combination of the two drugs than those of their single use,with their MIC distribution concen⁃tration-accumulative curves shifted to the left.The value of FICI of Cinnamaldehye-VRC combination ranged from 0.187 5 to 1.5.Sixteen strains(38.10%)of them showed the synergistic effect,19 strains(45.23%)showed additive effect,and 7 strains(16.67%)showed an unrelated effect,and no antagonist effect on tested Aspergillus fumigatus strains in vitro.Conclu⁃sionCinnamaldehye in combination with VRC mainly shows a combined synergic and additive inhibitory effect on Asper⁃gillus fumigatus isolates,and this combination appears to be more active against the test strains,which are less susceptible to voriconazole.
drug therapy,combination;in vitro;Cinnamaldehyde;Voriconazole;Aspergillus fumigatus
R978.5,R379.6
A
10.11958/j.issn.0253-9896.2015.07.020
国家自然科学基金资助项目(81260002)
广西医科大学第一附属医院呼吸疾病研究所(邮编530021)
罗劲(1989),男,硕士研究生在读,主要从事肺部感染性疾病的基础研究
△通讯作者E-mail:kongjl2013@126.com
