糖尿病足分离的铜绿假单胞菌对氨基糖苷类抗生素耐药机制探讨
2015-11-15乌洪芳孙茜李玉珠张敏孟玲玲李代清
乌洪芳,孙茜,李玉珠,张敏,孟玲玲,李代清△
糖尿病足分离的铜绿假单胞菌对氨基糖苷类抗生素耐药机制探讨
乌洪芳1,孙茜2,李玉珠1,张敏1,孟玲玲1,李代清1△
目的分析糖尿病足溃疡感染(DFI)铜绿假单胞菌(PA)的临床特点及对氨基糖苷类抗生素(AmAn)耐药的表型和基因型。方法采集本院209例DFI患者感染部位的细菌学报告及药敏结果,筛选出41株PA菌株,以聚合酶链反应(PCR)检测AmAn修饰酶基因aac(3′)-Ⅱ、aac(6′)-Ⅰb、aac(6′)-Ⅱ、ant(2′′)-Ⅰ、ant(3′′)-Ⅰ及aac(3′)-Ⅰ,结合患者的临床资料和耐药报告,对耐药基因型及耐药表型进行相关分析。结果DFI患者创面分离出的致病菌以革兰阳性(G+)菌为主(51.67%);PA的总检出率为19.62%,且是革兰阴性菌(G-)的首位致病菌(47.67%)。PA组患者溃疡面积≥4 cm2的比例高于非PA组和G+组,差异有统计学意义;与G+组相比,PA组患者缺血性溃疡、骨髓炎的发生率均较高,患者临床特点及溃疡深度评分(SAD评分)、超敏C反应蛋白增高,差异均有统计学意义。30株PA对AmAn耐药(73.17%);耐药基因检出最多的为ant(3′′)-Ⅰ(65.85%),aac(3′)-Ⅰ未检出。结论DFI患者PA检出率较高,且多见于溃疡面积较大、溃疡较深及缺血严重的患者中;PA对AmAn的耐药现象较为严重;ant(3′′)-Ⅰ是检出的最常见的耐药基因。
糖尿病足;假单胞菌,铜绿;氨基糖苷类;微生物敏感性试验;DNA限制修饰酶类
糖尿病足溃疡感染(DFI)是糖尿病足致残、致死的主要原因之一,严重威胁着糖尿病患者的生活质量[1]。近几年DFI中革兰阴性(G-)菌的检出率呈逐年上升趋势,甚至有超越革兰阳性(G+)菌的报道[2-3]。一般而言,革兰阴性杆菌和厌氧菌主要在感染严重的创面中检出[4]。铜绿假单胞菌(Pseudomonas aeru⁃ginosa,PA)对临床常用抗菌药物的耐药性亦呈现上升趋势,且PA的耐药机制很复杂,极大加重了临床治疗的困难。本研究通过分析患者的临床资料、检测PA分离菌株耐药基因,揭示PA耐药与糖尿病足溃疡感染程度间的相关性,及PA对临床上常用的氨基糖苷类抗生素(aminoglycoside antibiotics,AmAn)耐药所检测出的表型和基因型的关系,以指导临床抗生素的选择。
1 对象与方法
1.1对象收集2009年11月—2011年1月于我院糖尿病足病科住院治疗的209例DFI患者的临床资料。糖尿病足感染诊断标准采用2004年美国感染疾病学会制定的糖尿病足溃疡合并感染的临床诊治指南。
1.2方法
1.2.1细菌培养与药敏试验患者入院首次换药时,对足溃疡感染部位适度清创后,以刮除或咬剪的方式获取深部组织样本,迅速送检进行细菌培养及药敏试验。细菌鉴定参照全国临床检验操作规程进行。通过观察菌落形态、溶血环识别,革兰染色以及生化试验,分离出41株PA菌株。质控菌株ATCC27853购自卫生部临床检验中心。采用K-B纸片扩散法对我院常用的抗菌药物进行药敏试验:头孢他啶、头孢噻肟、头孢哌酮、头孢地嗪、头孢哌酮/舒巴坦、亚胺培南、氧氟沙星、左氧氟沙星、环丙沙星、阿米卡星、庆大霉素。实验操作及结果判断均按美国国家临床实验室标准化委员会(NCCLS)标准进行。
1.2.2DNA模板提取将保存于-20℃的鉴定完毕的PA菌液经血平皿37℃培养22 h后用磷酸盐缓冲液(PBS)适量稀释,然后室温下1 500×g,离心15 min,重复2次,收集细菌沉淀,以细菌DNA提取试剂盒(Axygen)提取DNA。
1.2.3应用PCR法检测基因(1)PCR反应体系。氨基糖苷类修饰酶基因的检测:扩增aac(3′)-Ⅰ,aac(3′)-Ⅱ,aac(6′)-Ⅰb,aac(6′)-Ⅱ,ant(2′′)-Ⅰ及ant(3′′)-Ⅰ6个基因。引物序列及扩增产物长度见表1。PCR扩增反应体系为:Dream Tap Green PCR Master Mix 12.5 μL、上下游引物(浓度为10 pmol/L)各1.0 μL、DNA模板5 μL以及双蒸水7.5 μL,总体积为27 μL。PCR反应条件:94℃5 min,然后94℃40 s、58℃40 s、72℃40 s,33个循环,最后72℃延伸5 min。(2)PCR产物鉴定。PCR扩增产物经1.5%琼脂糖凝胶电泳,经溴酚蓝染色后将胶块置于紫外凝胶成像仪(法国VILBER LOURMAT公司)中观察,照相保存并记录结果,出现与阳性对照片段大小相同的条带即为阳性。对于阳性条带,随机抽样进行DNA序列测定,验证扩增片段的正确性。
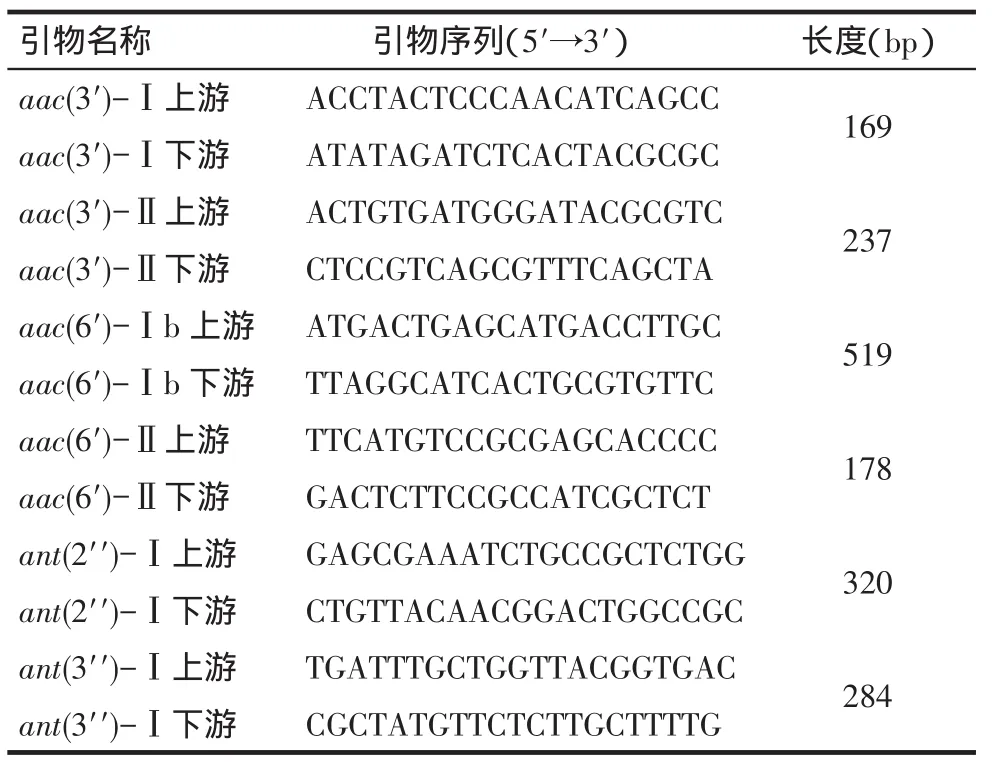
Tab.1Primer sequences and PCR product length表1引物序列及扩增产物长度
1.3统计学方法所有数据应用SPSS 21.0统计软件进行处理。计数资料以%或例表示,组间比较采用χ2检验;计量资料进行正态分布检验,非正态分布计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis H秩和检验;正态分布计量资料以表示,组间比较采用方差分析,多重比较采用LSD-t检验。检验水准为0.05;并通过Bonferroni法将χ2及秩和检验的组间多重比较的检验水准调整为0.016 7。
2 结果
2.1DFI检出的致病菌分布特点209例DFI患者中G+菌、G-菌及真菌的检出率分别为51.67%(108/ 209)、41.15%(86/209)、7.18%(15/209)。PA的总检出率为19.62%(41/209),G-菌中以PA居首位(47.67%,41/86),见表2。
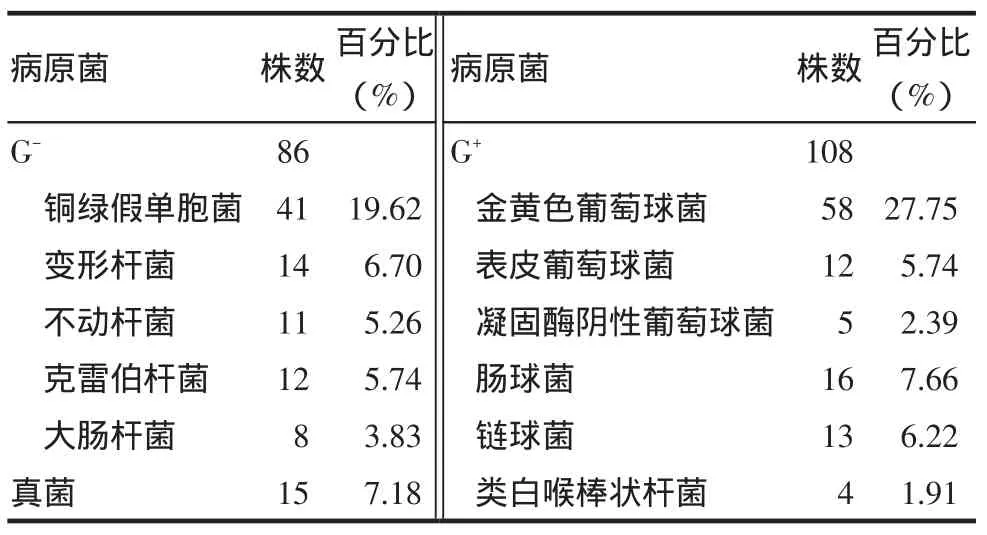
Tab.2Profile of bacteria pathogens isolated from DFI patients表2 DFI患者致病菌分布
2.2患者基本情况见表3。209例致病菌检出患者(除15例真菌外)分为G-组(86例)和G+组(108例),前者又进一步分为PA组(41例)和非PA组(45例)。PA组与非PA组及G+组相比,患者的糖基化血红蛋白(HbA1c)水平、血白细胞计数、中性粒细胞比值等均无明显差异;但PA组患者年龄,溃疡面积≥4 cm2的比例均明显大于非PA组和G+组,差异有统计学意义(P<0.05)。PA组与G+组相比,超敏C-反应蛋白(hs-CRP)增高,血红蛋白水平降低,患者临床特点及溃疡深度评分(SAD评分)增高,缺血性溃疡、骨髓炎比例均明显增高,差异有统计学意义(P<0.05或P<0.01)。
2.3DFI中PA的氨基糖苷类修饰酶基因的检出
2.3.1DFI中PA对AmAn的耐药情况及耐药修饰酶基因检测结果PA对AmAn的总耐药率高达73.17%(30/41);对庆大霉素及阿米卡星的耐药率分别为65.85%(27/41)和17.07%(7/41)。共有38株PA检出耐药基因,以ant(3′′)-Ⅰ及aac(3′)-Ⅱ检出率较高,分别为65.85%(27/41)和63.41%(26/41),未检出aac(3′)-Ⅰ。见表4、图1。
2.3.2氨基糖苷类修饰酶基因分型与其耐药表型的关系41株PA中有1株无修饰酶检出且对庆大霉素及阿米卡星均敏感,2株无修饰酶基因检出但对庆大霉素耐药。10株有修饰酶基因检出但对庆大霉素及阿米卡星均敏感,见表4。
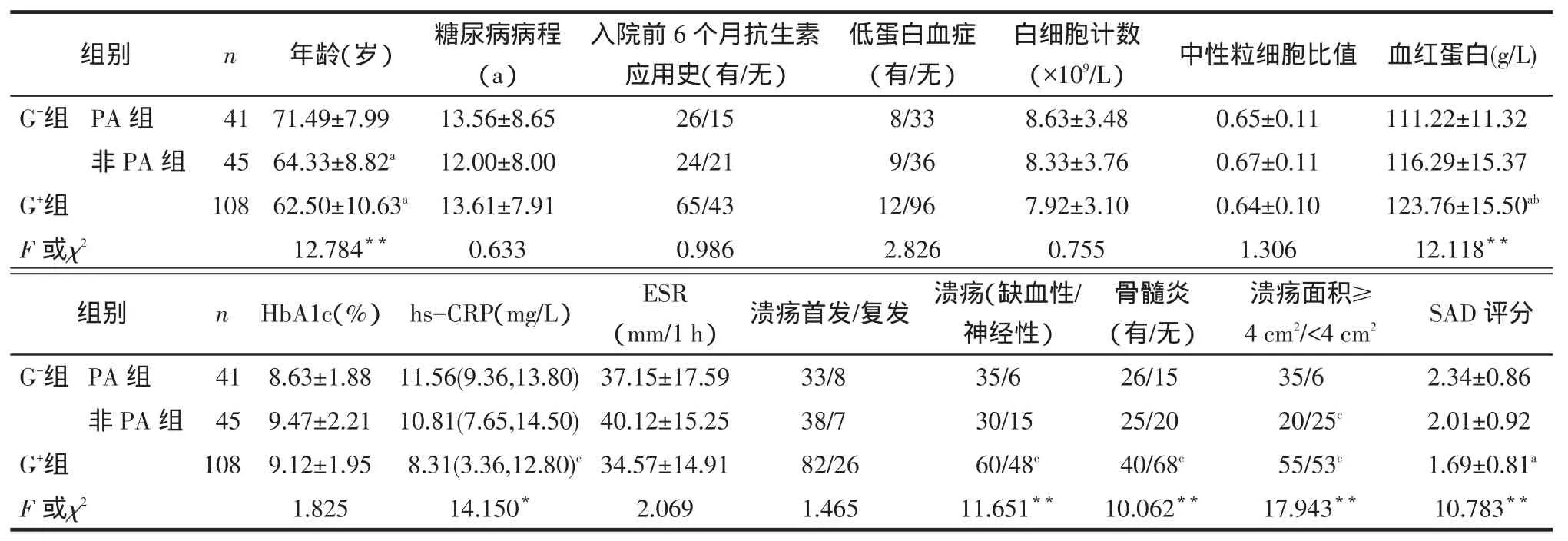
Tab.3The basic data of DFI patients表3 DFI患者基本情况

Tab.4Aminoglycoside modifying enzyme genes detection and the relationship with the resistance phenotypes表4 氨基糖苷类修饰酶基因检测情况及其与耐药表型的关系
3 讨论
糖尿病足溃疡细菌感染中的PA感染是导致足溃疡发生截肢的一个重要原因[5],PA感染也是导致下肢非创性截肢的重要原因。印度的最新资料显示PA感染在所有糖尿病足溃疡致病菌感染中占35%,土耳其一项研究显示为13%~15%[6-7]。本研究中PA的总检出率为19.62%,在足溃疡中发生率较高,与其他国家检测结果相比处于中间位置;PA检出率在G-感染中居首位,与笔者前期研究结果一致[8]。这可能与本院患者临床特点有关,如高龄、局部损伤严重(溃疡面积大、SAD评分较高及伴发骨髓炎)、缺血性溃疡伴发率较高及hs-CRP显著增高等,均为PA的生长创造了较有利的条件,但具体机制有待进一步研究。

Fig.1The expression of resistance gene mRNA in PA strains detected by gel electrophoresis图1 凝胶电泳检测PA耐药基因mRNA的表达
本研究中显示PA对AmAn的总耐药率高达73.17%,对庆大霉素及阿米卡星的耐药率也分别达到了65.86%和17.07%,与国内外相关报道有所不同[9-10]。原因可能是在使用AmAn治疗PA感染时,后者会产生较复杂的耐药机制,进而对此类抗生素不敏感,甚至产生耐药。其中由PA质粒或染色质编码表达的修饰酶可导致AmAn失活,此耐药机制最为常见。在本研究中,6种常见修饰酶基因型的检测结果显示,以ant(3″)-Ⅰ(65.85%)和aac(3′)-Ⅱ(63.41%)为主。Vakulenko等[11]报道aac(6′)-Ⅰ为最常检出的修饰酶基因,检出率大于70%;Aghazadeh等[12]报道aph(3′)-Ⅵa(90.6%)及aph(3′)-Ⅱb(61.8%)的检出率较高。以上结果的不同可能是AmAn在不同国家、不同地区的使用剂型、剂量、疗程等方面的差异及Ⅰ型整合子在不同地区流行的差异所致[13]。此外,本研究中诊治的患者年龄偏高、伴发症较多、溃疡较严重等,这些因素的差异可能促使PA中不同的耐药基因由静默态转为激活态而产生耐药。特别值得注意的是,本研究显示有10株PA对庆大霉素及阿米卡星均敏感,但均有耐药修饰酶基因检出。其原因可能是产生此酶的细菌不一定都高度耐药,有时经酶修饰后的抗生素只是部分失活,但仍具有相当的抗菌活性;或者由于细菌摄取和转运抗生素的速度远远超过药物被酶修饰的速度,因此仍有较多药物进入菌体发挥抗菌作用。
有研究曾报道过一种NDM-1耐药基因[14],该基因极易导致细菌对绝大多数抗生素产生耐药。本研究所检测的PA是否也因携带此基因而造成了严重的耐药现象尚不明确,需要进行更精细的基因测序。且出于对安全性及经济性问题的考虑,本院在治疗DFI时所选用的AmAn种类偏少,所检测的PA耐药率与选用多种此类抗生素治疗时所检测的耐药率相比有一定的差异,需要拓宽这类抗生素药敏检测的范围,得到更精确的数据,从而更好地指导临床用药。
[1]Futrega K,King M,Lott WB,et al.Treating the whole not the hole: necessary coupling of technologies for diabetic foot ulcer treatment[J].Trends Mol Med,2014,20(3):137-142.doi:10.1016/j.mol⁃med.2013.12.004.
[2]Ramakant P,Verma AK,Misra R,et al.Changing microbiological profile of pathogenic bacteria in diabetic foot infections:time for a rethink on which empirical therapy to choose[J]?Diabetologia,2011,54(1):58-64.doi:10.1007/s00125-010-1893-7.
[3]Ertugrul BM,Oncul O,Tulek N,et al.A prospective,multi-centerstudy:factors related to the management of diabetic foot infections[J].Eur J Clin Microbiol Infect Dis,2012,31(9):2345-2352.doi: 10.1007/s10096-012-1574-1.
[4]Lipsky BA,Berendt AR,Cornia PB,et al.2012 Infectious Diseases Society of America clinical practice guideline for the diagnosis and treatment of diabetic foot infections[J].Clin Infect Dis,2012,54(12):e132-e173.doi:10.1093/cid/cis346.
[5]Fujitani S,Sun HY,Victor LY,et al.Pneumonia due to pseudomo⁃nas aeruginosa Part I:Epidemiology,clinical diagnosis,and source[J].Chest,2011,139(4):909-919.doi:10.1378/chest.10-0166.
[6]Sugandhi P,Prasanth DA.Microbiological profile of bacterial patho⁃gens from diabetic foot infections in tertiary care hospitals,Salem[J].Diabetes Metab Syndr,2014,8(3):129-132.doi:10.1016/j. dsx.2014.07.004.
[7]Hatipoglu M,Mutluoglu M,Uzun G,et al.The microbiologic profile of diabetic foot infections in Turkey:a 20-year systematic review[J]. Eur J Clin Microbiol Infect Dis,2014,33(6):871-878.doi:10.1007/ s10096-014-2047-5.
[8]Shen S,Ding Q,Li DQ,et al.Clinical features and antibiotic sensi⁃tivity of Gram-negative diabetic foot osteomyelitis[J].Tianjin Medi⁃cal Journal,2013,41(12):1165-1168.[申翔,丁群,李代清,等.糖尿病足合并骨髓炎患者革兰阴性菌感染的临床特点及药敏分析[J].天津医药,2013,41(12):1165-1168].doi:10.3969/j.issn.0253-9896.2013.12.008.
[9]Qu Y,Zhang C,Cao KY,et al.Researches on the correlated resistant genes of aminoglycosides-resistant Pseudomonas aerugionsa[J].Chin J Antibiotics,2012,37(7):501-506.[屈艳,张崇,曹开源,等.耐氨基糖苷类铜绿假单胞菌相关耐药基因的研究[J].中国抗生素杂志,2012, 37(7):501-506].doi.10.3969/j.issn.1001-8689.2012.07.002.
[10]Cai PQ,Wang CX,Mi ZH.Study on the Pseudomonas aeruginosa re⁃sistance to aminoglycoside and the modifying enzyme genes[J].Chin J Microbiol and Immunol,2006,26(4):374.[蔡培泉,王春新,糜祖煌.铜绿假单胞菌氨基糖苷类耐药性及其修饰酶基因的研究[J].中华微生物学和免疫学杂志,2006,26(4):374].doi.10.3760/j: issn:0254-5101.2006.04.019.
[11]Vakulenko SB,Mobashery S.Versatility of aminoglycosides and prospects for their future[J].Clin Microbiol Rev,2003,16:430-450.
[12]Aghazadeh M,Rezaee MA,Nahaei MR,et al.Dissemination of ami⁃noglycoside-modifying enzymes and 16S rRNA methylases among Acinetobacter baumannii and Pseudomonas aeruginosa isolates[J]. MicrobDrugResist,2013,19(4):282-288.doi:10.1089/ mdr.2012.0223.
[13]Zhu YY,Yi Y,Yang X,et al.Discovery of new structure of class 1 integron in MDR Pseudomonas aeruginosa and its association with drug-resistance[J].Acta Microbiol Sinica,2013,53(9):927-932.[朱玉莹,易勇,杨犀,等.多重耐药铜绿假单胞菌中Ⅰ型整合子新结构的发现及其与耐药的相关性[J].微生物学报,2013,53(9):927-932].
[14]Kumarasamy KK,Toleman MA,Walsh TR,et al.Emergence of a new antibiotic resistance mechanism in India,Pakistan,and the UK:a molecular,biological,and epidemiological study[J].Lancet Infect Dis,2010,10(9):597-602.doi:10.1016/S1473-3099(10)70143-2.
(2014-11-13收稿 2015-01-21修回)
(本文编辑 李国琪)
Study on aminoglycoside antibiotics resistance of Pseudomonas aeruginosa isolated from diabetic foot infections
WU Hongfang1,SUN Qian2,LI Yuzhu1,ZHANG Min1,MENG Lingling1,LI Daiqing1△
1 Key Lab of Hormones&Development,Ministry of Health,Metabolic Diseases Hospital,Tianjin Medical University,Tianjin 300070,China;2 Endocrine Department of CNPC Central Hospital,Langfang of Hebei Province△
ObjectiveTo investigate the clinical features,phenotypes and genotypes of Pseudomonas aeruginosa(PA)strains isolated from patients with diabetic foot infection(DFI)resisting to aminoglycosides antibiotics(AmAn).Methods The clinical profiles of 209 DFI patients hospitalized in the Tianjin Metabolic Diseases Hospital were collected and ana⁃lyzed.Forty-one PA strains were identified,and their antibiotic resistance profiles were obtained.The DNAs of PA isolates were extracted and applied to amplifications for several aminoglycosides modifying enzyme genes,including aac(3′)-Ⅰ,aac(3′)-Ⅱ,aac(6′)-Ⅰb,aac(6′)-Ⅱ,ant(2′′)-Ⅰand ant(3′′)-Ⅰby PCR method.Combining with the clinical features and the antibiotic resistance profiles,the relationship between genotypes and phenotypes of the PA strains was analyzed.Results Gram positive bacteria(G+)were the majority of the pathogen with 51.67%detection rate.The total detection rate of PA was 19.62%,listed as the top one pathogenic bacterium among gram negative bacteria(47.67%).There was significant difference in the ratio of ulcer area≥4 cm2between PA group and non-PA group and G+group.There were significantly higher inci⁃dence rate of ischemic ulcer and osteomyelitis in PA group than those of G+group.There were higher clinical characteristics and ulcer depth(SAD)score,and increased hypersensitive C-reactive protein in PA group than those of G+group.There were 30 strains of PA being resistant to AmAn(73.17%).The predominant drug resistance gene to AmAn was ant(3′′)-Ⅰ(65.85%),and aac(3′)-Ⅰgene was not found from all PA isolates.ConclusionThe detection rate of PA isolated from DFI patients was higher,and patients were with the characteristics of larger,deeper and severe ischemia of ulcer area.The phe⁃nomenon of PA resistant to AmAn was more serious,and ant(3′′)-Ⅰgene identified from PA isolates was the most common resistance gene identified to AmAn.
diabetic foot;pseudomonas aeruginosa;aminoglycosides;microbial sensitivity tests;DNA restriction-modi⁃fication enzymes
R587.2
A
10.11958/j.issn.0253-9896.2015.07.019
1天津医科大学代谢病医院、卫生部激素与发育重点实验室(邮编300070);2河北省廊坊市,中国石油中心医院内分泌科
乌洪芳(1989),女,硕士研究生,主要从事内分泌与糖尿病学方面研究
△通讯作者E-mail:daiqingli68@126.com
