致倦库蚊卵黄羧肽酶基因与溴氰菊酯抗性关系的研究*
2015-11-12刘钦梅李春晓刁晓平廖承红赵彤言
刘钦梅 李春晓 刁晓平 廖承红 韩 谦 赵彤言**
(1. 海南大学农学院,海口 570228;2. 军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071)
长期以来,化学防治是控制蚊媒病的重要手段(Heimingweietal.,2006)。随着拟除虫菊酯类杀虫剂的长期大量使用,蚊虫对施用过的杀虫剂几乎都产生了不同程度的抗性(郭凤英等,2001;Nkyaetal.,2013)影响杀虫效果。
杀虫剂抗性是一种复杂的多基因遗传现象,只有认识杀虫剂抗性相关基因序列特征以及调控规律,才能有效阐明抗药性表型背后的分子机制,进而发展适宜的防治手段(Hemingweietal.,1993)。近年来,分子生物学技术的快速发展,寻找蚊抗药性相关新基因及其与抗药性关系,阐明抗药性的发生机制并寻找抗药性的治理方法,是科学合理地进行蚊虫防治的关键(Denholmetal.,2002)。
卵黄羧肽酶基因(Vitellogenic carboxypeptidase,VCP),属于S10肽酶家族,其功能和丝氨酸羧肽酶相似。分子量大小在40与75 kDa之间,高等动植物和真菌中都有分布。在pH<7的环境下,丝氨酸蛋白酶具有C末端蛋白水解酶脱酰胺酶和酯酶的活性,参与多种蛋白质及多肽的加工修饰与降解等代谢过程(Schaller,2004),如昆虫及其他哺乳动物肠道中食物蛋白质的初步消化(Bownetal.,1998)、昆虫生长、发育、蜕皮和变态等生长发育过程等(Suietal.,2009),以及小麦等植物种子体内储藏蛋白的调用。
本研究采用实时荧光定量PCR的方法检测VCP基因在敏感株、野外株和抗性株致Culexpipiensquinquefasciatus中的表达,探讨VCP与蚊抗性的关系。
1 材料与方法
1.1 供试蚊虫
敏感株蚊虫采自广东广州,在军事医学科学院微生物流行病研究所媒介生物学和防治研究室常规饲养10年以上,未接触任何杀虫剂的致倦库蚊。野外株致倦库蚊F22代是从海南三亚采集于实验室传代饲养得到。为了得到更高的抗药性,以溴氰菊酯LC50浓度对于野外株的Ⅳ龄幼虫用药,经过其间5代筛选得到抗性株F22代致倦库蚊。
蚊虫养殖条件为:温度(26±1)℃、相对湿度(65±5)%、光照∶黑暗=14 h∶10h,成蚊喂食8%糖水。
1.2 生物测定
采用WHO幼虫浸渍法(Cetinetal.,2005),具体操作步骤:首先将杀虫剂(拟除虫菊酯类杀虫剂溴氰菊酯,浓度98%购自上海农药研究所)原液用丙酮(分析纯)配制成5~10个浓度梯度。每个容器(纸杯)中加99 mL过夜脱氯水,之后加1 mL不同浓度梯度的药液,对照组加入1 mL丙酮。其次,挑选30条Ⅲ龄末或Ⅳ龄初幼虫,连同脱氯水共量取100 mL加入药液杯中。24 h后观察实验结果,并且记录死亡数(以幼虫不能逃避机械刺激为死亡)。实验重复3次。最后,将蚊虫放入温度(26±1)℃、相对湿度(65±5)%的实验室中。
1.3 致倦库蚊VCP基因的定量分析
1.3.1引物合成:根据GenBank数据库中致倦库蚊的VCP基因序列(CPIJ008608)和核糖体蛋白L8基因序列(XP_001841927),在NCBI-Primer-BLAST里设计特异性引物,VCP基因引物序列:上游为:5’-A C G C T C A A C T T C T C G G G T CG-3’,下游为:5’-T G A T C A G A T C C A G C G C C C AC-3’; RPL8基因引物序列:上游为:5’-G T G G A A A G G G A G A C G A G A A G TT-3’,下游为:5’-C G C A G A A C G A A C C G A A T CT-3’,引物由英潍捷基(上海)贸易有限公司合成。
1.3.2致倦库蚊整体cDNA的获得:按照全式金公司TransZol Up Plus RNA Kit试剂盒说明书提取总RNA;1.5% TAE琼脂糖凝胶电泳检测提取的RNA的完整性,紫外分光光度计测量提取的RNA的浓度与纯度;使用全式金公司TransScript Ⅱ All-in-One First-Strand cDNA Synthesis SuperMix for qPCR反转录试剂盒反转录,体系如下:5×TransScript Ⅱ All-in-One SuperMix for qPCR 4 μL,gDNA Remover 1 μL,RNase-free Water 补全到体积20 μL,总RNA 1 μg;反应条件如下:50℃ 15 min,85℃ 5 s,4℃,保存。得到cDNA溶液-20℃保存。
1.3.3致倦库蚊VCP基因和RPL8基因的扩增:利用全式金TransStart TopTaq DNA Polymerase通过PCR扩增内参基因与目的基因,PCR反应体系总体积50 μL,包括模板cDNA 1 μL,上游引物(10μmol/L) 1 μL,下游引物(10 μmol/L)1 μL,10×TransStart TopTaq Buffer 5 μL,2.5 mmol/L dNTPs 4 μL,TransTaq TopTaq DNA Polymerase 1 μL,ddH20 37 μL。反应条件为95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min;4℃保存。取5 μL PCR产物使用1.5%TAE琼脂糖凝胶电泳检测扩增结果,将PCR产物直接送往华大测序公司进行测序,测序结果进行BLAST比对鉴定。
1.3.4PCR产物的克隆、测序和鉴定:将剩余PCR产物用全式金EasyPure PCR Purification Kit试剂盒说明书进行纯化,分别将两条基因PCR纯化产物与pEASY-T1 Simple载体连接,蓝白斑筛选出的阳性克隆经检测后送公司测序,测序结果进行BLAST比对鉴定。
1.3.5制备VCP和RPL8基因标准品,构建标准曲线:按照全式金EasyPure HiPure Plasmid MiniPrep Kit试剂盒说明书提取重组质粒,测定质粒浓度,计算拷贝数,按10倍梯度逐级稀释制备标准品。反应体系总体积20 μL,包括2x TransStart Top Green qPCR SuperMix 10 μL,模板cDNA 1 μL,上游引物 (10 μmol/L) 0.4 μL,下游引物(10 μmol/L) 0.4 μL,ddH2O 8.2 μL。反应条件为95℃ 30s;95℃ 5s,60℃ 15 s,72℃ 10 s,45个循环;熔解曲线反应条件为:95℃ 15 s,60℃ 1 min,95℃ 15 s。
1.3.6三种株致倦库蚊VCP基因和RPL8基因的定量分析:构建标准曲线后,采用RPL8基因的拷贝数对VCP基因的拷贝数进行校正,比较VCP基因在致倦库蚊敏感株、野外株、抗性株之间表达量的差异倍数。
1.4 数据分析
采用SPSS 13.0软件中的回归分析中概率分析对数据进行分析,获得致死中浓度LC50值和95%置信区间。采用GraphPad Prism 5单因素方差分析中的Turkey法对3种株拷贝数进行分析。
2 结果
2.1 三种株致倦库蚊幼虫对溴氰菊酯抗性检测结果
和敏感株相比,其他2种株致倦库蚊对溴氰菊酯均产生了很高的抗性,野外株和抗性株对溴氰菊酯的抗性差异倍数分别为682与74 144倍(表1)。
2.2 三株致倦库蚊总RNA电泳检测
结果显示,三种致倦库蚊总RNA的条带明亮、清晰、锐利,可用于后续实验(图1)。

表1 三种株致倦库蚊溴氰菊酯的抗性水平Tab.1 Levels of deltamethrin resistance in three Cx.pipiens quinquefasciatus
SS:敏感株;FS:野外株;RS:抗性株。
S:Sensitive strain;F:Field strain;R:Resistant strain.

图1 致倦库蚊总RNA扩增电泳图Fig.1 Electrophoresis of Cx.pipiens quinquefasciatus RNAM: Trans2K Plus П DNA Marker;1-3:野外采集株;4-6:敏感株;7-9:抗性株。M: Trans2K Plus П DNA; 1-3: Field strain; 4-6: Sensitive strain; 7-9: Resistant strain.
2.3 致倦库蚊VCP基因与管家基因RPL8的扩增结果
以致倦库蚊野外抗性株cDNA为模板,特异性引物扩增致倦库蚊VCP、RPL8片段大小分别为175、98 bp,测序结果与预期结果相符(图2)。
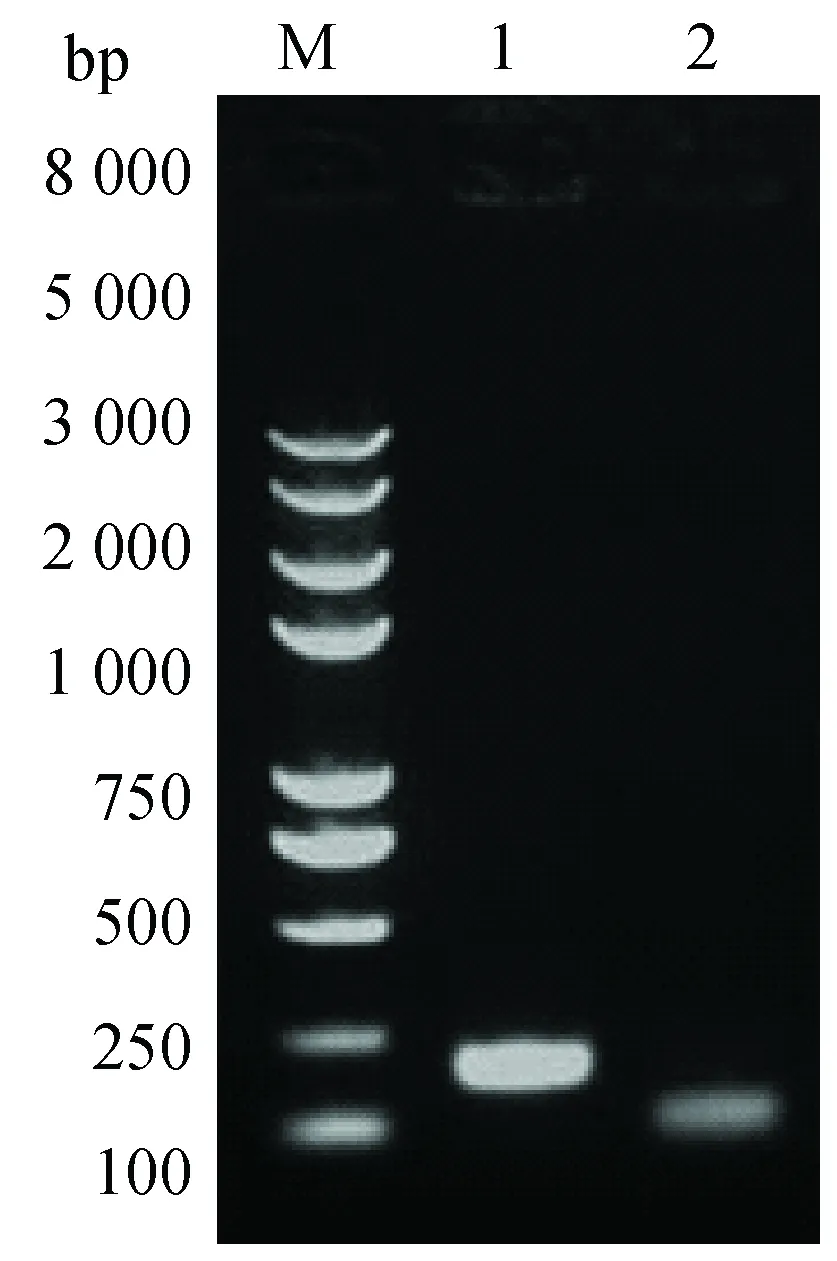
图2 致倦库蚊基因扩增产物电泳图Fig.2 Electrophoresis of PCR products of Cx.pipiens quinquefasciatus genes fragmentM: Trans2K Plus П DNA Marker;1:VCP基因扩增条带;2:RPL8基因扩增条带。M: Trans2K Plus П DNA;1: VCP amplification band; 2: RPL8 amplification band.
2.4 标准曲线和熔解曲线的制作
致倦库蚊VCP和RPL8重组质粒的浓度和OD比值分别为:195 ng/μL,A260/280=1.733;485 ng/μL,A260/280=1.732。将质粒浓度换算成拷贝数后,10倍浓度稀释用于制作标准曲线和熔解曲线,每个反应重复3次。得到VCP基因标准曲线方程y=-3.795×Log(x)+56.05,R2=0.996, 扩增效率E=83.4%;内参基因标准曲线方程y=-3.150×Log(x)+43.55,R2=1.000,扩增效率E=107.7%。从标准曲线斜率可知VCP和RPL8基因的扩增效率较高,并且熔解曲线表明VCP和RPL8基因都不存在非特异性扩增。
2.5 三种致倦库蚊VCP基因表达量分析
对致倦库蚊敏感株、野外株和抗性株中VCP基因拷贝数进行定量分析,结果见表2和图3。结果显示,VCP基因在敏感株中的表达量比野外株高,差异具有显著性;野外株中的表达量比抗性株高,差异达到显著性。
2.6 VCP基因的表达量与对溴氰菊酯的抗药性之间的关系
将致倦库蚊不同株对溴氰菊酯的LC50值(RR值为抗性指数:三种株以敏感株LC50值为底数,其RR值分别为1、682、74144)和VCP的cDNA基因的拷贝数均取对数后,相关性分析结果显示两基因的表达量之间存在着显著的负相关关系(图4)。

表2 VCP基因在致倦库蚊敏感株、野外株和抗性株的表达量Tab.2 The VCP expression level in sensitive, field and resistant of Cx.pipiens quinquefasciatus
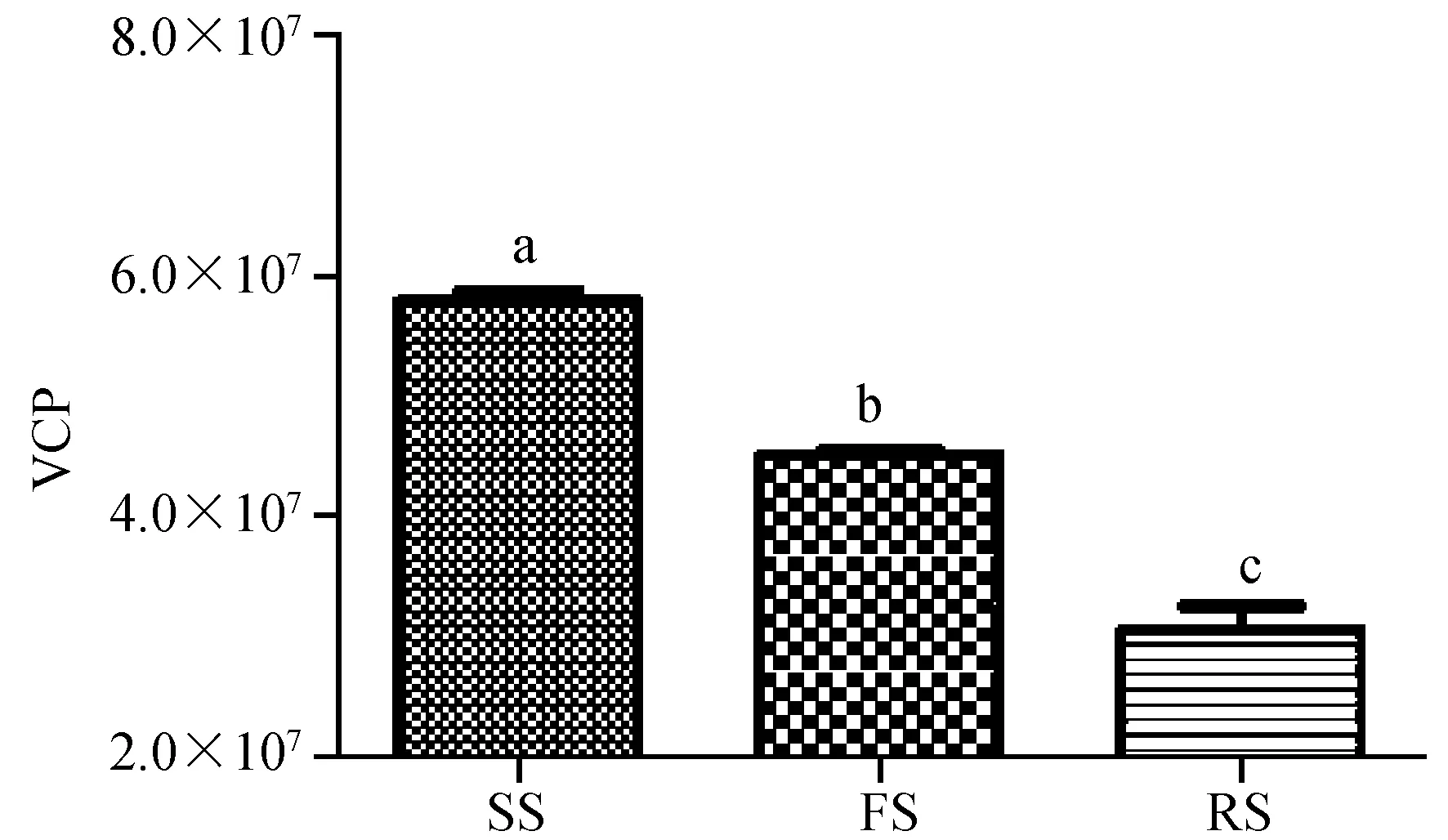
图3 不同株中VCP基因表达拷贝数Fig.3 The expression level of VCP genes in different strainsSS:敏感株;FS:野外株;RS:抗性株。 SS:Sensitive strain;FS:Field strain;RS:Resistant strain.
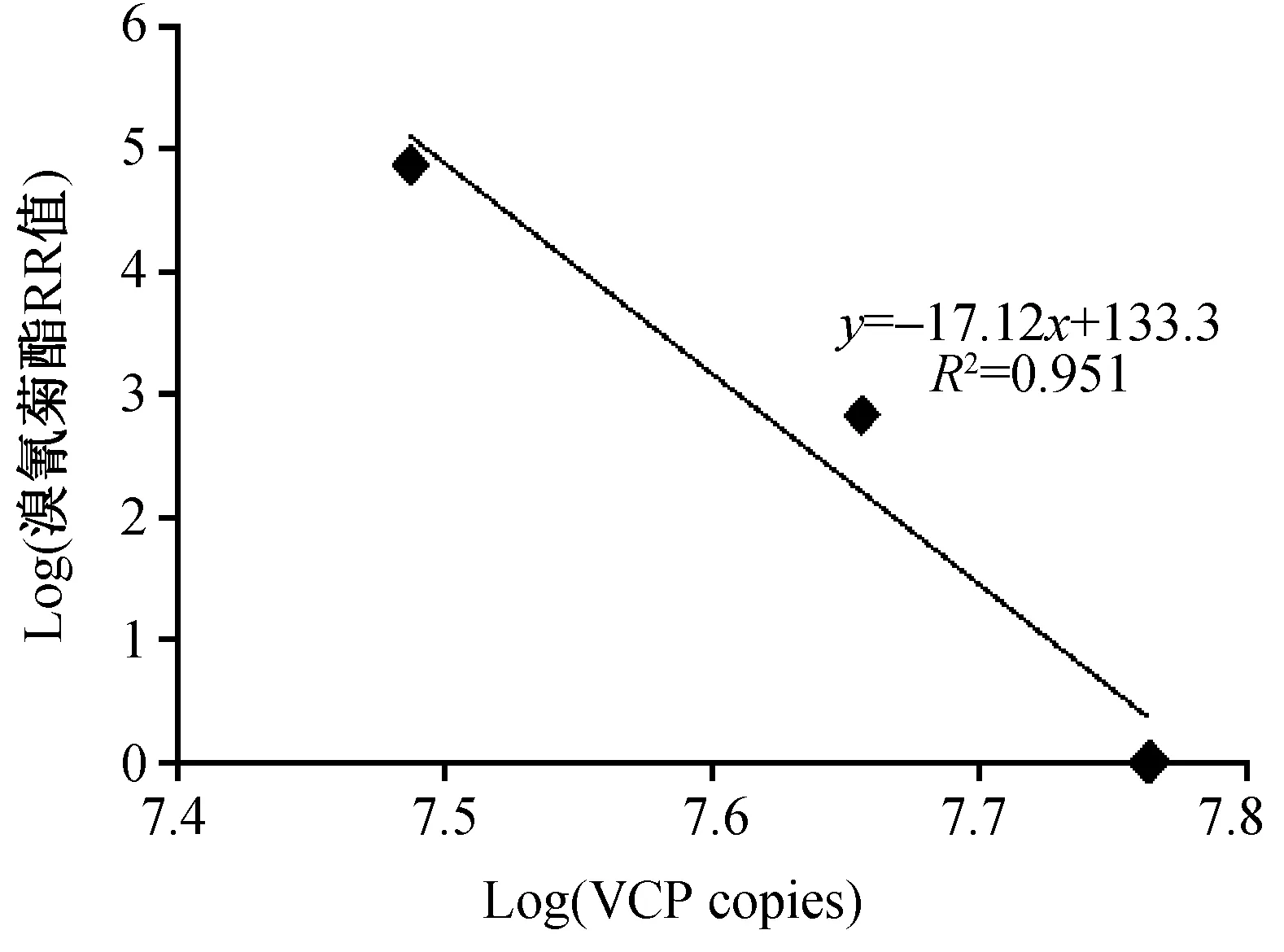
图4 三种致倦库蚊溴氰菊酯RR值与VCP基因拷贝数的相关性分析Fig.4 Relationship between VCP copies of three Cx. pipiens quinquefasciatus strains and the prevalence of the resistance ratio of deltamethrin
3 讨论
抗性的产生是多种因素综合的结果,其中代谢相关酶表达或活性的增加是导致杀虫剂抗性产生的最重要机制(Davidetal.,2005)。到目前为止,人们已证实一些代谢酶家族成员与蚊对杀虫剂的代谢抗性相关,如细胞色素P450(P450s)、谷胱甘肽S转移酶(GSTs)和乙酰胆碱酯酶等(Nkyaetal.,2013)。
在植物中,丝氨酸羧肽酶主要参与其生长、细胞凋亡及种子发育等生理过程(Cercosetal.,2003)。但是在昆虫中对其研究相对较少,只有少数几个丝氨酸羧肽酶的序列及生理学功能得到鉴定。昆虫生长发育过程中丝氨酸蛋白酶是必需生化酶类,如在埃及伊蚊雌蚊的脂肪体内可以合成一种丝氨酸羧肽酶,以酶原形式在卵母细胞中存在,并在卵中形成活性形式为胚胎生长发育运输卵黄蛋白(Choetal.,1991)。最近有研究结果表明,通过在昆虫的中肠蛋白酶表达水平高低或类型的改变从而对杀虫剂是否降解或者降解程度的不同使昆虫对杀虫剂产生抗性(张雅昆等.,2013)。
荧光定量PCR结果证明,VCP基因在敏感株致倦库蚊表达量显著高于野外株,野外株也显著高于抗性株。推测在致倦库蚊中,抗性株丝氨酸羧肽酶受到抑制,由于杀虫剂的持续作用,致倦库蚊体内保幼激素发生变化,间接使致倦库蚊成虫体内卵黄发生受到影响,使得抗性种群的丝氨酸羧肽酶表达量降低。
本实验结果提示VCP基因在致倦库蚊对杀虫剂产生抗性的机制中存在一定作用,可做为新的耐药性治理备选基因及耐药性检测靶标,为昆虫抗药性机理研究及抗药性的分子检测提供了新的研究方向。
