美拉德反应修饰改善猪血浆蛋白抗氧化肽功能特性的研究
2015-11-11
美拉德反应修饰改善猪血浆蛋白抗氧化肽功能特性的研究
刘骞1,牛海力1,李菁1, 2,卢岩1,耿蕊1,孔保华1*,李东海1
(1.东北农业大学食品学院,哈尔滨150030;
2.哈尔滨市产品质量监督检验院,哈尔滨150036)
摘要:研究主要探讨美拉德反应修饰对猪血浆蛋白抗氧化肽功能特性的影响。采用D-半乳糖对猪血浆蛋白抗氧化肽进行美拉德修饰,蛋白质和糖的比例为1ϑ3(W/W),在90℃水浴中分别加热0、1和6 h,得到美拉德反应产物(MRPs),测定其溶解性、表面疏水性、乳化性及乳化稳定性、起泡性及起泡稳定性。结果表明,经美拉德反应修饰后猪血浆蛋白抗氧化肽的功能特性有明显改善,其溶解性、乳化及乳化稳定性、起泡及起泡稳定性均随反应时间增加而逐渐增大(P<0.05),表面疏水性则随反应时间增加而降低(P<0.05)。同时,MRPs功能特性随体系中pH的改变而显著变化(P<0.05)。因此,采用美拉德修饰改善猪血浆蛋白抗氧化肽功能特性,可使其广泛应用于食品加工业。
关键词:猪血浆蛋白抗氧化肽;D-半乳糖;美拉德反应修饰;功能特性
网络出版时间2015-1-27 15:59:46
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150127.1559.003.html
刘骞,牛海力,李菁,等.美拉德反应修饰改善猪血浆蛋白抗氧化肽功能特性的研究[J].东北农业大学学报, 2015, 46(2): 18-23. Liu Qian, Niu Haili, LI Jing, et al. Improvement of functional properties of procine plasma protein antioxidant peptides via maillard reaction modification[J]. Journal of Northeast Agricultural University, 2015, 46(2): 18-23. (in Chinese with English abstract)
目前,利用不同蛋白资源开发蛋白肽成为研究热点。研究表明蛋白质经过酶解后会产生具有抗氧化活性的抗氧化肽,已有研究包括乳清蛋白[1]、玉米蛋白[2]、猪血浆蛋白[3]、卵白蛋白[4],肌肉蛋白[5],大豆蛋白[6],马铃薯蛋白[7],以及荞麦蛋白[8]等。与其他生物分子如氨基酸、大分子蛋白质等相比,抗氧化肽具有天然、高效以及安全性高等优点。但相关研究表明,抗氧化肽的功能特性(尤其是乳化性、起泡性和凝胶性等等)由于酶解作用而丧失很多,直接影响其在食品体系中应用[9-10]。因此,有必要通过适当的改性技术,使抗氧化肽的功能性得到显著改善,使其具有更好的应用前景。
美拉德修饰(Maillard reaction modification)是一种在食品加工过程中广泛存在的非酶褐变反应,主要是指食品中的羰基化合物(还原糖类)和氨基化合物(氨基酸和蛋白质)间发生复杂反应[11],又称美拉德或者羰胺反应。美拉德修饰对食品的品质极其重要,会在色泽、风味、营养价值以及功能特性等方面影响食品的品质[12]。Saeki通过葡萄糖对鲤鱼肌原纤维蛋白进行美拉德修饰,研究结果表明肌原纤维蛋白的乳化能力显著增强[13]。Liu等将花生分离蛋白与D-核糖在加热条件下发生美拉德反应[14],研究结果表明花生分离蛋白的乳化性和热稳定性显著增强。通过以上文献综述可知,大部分学者都在致力于研究美拉德修饰对蛋白质功能特性的促进作用及其机制,但鲜少有人研究美拉德修饰对抗氧化肽功能特性的改善与促进。因此,在前期研究基础之上[15],本试验利用D-半乳糖对猪血浆蛋白抗氧化肽进行美拉德修饰,探讨抗氧化肽美拉德反应产物(Maillard reaction products,MRPs)功能特性变化,为猪血浆蛋白抗氧化肽在食品工业中的广泛应用提供理论依据。
1 材料与方法
1.1材料
猪血浆蛋白粉购于黑龙江省北大荒肉业,蛋白质含量为70%;碱性蛋白酶Alcalase购买于Novo公司;D-半乳糖,8-苯氨基-萘酚-磺酸(ANS),十二烷基磺酸钠(SDS)购于美国Sigma试剂公司;大豆色拉油购于上海嘉里粮油工业有限公司;其他试剂均为国产分析纯。
1.2仪器与设备
FE20KpH计(上海梅特勒-托利多仪器设备有限公司);JD500-2电子天平(沈阳龙腾电子称量仪器有限公司);AL-104型精密电子天平(上海梅特勒-托利多仪器设备有限公司);UT-1800紫外可见分光光度计(北京普析通用仪器有限公司)、DK-8B电热恒温水浴锅(上海精宏实验设备有限公司);JJ-1精密增力电动搅拌器(常州国华电器有限公司);FD-2A冷冻干燥机(北京博医康试验仪器有限公司);AM-1磁力搅拌器(北京鼎昊源实验仪器有限公司);F-4500荧光分光光度计(日本日立公司);T-18Basic内切式匀浆机(德国IKA公司)。
1.3方法
1.3.1猪血浆蛋白抗氧化肽的制备
参照Liu等的方法制备猪血浆蛋白抗氧化肽[3]。将猪血浆蛋白粉溶解后(40 mg·mL-1),经90℃水浴中预热5 min,调节溶液pH、温度至碱性蛋白酶最适条件(对于碱性蛋白酶,最适pH 8.0,最适温度为55℃),添加碱性蛋白酶的量与底物之比为2ϑ100(g·g-1)。水解过程中不断加入1 mol·L-1NaOH,使溶液pH保持恒定,记录耗碱量(mL),水解时间为5 h。待水解结束后,用1 mol·L-1HCl把水解液的pH调为7.0,然后在95℃水浴中加热5 min使酶灭活,得到猪血浆蛋白抗氧化肽(PPPH)。真空冷冻干燥水解液,得浅黄色粉末状固体,将冻干样品密封于4℃下保存。
1.3.2美拉德反应产物的制备
按照Li等方法[15],将猪血浆蛋白抗氧化肽溶解,使之蛋白浓度为20 mg·mL-1。称取一定量的D-半乳糖,加入蛋白溶液中,使反应体系中蛋白与糖的比例为1ϑ3。取上述溶液10 mL转移到25 mL具塞试管中,盖紧。在90℃水浴中分别加热0、1和6 h,然后立即放入冰水中冷却。将获得的MRPs进行真空冷冻干燥,得黄色粉末状固体,将冻干样品密封于4℃下保存,用于分析其功能特性。1.3.3溶解性的测定
称取200 mg不同反应时间的MRPs样品,分别在20 mL pH 3.0~8.0的缓冲溶液中溶解。用磁力搅拌器在室温下搅拌30 min,4 000 r·min-1离心20 min,转移上清液,上清液中蛋白质含量用双缩脲法进行测定。样品中总蛋白含量用凯式定氮法测定。然后用以下公式进行计算:
溶解性(%)=(A/B)×100%
式中,A表示上清液中蛋白含量;B表示水解样品中总蛋白含量。
1.3.4表面疏水性的测定
参照Akita等方法[16]。不同反应时间的MRPs样品用pH 3.0~8.0的缓冲溶液溶解成浓度为1, 5, 8, 10和20 mg蛋白/100 mL的溶液。每3 mL的蛋白溶液加入5 μL的ANS溶液(8 mmol·L-1)。使用1 cm样品池,利用F4500荧光分光光度计测量。测量条件为:激发波长374 nm,发射波长485 nm,狭缝宽选择10 nm,在室温20℃下测定。被溶解的MRPs样品的疏水性值(R)由相对荧光值H0与蛋白浓度(g·L-1)的比值计算。
参照Pearce等方法[17],稍作修改。称取60 mg不同反应时间的MRPs样品,在pH 3.0~8.0的缓冲溶液中溶解。在室温下(25℃)用磁力搅拌器搅拌30 min。分别加入10 mL大豆色拉油。用内切式匀浆机在20 000 r·min-1条件下分散乳化1 min。分别在乳化后0、10 min取50 μL乳状液于试管中,加入5 mL 0.1%SDS混匀,在500 nm时测定吸光度,乳化性及乳化稳定性用如下公式计算:
乳化活力指数EAI(m2·g-1)=(2×2.303×A0)/[0.25×Protein weight(g)]
乳化稳定指数ESI(min)=A0×Δt/ΔA
式中,A0、A10为乳状液在0和10 min时吸光度;ΔA=A0-A10;Δt=10 min
1.3.6起泡性及起泡稳定性的测定
参照Klompong等方法[18]。称取100 mg不同反应时间MRPs样品,用20 mL pH 3.0~8.0的缓冲溶液溶解。用磁力搅拌器在室温下搅拌30 min。将全部溶液转移至50 mL量筒内,读出此时溶液体积(V1),然后将溶液转移到烧杯中,用内切式匀浆机在20 000 r·min-1下搅打2 min,然后马上转移到50 mL量筒中读出体积(V2)。
起泡性(%)=(V2/V1)×100%
回家的一路,阿里都在车上打瞌睡。他起得很早,于是困了。阿里在梦中不仅见到了母亲,并且还得到许多好吃的东西。于是他脸上浮出笑容。车晃动着,阿里睡着的头随着汽车颠簸的节奏一甩一甩。阿东便伸手将他的头靠在自己肩头。阿里立即以一种惬意的方式枕着阿东,他连醒都没醒。
经搅打形成的泡沫静止放置60 min后,读出泡沫的体积记为(V3)。
起泡稳定性(%)=(V3/V2)×100%
1.4数据统计分析
每个试验重复3次,结果表示为Mean±SD。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用Sigmaplot 11.0软件作图。
2 结果与分析
2.1美拉德修饰对猪血浆蛋白抗氧化肽溶解性影响
由图1可知,随着美拉德反应修饰时间的延长,PPPH与D-半乳糖形成的MRPs的溶解性也随之增大(P<0.05),并且反应修饰6 h的样品的溶解性显著高于其他处理组(P<0.05)。同时,在不同的pH值范围内(3.0~8.0),反应修饰6 h的样品的溶解性均超过86.1%,随着美拉德反应的进行,半乳糖和蛋白肽逐渐通过次级力形成较弱的复合物,有利于蛋白的溶解[19]。由于等电点缘故,所有处理组的样品在pH为5.0时,溶解性均达到最低点,而在其他pH条件下溶解性均高于84.5%。
2.2美拉德修饰对猪血浆蛋白抗氧化肽表面疏水性的影响
由图2可知,随着美拉德反应修饰时间的延长,各处理组得到的MRPs的表面疏水性随之降低(P<0.05),反应修饰6 h的样品表面疏水性显著低于其他处理组(P<0.05)。另外,不同pH对表面疏水性影响显著(P<0.05),在pH为3.0时,表面疏水性均达到最大,随着pH增大,各样品表面疏水性逐渐降低(P<0.05)。
2.3美拉德修饰对猪血浆蛋白抗氧化肽乳化性以及乳化稳定性的影响
蛋白质的乳化特性通常用乳化活力指数(EAI)和乳化稳定指数(ESI)表示。由图3可知,与D-半乳糖发生美拉德反应修饰后,所得MRPs的EAI和ESI均有不同程度改善,随着美拉德反应修饰时间的延长,乳化性和乳化稳定性的改善程度随之增加(P< 0.05)。pH对EAI和ESI的影响与对溶解性的影响一致,不同反应修饰时间的MRPs在pH为5.0时,其EAI和ESI均达到最低。Klompong等研究发现[18],较高的溶解性会促进肽在乳化相中的分散和吸附。当体系的pH为5.0时,MRPs溶解性降到最低,从而使得大分子在乳化相的活动受到限制,致使乳化性和乳化稳定性降低。
2.4美拉德修饰对猪血浆蛋白抗氧化肽起泡性以及起泡稳定性的影响
结果见图4。
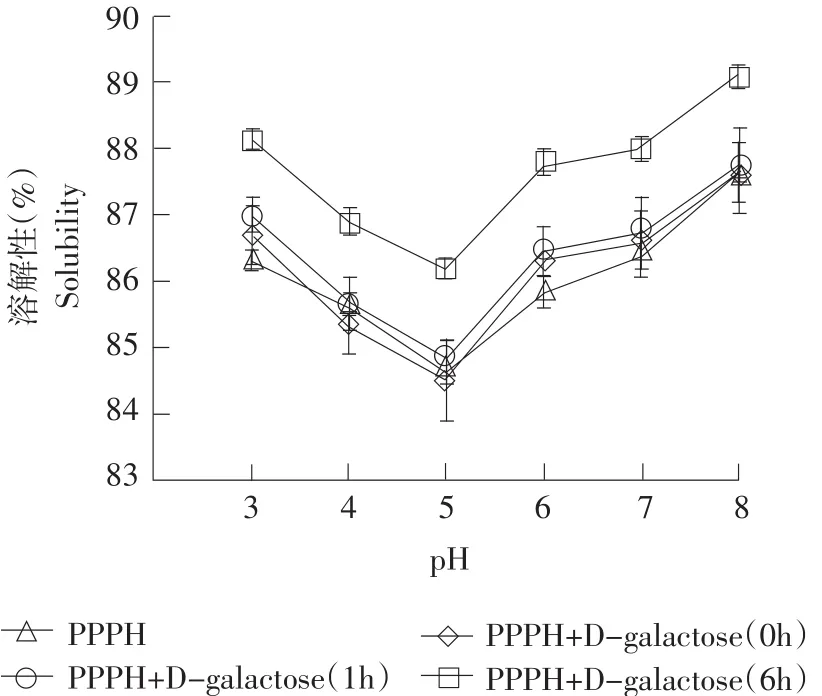
图1 pH对不同美拉德反应修饰时间的猪血浆蛋白抗氧化肽溶解性的影响Fig. 1 Solubility of porcine plasma protein antioxidant peptides modified using Maillard reaction with differentreaction times as influenced by pHs
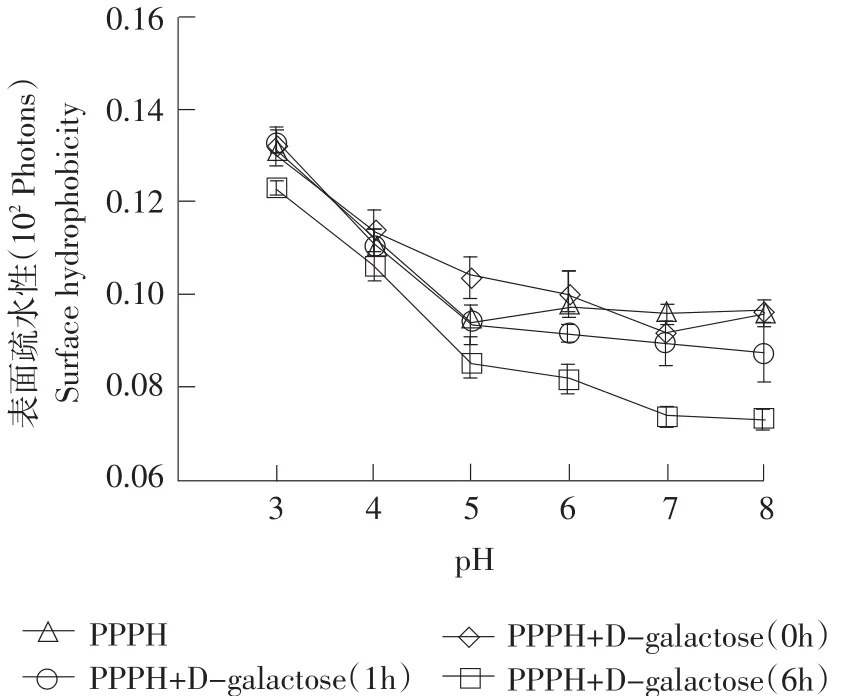
图2 pH对不同美拉德反应修饰时间的猪血浆蛋白抗氧化肽表面疏水性的影响Fig. 2 Surface hydrophobicity of porcine plasma protein antioxidant peptides modified using Maillard reaction withdifferent reaction times as influenced by pHs
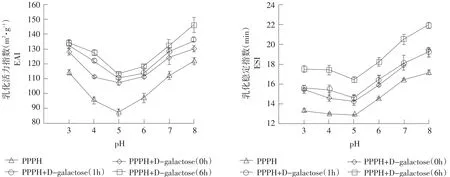
图3 pH对不同美拉德反应修饰时间的猪血浆蛋白抗氧化肽乳化性和乳化稳定性的影响Fig. 3 Emulsifying activity index (EAI) and emulsion stability index (ESI) of porcine plasma protein antioxidant peptides modified using Maillard reaction with different reaction times as influenced by pHs
经过美拉德反应修饰的PPPH相对于未处理的样品,随着反应修饰时间的延长,起泡性和起泡稳定性均显著提高(P<0.05)。其中,反应6 h的样品提高幅度最大(P<0.05)。当pH为5.0时,各处理组样品的起泡性和起泡稳定性最差(P<0.05),而且在pH 为8.0时的碱性条件下,各处理组样品的起泡性和起泡稳定性均达到最大(P<0.05),可见起泡性和起泡稳定性与样品的溶解度有一定关联。
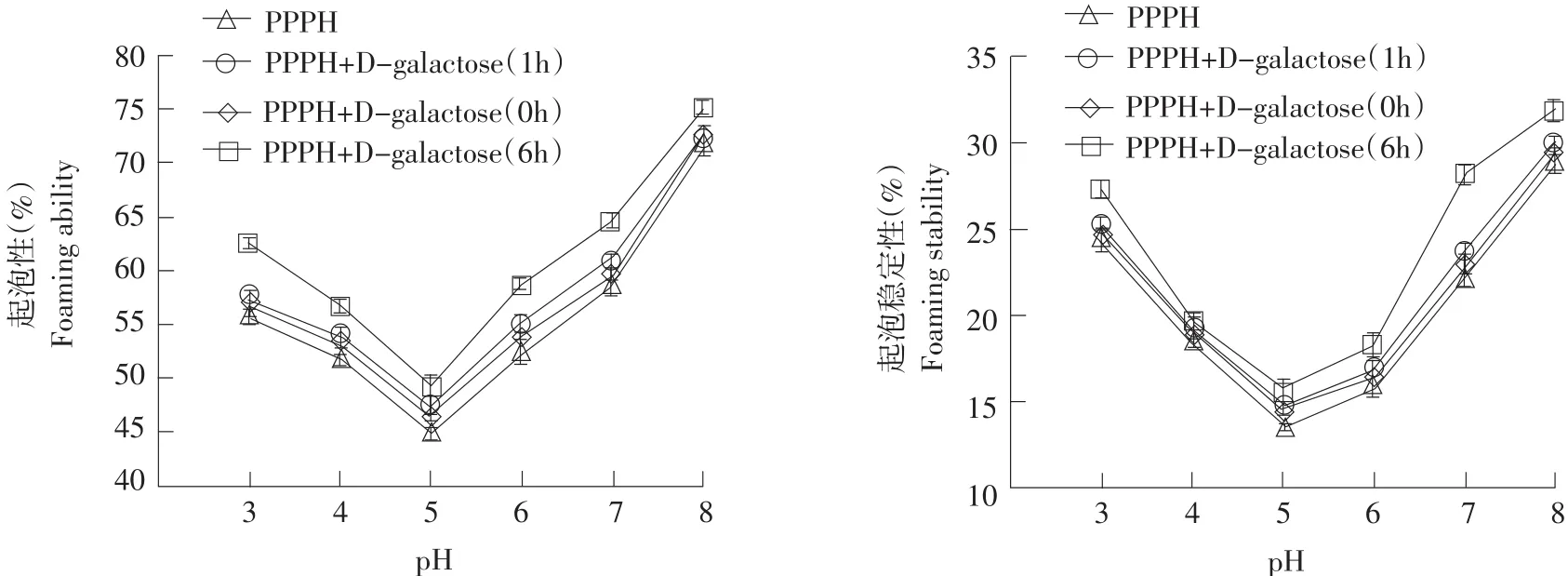
图4 pH对不同美拉德反应修饰时间的猪血浆蛋白抗氧化肽起泡性和起泡稳定性的影响Fig. 4 Foaming ability and foam stability of porcine plasma protein antioxidant peptides modified using Maillard reaction with different reaction times as influenced by pHs
3 讨论
对于食品加工中的添加组分而言,溶解性是最重要的功能性质,其他功能性质(如乳化性、起泡性等等)以溶解性为前提。经美拉德反应修饰后的猪血浆蛋白抗氧化肽溶解性增大原因主要是,糖类具有较多的亲水基团,使美拉德反应修饰后的蛋白肽-糖复合物中存在大量羟基基团,使整个分子的溶解性得到提高[20]。Achouri等将含有11S部分的大豆球蛋白与葡萄糖在50℃[21]、65%相对湿度条件下加热,进行美拉德反应,结果表明,加热到24 h,反应体系溶解性逐渐增加。
表面疏水性是蛋白的结构性质,用于评价蛋白空间构象,与蛋白的功能性质相关。蛋白质表面疏水性反映蛋白质分子表面疏水性氨基酸相对含量。经美拉德反应修饰后,猪血浆蛋白抗氧化肽疏水集团通过疏水相互作用聚集,埋藏在分子内部,分子表面大多被亲水集团占据,致使表面疏水性呈降低趋势[22]。表面疏水性还与环境体系中的pH有显著关联。Zhang等研究发现[23],鹰嘴豆分离蛋白在pH为3.0时表面疏水性最大,而在pH为9.0时表面疏水性达到最小。
乳化性是蛋白质重要功能特性,与蛋向质的品质密切相关,直接影响蛋白质在食品行业中的有效利用。经美拉德反应修饰后的蛋白肽的乳化性及乳化稳定性均有所提高,这是由于经热处理后,原来隐藏在分子内部的疏水基团暴露出来,亲油性增强[24]。同时由于糖添加可增加油/水乳化体系中水相的黏度,会稍微下降油/水界面张力,增加乳化液的乳化稳定性[25]。
泡沫是一种具有双相性的胶体系统,其中含有大量连续的液相和被分散的汽相。起泡性和起泡稳定性是表示起泡性质的最基本指标[26]。在本试验中,经美拉德反应修饰后的猪血浆蛋白抗氧化肽的起泡性及起泡稳定性均有所提高,但最差的起泡性及起泡稳定性出现在pH为5.0时,与溶解性变化一致,这是因为蛋白的溶解性对蛋白的起泡性质具有重要影响,蛋白质起泡性主要取决于其可溶部分,蛋白质高溶解性是良好起泡性及起泡稳定性的先决条件,蛋白质只有具有一定溶解性,才会有效向油水界面和气液界面扩散,但不溶解蛋白质粒子在稳定泡沫中由于提高了表面粘度而产生有益作用[27]。
4 结论
经美拉德反应修饰后的猪血浆蛋白抗氧化肽功能特性显著提高。溶解性、起泡及起泡稳定性、乳化及乳化稳定性随反应时间增加而逐渐增大,表面疏水性则随着反应时间的增加而降低。同时,各功能性质均随环境体系中pH改变而变化。因此,美拉德反应修饰可有效改善猪血浆蛋白抗氧化肽功能特性,应用于食品加工业中,可为抗氧化肽有效利用提供新途径。
[参考文献]
[1]Peña-Ramos E A, Xiong Y L. Antioxidative activity of whey protein hydrolysates in a liposomal system[J]. Journal of Dairy Science, 2001, 84(12): 2577-2583.
[2]Kong B H, Xiong Y L. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J]. Journal ofAgricultural and Food Chemistry, 2006, 54(16): 6059-6068.
[3]Liu Q, Kong B H, Jiang L Z, et al. Free radical scavenging activity of porcine plasma protein hydrolysates determined by electron spin resonance spectrometer[J]. LWT-Food Science and Technology, 2009, 42(5): 956-962.
[4]Davalos A, Miguel M, Bartolome B, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis [J]. Journal of Food Protection, 2004, 67(9): 1939-1944.
[5]Saiga A, Tanabe S, Nishimura T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment [J]. Journal of Agricultural and Food Chemistry, 2003, 51(12): 3661-3667.
[6]Chen H M, Muramoto K, Yamauchi F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2619-2623.
[7]Wang L, Xiong Y L. Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9186-9192.
[8]Ma Y Y, Xiong Y L, Zhai J J, et al. Fractionation and evaluation of radical-scavenging peptides from in vitro digests of buckwheat protein[J]. Food Chemistry, 2009, 118(3): 582-588.
[9]Thiansilakul Y, Benjakul S, Shahidi F. Compositions, functional properties and antioxidative activity of protein hydrolysates prepared from round scad (Decapterus maruadsi)[J]. Food Chemistry, 2007, 103(4): 1385-1394.
[10]Liu Q, Kong B H, Xiong Y L, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry, 2010, 118(2): 403-410.
[11]Kim J S, Lee Y S. Antioxidant activity of Maillard reaction products derived from aqueous glucose/glycine, diglycine, and triglycine model systems as a function of heating time[J]. Food Chemistry, 2009, 116(1): 227-232.
[12]Jaeger H, Janositz A, Knorr D. The Maillard reaction and its control during food processing. The potential of emerging technologies[J]. Pathologie Biologie, 2010, 58(3): 207-213.
[13]Saeki H. Preparation of neoglycoprotein from carp myofibrillar protein by Maillard reaction with glucose: Biochemical properties and emulsifying properties[J]. Journal of Agricultural and Food Chemistry, 1997, 45(3): 680-684.
[14]Liu Y, Zhao G L, Zhao M M, et al. Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J]. Food Chemistry, 2012, 131(3): 901-906.
[15]Li J, Liu Q, Kong B H, et al. Characteristics and antioxidant activity of Maillard reaction products from porcine plasma protein hydrolysate-galactose model system[J]. Advanced Materials Research, 2012, 554-556: 1042-1048.
[16]Akita E M, Nakai S. Liophilization of β-lactoglobulin: Effect no hydrophobicity, conformation and surface functional properties[J]. Journal of Food Science, 1990, 55(3): 711-717.
[17]Pearce K N, Kinsella J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
[18]Klompong V, Benjukal S, Kantachote D, et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1317-1027.
[19]Gu F L, Kim J M, Hayat K, et al. Characteristics and antioxidant activity of ultrafiltrated Maillard reaction products from a caseinglucose model system [J]. Food Chemistry, 2009, 117(1): 48-54.
[19]Kato A. Industrial applications of Maillard-type protein-polysaccharide conjugates[J]. Food Science and Technology Research, 2002, 8(3): 193-199.
[20]Achouri A, Boye J I, Yaylayan V A, et al. Functional properties of glycated soy 11S glycinin[J]. Journal of Food Science, 2005, 70(4): 269-274.
[22]Rangsansarid J, Cheetangdee N, Kinoshita N, et al. Bovine serum albumin-sugar conjugates through the Maillard reaction: Effects on interfacial behavior and emulsifying ability[J]. Journal of Oleo Science, 2008, 57(10): 539-547.
[23]Zhang T, Jiang B, Mu W M, et al. Emulsifying properties of chickpea protein isolates: Influence of pH and NaCl[J]. Food Hydrocolloids, 2009, 23(1): 146-151.
[24]Decourcelle N, Sabourin C, Dauer G, et al. Effect of the Maillard reaction with xylose on the emulsifying properties of a shrimp hydrolysate (Pandalus borealis) [J]. Food Research International, 2010, 43(8), 2155-2160.
[25]Coia K A, Stauffer K R. Shelf life study of oil/water emulsions using various commercial hydrocolloids[J]. Journal of Food Science, 1987, 52(1): 166-172.
[26]Panyam D, Kilara A. Enhancing the functionality of food proteins by enzymatic modification[J]. Trends in Food Science and Technology, 1996, 7(4): 120-125.
[27]曲晓婷,张名位,温其标.米糠蛋白提取工艺的优化及其特性研究[J].中国农业科学, 2008, 41(2): 525-532.
Improvement of functional properties of procine plasma protein
antioxidant peptides via maillard reaction modification
/LIU Qian1, NIU Haili1, LI Jing1, 2, LU Yan1, GENG Rui1, KONG Baohua1, LI Donghai1(1. School of Food Science, Northeast Agricultural University, Harbin 150030, China; 2. Harbin Institute of Product Quality and Inspection, Harbin 150036, China)
Abstract:This study mainly investigated the influence of functional properties of procine plasma protein antioxidant peptides via Maillard reaction modification. Porcine plasma protein hydrolysate (PPPH) were mixed with D-galactose with the ratio of 1ϑ3 (W/W) to formulate a reaction system and then heated at 90℃for 0, 1 and 6 h, in order to get maillard reaction products (MRPs) of different reaction times. Solubility, surface hydrophobicity, emulsifying activity index (EAI) and emulsion stability index (ESI), foaming ability and foam stability were determined. The results showed that the functional properties of porcine plasma protein antioxidant peptides have significantly improved via the Maillard reaction modification. Solubility, EAI and ESI, foaming ability and foaming stability were significantly increased as the heating time increased (P<0.05), as well as the surface hydrophobicity of MRPs were significantly decreased as the heating time increased (P<0.05). Additionally, the functional properties of
MRPs were obviously affected by pH values (P<0.05). Therefore, Maillard reaction modification could significantly improve the functional properties of procine plasma protein antioxidant peptides, and also could be used as an emulsifier and as a foaming agent in food industry.
Key words:procine plasma protein antioxidant peptides; D-galactose; maillard reaction modification; functional properties
*通讯作者:孔保华,教授,博士生导师,研究方向为畜产品加工。E-mail: kongbh@163. com
作者简介:刘骞(1981-),男,副教授,博士,硕士生导师,研究方向为畜产品加工。E-mail: liuqian_neau@hotmail. com
基金项目:黑龙江省教育厅普通高等学校青年学术骨干支持计划项目(1253G007);高等学校博士学科点专项科研基金项目(新教师类)(20122325120018);国家自然科学基金青年基金项目(31301450)
收稿日期:2014-05-04
文章编号:1005-9369(2015)02-0018-06
文献标志码:A
中图分类号:S855.1+2
