短C肽门冬胰岛素制备工艺的研究
2015-11-08付志成马妍张增涛刘日勇何勇范开
付志成,马妍,张增涛,刘日勇,何勇,范开
(1.重庆理工大学,重庆400054;2.富进生物医药有限公司,重庆400041)
短C肽门冬胰岛素制备工艺的研究
付志成1,马妍1,张增涛2,刘日勇2,何勇2,范开1
(1.重庆理工大学,重庆400054;2.富进生物医药有限公司,重庆400041)
为研究门冬胰岛素制备工艺,参照毕赤酵母偏好密码子,设计合成N-端连接引导肽EEAEAEAEPK,以KEWK作为短C肽,A、B链结构完整的门冬胰岛素cDNA序列。利用Xho I-Not I酶切位点将其插入表达质粒pPICZαA,采用电转移方法将重组质粒转入毕赤酵母x-33,筛选高拷贝重组子作为工程菌株进行高密度发酵,表达量可达到0.57 g/L。发酵液经金属螯合层析和SP阳离子层析纯化后鉴定正确。建立CPB/Trypsin双酶切工艺,对不同温度及pH条件下产生的酶切产物进行分析,初步建立了酶切最佳pH值和温度条件。酶切产物经纯化后制得纯度为91.7%的门冬胰岛素,副产物为B链30位缺失的门冬胰岛素。该设计方法为含短C肽EWK门冬胰岛素制备中选用Lys-c酶切成本过高的问题提供了备选解决方案。
门冬胰岛素;毕赤酵母;短C肽;纯化
门冬胰岛素(Insulin Aspart,商品名Novo Rapid)由丹麦诺和诺德(Novo Nordisk)公司开发,是一种速效胰岛素类似物,于2000年在美国上市[1]。其设计原理为通过基因重组将胰岛素B链第28位脯氨酸(Pro)置换为天冬氨酸(Asp)。该阴离子的引入未改变其受体亲和力、分离的速度及体内的药物效能,而是通过增大胰岛素分子间的相互排斥阻止二聚体的形成,使其吸收速度为人胰岛素的2倍[2]。Thim等[3]比较含不同长度C肽与去除C肽胰岛素原在毕赤酵母中的表达情况,发现C肽长度由4个氨基酸残基缩短至2 h,胰岛素原的表达量上升。自此,C肽的设计成为胰岛素重组表达中受到关注的问题,以期达到更高的表达量,降低胰岛素的制备成本。Kjeldsen等[4]将去除B30苏氨酸(Thr)后用小C肽代替人胰岛素C肽或B29赖氨酸(Lys)与A1甘氨酸(Gly)直接连接的A、B链结构连于前导肽α因子,提高了其在酿酒酵母中的分泌表达水平;而后发现在短C肽中引入一个芳香族氨基酸以及在分子疏水核心加入酚结合位点能够使门冬胰岛素在酿酒酵母中的表达量提高5倍[5]。Annibali[6]设计以赖氨酸(Lys)或精氨酸(Arg)构成的2个氨基酸短肽的人胰岛素原在毕赤酵母中得以表达。
国内对于门冬胰岛素的研究主要集中在以其为组成成分的预混胰岛素类似物的药理学特点[7]、在I型及II型糖尿病临床应用的研究[8]、在妊娠期糖尿病中应用的安全性和有效性[9-10],以及与二甲双胍、阿卡波糖等降血糖药物联合用药临床效果[11]等方面,而对于门冬胰岛素的重组表达和制备工艺所进行的研究鲜有报道。笔者所在实验室曾设计构建在α-MF信号肽序列后插入氨基酸序列EEAEAEAEPK作为引导肽,以EWK作为短C肽,B30Thr缺失的胰岛素原,用pPICZαA为载体质粒,毕赤酵母x-33作为表达菌株,构建的表达Insulin Aspart的重组菌株发酵诱导64 hr表达量达到2.55 g/L。但在酶切处理过程中,常用的能切开赖氨酸(Lys,K)或精氨酸(Arg,R)的胰蛋白酶不能切除C肽,因此选用赖氨酸内肽酶(Lys-c)进行酶切去除引导肽和C肽。但有关该酶的文献报道较少,制备需培养天然筛选菌株,产量较低,使用需向日本Wako公司购买,成本较高。因此,设计N-端连接引导肽EEAEAEAEPK,以KEWK作为短C肽的A、B链结构完整的门冬胰岛素序列,IAsp:EEAEAEAEPK-B1-B28Asp-B29Lys-B30-K-E-W-K-A1-A21。以pPICZαA为载体质粒,毕赤酵母x-33作为表达菌株,构建筛选高表达菌株,建立成本较低的酶切工艺。
1 材料与方法
1.1材料
E.coli/Top10F',P.Pastoris/x-33,表达质粒pPICZαA均由重庆富进生物医药有限公司保存;限制性内切酶Xho I,NotⅠ,T-4 DNA连接酶购自TAKARA公司;羧肽酶B(CPB),胰蛋白酶(Trypsin)由富进生物医药有限公司制备;中分子蛋白标准购自TIANGEN公司;Zeocin购自迈晨科技(北京)有限公司;金属螯合层析柱和离子交换层析柱填料均购自GE公司。
LB培养基,MD、MY、YPG固体培养,BMMY、BMGY液体培养基等均参照Invitrogen公司毕赤酵母操作手册进行配制。
1.2方法
1.2.1重组质粒pPICZαA-IAsp的构建
根据设计门冬胰岛素原的氨基酸序列组成,选择酵母偏爱密码子设计cDNA序列,其中TGA和TAA为两个终止密码子序列,并在序列5'端和3'端分别设计Xho I(CTCGAG)和Not I(GCGGCCGC)限制性酶切位点。设计的cDNA委托宝生物工程(大连)有限公司全基因合成,连于pMD19-T质粒。门冬胰岛素基因序列如图1所示。

图1 门冬胰岛素基因序列
将携带目的基因的甘油菌保接种于8 mL LB培养基中,于37℃、180 r/min摇床培养过夜后,取适量菌液,按Omega公司质粒小提试剂盒操作,抽提重组质粒pMD19-T-IAsp。利用Xho I-Not I分别双酶切pMD19-T-IAsp质粒和pPICZαA,经琼脂糖凝胶电泳后分别回收大小约200 bp和3300 bp片段并链接两片段,构建质粒pPICZαAIAsp。重组质粒pPICZαA-IAsp,用CaCl2法转入E.coli Top10F',涂布LB-Zeocin平板筛选重组子。挑取平板上菌落,摇瓶培养后抽提质粒,经Xho I-Not I双酶切后,送大连宝生物公司测序。
1.2.2重组质粒转化毕赤酵母x-33
Sac I单酶切重组质粒pPICZαA-IAsp,线性化质粒电击法转入毕赤酵母x-33感受态细胞。转化液涂布在含有0.5,1,1.5,2 mg/mL Zeocin的YPD平板上,30℃培养4 d,每24 h观察平板上菌落的生长情况。
1.2.3重组子摇瓶诱导表达
根据重组拷贝数与Zoecin浓度计量依赖关系,于YPD-Zeocin平板(1.5 mg/mL)挑取pPICZαA -IAsp/x-33菌落,接种于50 mL BMGY培养基;在30℃、220 r/min摇床培养约16 h至OD600值约为10,换用BMMY培养液50 mL,30℃继续培养96 h,按终浓度0.5%每隔24 h补加无水甲醇,将诱导96 h后的各单菌落摇瓶培养液离心收集上清,通过SDS-PAGE鉴定其表达产物。
1.2.4重组酵母的高密度发酵
将鉴定正确的高表达的菌株所保菌种接种于1L YPD培养基中,摇瓶培养约24 h。配制BSM培养基9 L,于瑞士比欧生物工程公司30 L发酵罐中灭菌降温至28℃后,氨水自控pH值到4.8,补加PTM1,用种子液接种进行发酵。培养约24 h后培养基内甘油耗尽,补加50%甘油补料,至菌体湿重约200 g/L,停止流加甘油并饥饿约1 h,开始流加含甲醇的甘油补料进行诱导。诱导起始甲醇终浓度为0.2%,随发酵过程逐渐提高甲醇诱导浓度至0.6%,过程中取样HPLC检测分泌表达产物含量。发酵进行至64 h后下罐收集离心上清。
HPLC检测选用Welch UltimateR XB-C18(5μm 4.6×100 mm);A液:DDW+0.1%三氟乙酸;B液:100%乙腈+0.1%三氟乙酸,为流动相;流速为1 mL/min,0%~95%B;检测波长为214 nm,上样20 μL。目的蛋白保留时间为12.5 min,18 000 000 mAU峰面积为1 mg/L。
1.2.5表达产物的纯化
金属螯合柱纯化:1 mol/L NaCl冲洗柱填料2个柱体积后,以20 mmol/L Na2HPO4,0.3 mol/L NaCl,pH值为6.5~7.0的缓冲液洗柱,直至穿出液pH值约为7.0;用0.1 mol/L CuSO4和0.3 mol/L NaCl混合液进行再生,DDW冲洗未结合Cu2+;柱层析平衡液平衡(20 mmol/L Na2HPO4、0.3 mol/L NaCl、pH值为6.5~7.0)后上样(发酵液离心取上清,将pH值调到7.0);平衡液(20 mmol/L Na2HPO4、0.3mol/L NaCl、pH值7.0)复平衡至吸收基线,开始用洗脱液(20 mM Na2HPO4、50 mM咪唑、pH值6.5~7.0)洗脱,收集目的蛋白峰。
SP柱纯化:平衡液(20 mmol/L CH3COONa、pH值为3.0~3.5)平衡柱填料,直至穿出液pH值约为3.5;上述洗脱液用去离子水稀释至电导小于10 Ms/cm2,调pH值为3.0~3.5后上样;平衡液复平衡至基线,洗脱液洗脱(20 mmol/L CH3COONa、1 mol/L NaCl、pH值为3.0~3.5),收集目的蛋白。与层析柱填料结合的色素可用1 mol/L NaOH除去。
1.2.6酶切体系建立
根据蛋白序列,需切除引导肽-EEAEAEAEPK-及C肽-KEWK-,形成正确的B1-B28Asp -B29-B30-A1-A21门冬胰岛素序列。将SP阳离子柱层析收集样品,采用HPLC法标定浓度后,稀释至浓度1 mg/mL,分装后分别调节pH值至7.5和8.5,按以下比例设置实验组。表1中比例均为酶与底物质量比,酶切过夜。HPLC检测酶切结果,并通过质谱比照判断各个酶切条件的酶切效果。
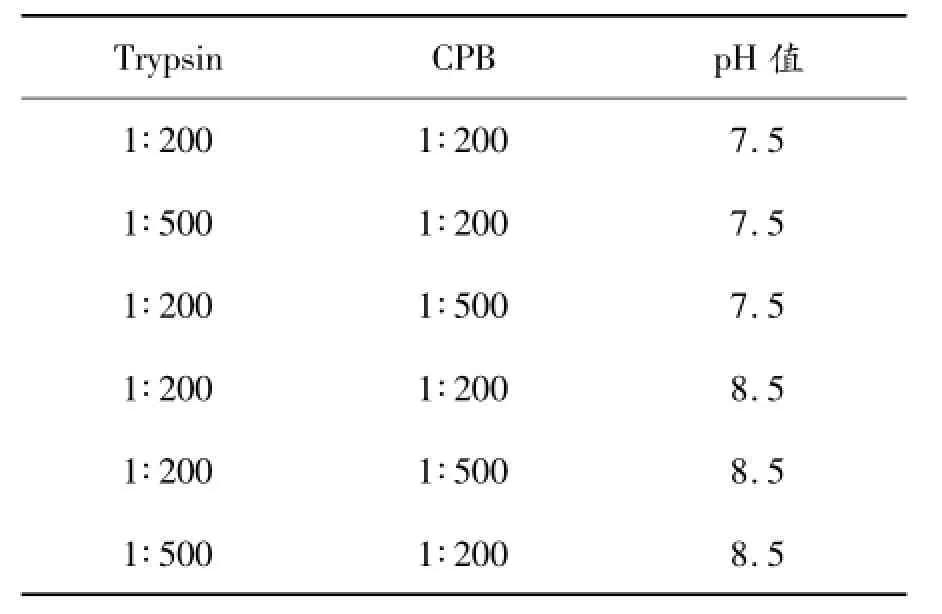
表1Trypsin/CPB双酶切比例
1.2.7酶切产物回收与分析
将样品pH值调低到3.0,通过反相Source 15RPC纯化回收目的蛋白。以Source 15RPC(75 mL)为制备柱。A液:0.1 M(NH4)2SO4,10%乙腈,0.1%H2SO4;B液:70%乙腈,10%甲醇为流动相。洗脱梯度:5%B至25%B 5 min;25%B至40%B 30 min,收集各洗脱峰。
利用RP-HPLC对收集到的各个洗脱峰进行鉴定,因C18普通反相不能有效分离Insulin Aspart与IAsp-DesB30组分,因而选用Kromasil 100 -10-C8分析柱。A液:90%缓冲,10%乙腈;B液:40%缓冲,60%乙腈作为流动相。30%B至80%B 50 min,检测波长214 nm。
2 结果与分析
2.1重组质粒的酶切鉴定
构建重组质粒pPICZαA-IAsp后,经Xho INot I双酶切,结果如图2所示,可见在3 300 bp和200 bp左右有明亮条带,与理论值相符,证明重组质粒含有设计的基因序列。测序结果与设计序列一致,说明编码含短C肽门冬胰岛素序列已连接入pPICZαA质粒。

图2 重组质粒酶切鉴定
2.2重组菌株的筛选与摇瓶诱导表达
重组毕赤酵母表达外源蛋白的表达量一定程度上受到基因组内所整合编码外源蛋白的基因拷贝数影响。由于选用的质粒pPICZαA带有Zeocin抗性基因,且重组子对Zeocin的抗性与外源基因的拷贝数在一定范围内成正比关系,故挑取1.5 mg/mL Zeocin浓度YPD平板上菌落作为工程菌株,摇瓶诱导表达并进行高密度发酵,考察表达量。
目的蛋白理论相对分子质量为7 853.86,利用中分子蛋白Marker作为对照,能够看到在低于14.4 kDa处有明显条带,初步判断目的蛋白在重组菌株中能够得以分泌表达。

图3 重组子诱导表达SDS-PAGE
2.3工程菌发酵表达量
对所筛菌株进行小规模高密度发酵,不仅能够对构建的工程菌株发酵条件进行初步摸索,还能为后续纯化及酶切提供足够的样品。依据笔者所在实验室对以EWK作为短C肽pPICZαAIAsp(EWK)/x-33发酵工艺为参照,对本菌株进行高密度发酵培养,诱导64 h对目标蛋白表达量进行检测,表达量约为0.57 mg/L,见图4。

图4 发酵诱导表达64 h上清RP-HPLC检测
2.4目的蛋白纯化
发酵上清经金属螯合层析,SP柱纯化后,以除去绝大部分杂蛋白和可能干扰酶切的色素,纯化结果如图5所示。虽经Zn2+沉淀复溶后,能够更加彻底地清除溶液中的色素,但Zn2+沉淀引入Zn2+可能干扰蛋白酶的酶切效率,而复溶需加入EDTA螯合Zn2+,EDTA为蛋白酶活性抑制剂。因此,经两步纯化的样品,多数色素被除去。纯化终样品RP-HPLC检测如图5,目的峰为单一峰,保留时间为12.5 min左右。
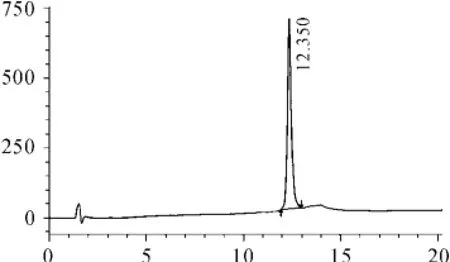
图5 纯化产物RP-HPLC检测
2.5酶切处理结果
经酶切处理样品,利用C-18 RP-HPLC检测,除可见引导肽C肽外,有3种主要酶切产物,结合质谱结果分析,分别为错切B22Arg剩余多肽和带有C肽未能切除的门冬胰岛素原形式。在正确酶切产物峰中,混合了切除TKEWK的结构,即B30Thr缺失的IAsp-DesB30。各个组分在不同酶切条件下所占比例如表2、3所示。
表2、3中:组分I为未被酶切门冬胰岛素原;组分II为在B22Arg位点错误切开的肽段;组分III为酶切正确的门冬胰岛素蛋白;组分IV为带有C肽KEW(K)而被切去引导肽的多肽链。由表2、3可知,pH值对酶切效率有一定的影响,高pH值可能造成错切率升高,低pH值则会造成未被酶切的门冬胰岛素原过多。Trypsin1∶500,CPB1∶200,pH值8.5实验组虽然错切B22Arg的产物最多,但是其产物中酶切正确的Insulin Aspart所占比例也最高。由此,参照该实验方案,将制备样品稀释至4 mg/mL,Typsin与目的蛋白质量比为1∶800,CPB与目的蛋白比为1∶200,pH值为8.5,20℃酶切5 h后,RP-HPLC检测结果如图6所示。13.191 min保留峰经高分辨质谱测定分子量为5 826 Da,与理论分子量一致。
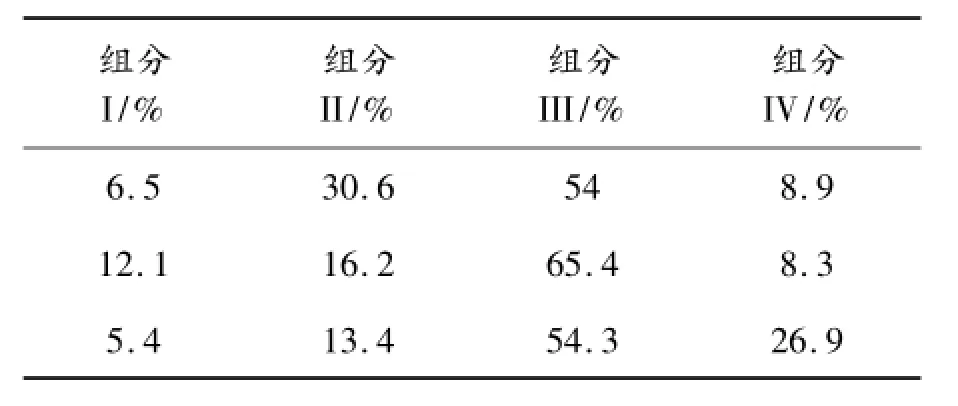
表2 酶切产物组分表(pH值为7.5)
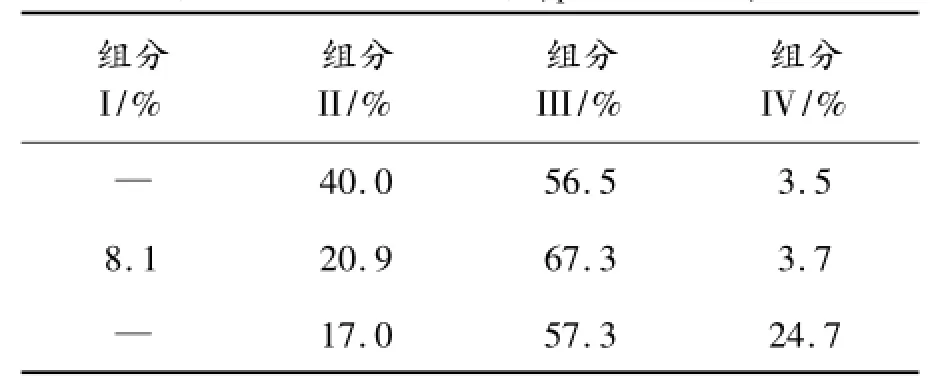
表3 酶切产物组分表(pH值为8.5)
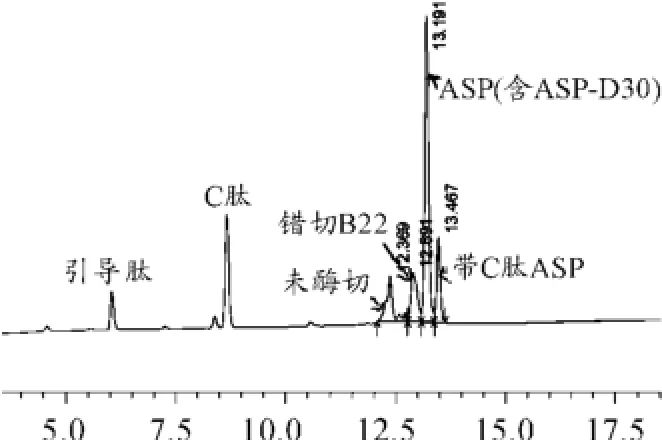
图6 酶切产物RP-HPLC检测
2.6酶切产物的回收与分析结果
利用15RPC对酶切产物进行纯化,洗脱时分别收集4个洗脱峰,见图7。对4个洗脱峰RP-HPLC进行分析,并与标准品比照,可知峰3收集即为Insulin Aspart,见图8。

图7 酶切产物15RPC纯化

图8 15RPC收集峰RP-HPLC检测
因副产物IAsp-DesB30与目的蛋白Insulin Aspart结构类似,只有B30Thr缺失,C18-HPLC难以分离,因此选用Kromasil 100-10-C8柱对纯化后酶切产物进行分析,结果见图9。纯化后的酶切产物已为纯度较高的Insulin Aspart,其纯度达到91.71%。

图9 酶切回收峰3 Kromasil 100-10-C8检测
3 结论
胰岛素及胰岛素类似物在毕赤酵母中的表达量不仅受到编码外源蛋白基因特性的影响,蛋白本身结构也是决定性因素之一。对于在毕赤酵母中表达胰岛素及其前体,在质粒信号肽α-MF序列和胰岛素基因之间加入EEAEAEAEPK信号肽序列能有效地提高表达量。国内多选择以AAK作为短C肽提高胰岛素或胰岛素类似物Detmir前体(B30Thr缺失的人胰岛素)[11],而对门冬胰岛素的报道并不多见。设计短C肽KEWK,在C肽中引入芳香族类氨基酸,以期能够提高表达量。在工程菌株高密度表达的发酵过程中,外源蛋白表达量决定于菌种本身和外源蛋白的性质,同时也受到的发酵环境的影响。参照毕赤酵母表达人胰岛素前体发酵条件[11],对构建工程菌进行高密度培养,诱导表达门冬胰岛素前体,64 h表达量为0.57 g/L。就本实验结果而言,为了酶切而在EWK序列前引入的氨基酸增加了C肽的长度,很有可能是限制表达量的因素之一。发酵的表达量通过改变补料流加的时机和诱导模式,有进一步提升的潜力。
发酵上清液中所含无机盐、色素及背景蛋白均会对门冬胰岛素制备中的酶切造成干扰。毕赤酵母分泌表达胰岛素原早期运用硫酸铵沉淀后阴离子柱层析分离[12],之后多用超滤或大孔树脂吸附层析后经SP离子交换层析,再经Zn2+沉淀制得[11,13]。本文发现在目的蛋白不带有组氨酸标签的情况下,胰岛素前体能与铜金属螯合层析柱填料结合,有效除去发酵液中背景蛋白,但对色素清除能力不强,故仍需使用SP离子交换层析去除部分色素。因酶切工艺易受到Zn2+和EDTA的干扰,故未进行Zn2+沉淀与复溶的步骤,所得样品经HPLC检测为单一峰,残留少许色素,能够满足酶切需要,色素可在酶切后纯化中被除去。
因含C肽的胰岛素原不具有生物学活性,需切除短C肽的胰岛素原[14]。故设计短C肽时,不仅需要考虑C肽对表达量的影响,还要考虑其在后续处理中纯化酶切。羧肽酶B和胰蛋白酶常在重组蛋白表达后酶切加工时使用[15],目前已经完成了基因工程重组表达的研究,可利用工程菌大量制备,使得其生产或购买的成本降低。使用CPB/Trypsin双酶切体系,能够被酶切的位点为B22Arg,B29Lys,以及C肽第1位和第4位的Lys,因此,若CPB作用与C肽第1位Lys切断C端肽键,会在B链C端引入一个多余的Lys,而B29Lys仍可被内肽酶作用,多余Lys连同B30Thr一同被切除,形成B链第30位缺失的门冬胰岛素(IAsp-DesB30)。门冬胰岛素B30缺失对药效和药代动力学的影响研究目前还未见相关报道,所以需进一步纯化分离IAsp-DesB30,并应用分离度较好的检测方法作为质量控制的手段。经Kromasil 100-10-C8反相色谱检测15 RPC制备柱纯化后的样品,酶切纯化制得样品门冬胰岛素纯度达到91.7%,杂质即为IAsp-DesB30。该类物质经纯化分离后可继续加工,在B链末尾连接一个Thr,以制备门冬胰岛素。
本实验将在以后的研究中对发酵的工艺进行进一步优化,提高产量,改进酶切体系,提高酶切效率,减少错误酶切的副产物,提高纯化收率,为速效胰岛素工业化生产提供帮助。
[1]滕香宇.新型胰岛素类似物的研究进展[J].世界临床药物,2004,25(12):714-717.
[2]Home P D,Lindholm A,Hylleberg B,et al.Improved glycemic control with insulin aspart:a multicenter randomized double-blind crossover trial in type 1 diabetic patients[J].Diabetes Care,1998,21(11):1904-1909.
[3]Thim L,Hansen M T,Norris K.et al.Secretion and processing of insulin precursors in yeast[J].Proc Natl Acad Sci U S A,1986,83(18):6766-6770.
[4]Kjeldsen T.Yeast secretory expression of insulin precursors[J].Appl Microbiol Biotechnol,2000,54(3):277 -286.
[5]Kjeldsen T,Ludvigsen S,Diers I,et al.Engineering enhanced protein secretory expression in yeast with application to insulin[J].J Biol Chem,2002,277(21):18245 -18248.
[6]Annibali.Expression of a human insulin precursor in P[P].pastoris US Patent,7,091,032.2006-08-15.
[7]董超.门冬胰岛素30临床应用进展[J].山西医药杂志,2009,38(11):991-992.
[8]李淑颖.胰岛素类似物的研究进展[J].河北医药,2005,27(9):693-694.
[9]于四永,王慧丽,陈永立,等.胰岛素类似物治疗妊娠期糖尿病的患者的临床观察[J].临床荟萃,2013,28(5):573-575.
[10]吕诗诗,徐勇,刘霜,等.胰岛素类似物治疗妊娠期糖尿病的研究进展[J].临床荟萃,2015,30(2):228 -230.
[11]李红亮.不同启动子对重组毕赤酵母高密度表达人胰岛素前体的影响[D].重庆:重庆理工大学,2012.
[12]高剑坤.一种新型长效人胰岛素类似物的研制[D].重庆:重庆大学,2007.
[13]Xie T,Liu Q,Xie F,et al.Secretory expression of insulin precursor in Pichia pastoris and simple procedure for producing recombinant human insulin[J].Prep Biochem Biotechnol,2008,38:308-317.
[14]吴颖.小C肽人胰岛素原在甲醇酵母中的分泌表达[D].浙江:浙江大学,2005:6-7.
[15]Chunsheng Leng,Hang Cui.Application of recombinant enzymes in the production of human insulin[J].Journal of Chinese Pharmaceutical Science,2011,23(5):335 -337.
(责任编辑何杰玲)
Research on Preparation of Insulin Aspart with Short C-Peptide
FU Zhi-cheng1,MA Yan1,ZHANG Zeng-tao2,LIU Ri-yong2,HE Yong2,FAN Kai1
(1.Chongqing University of Technology,Chongqing 400054,China;2.FAGEN Biological Medicine Co.Ltd.,Chongqing 400041,China)
In order to study the preparation techniques of insulin aspart,we designed and linked EEAEAEPK to its N-terminal,referring to the preference codons of pichia pastoris,and took KEWK as C-peptide,which was a synthetise insulin aspart cDNA sequence with integrated A,B chain structure.We inserted the target sequence into expression plasmid pPICZαA by the restriction enzyme sites Xho I and Not I.The combination of P.Pastoris/x-33 was constructed by electrotransformation and the high-yield strain was selected.The combinant strain expressed 0.57 g/L at the 64th hours of fermentation.We obtained the purer insulin aspart precursor from broth through metal ion-affinity chromatography,SP ion-exchange chromatography and the result of authentication was correct.The system of enzyme digestion by CPB/Trypsin was established and probed the effect in different pH and temper-ature.The product after enzyme digestion was made into insulin aspart and the by-product was insulin aspart DesB30.The purity of insulin aspart reached 91.7%.This design would be another choice to the preparation of insulin aspart,compared with which with short C-peptide EWK,as its high cost in use of Lys-c.
insulin aspart;pichia pastoris;short C-peptide;purification
R977.15
A
1674-8425(2015)04-0060-07
10.3969/j.issn.1674-8425(z).2015.04.012
2015-01-26
付志成(1990—),男,硕士研究生,主要从事基因工程药物方面研究。
付志成,马妍,张增涛,等.短C肽门冬胰岛素制备工艺的研究[J].重庆理工大学学报:自然科学版,2015(4):60-66.
format:FU Zhi-cheng,MA Yan,ZHANG Zeng-tao,et al.Research on Preparation of Insulin Aspart with Short CPeptide[J].Journal of Chongqing University of Technology:Natural Science,2015(4):60-66.
