组织蛋白酶D绿色荧光蛋白复合质粒转染技术在慢性光损伤成纤维细胞研究中的作用
2015-11-07郑跃陈海燕许庆芳叶聪秀刘惠娴易金玲赖维
郑跃 陈海燕 许庆芳 叶聪秀 刘惠娴 易金玲 赖维
组织蛋白酶D绿色荧光蛋白复合质粒转染技术在慢性光损伤成纤维细胞研究中的作用
郑跃 陈海燕 许庆芳 叶聪秀 刘惠娴 易金玲 赖维
目的探讨组织蛋白酶D绿色荧光蛋白复合质粒(GFP-CatD)技术在成纤维细胞慢性光损伤研究中的作用。方法长波紫外线(UVA)25 J/cm2每天照射人皮肤成纤维细胞1次,共21 d,构建慢性光损伤成纤维细胞模型。构建GFP-CatD质粒,将其转染入慢性光损伤成纤维细胞,荧光显微镜观察绿色荧光标记的组织蛋白酶D表达,Western印迹检测组织蛋白酶D表达,流式细胞仪检测转染GFP-CatD后的慢性光损伤成纤维细胞凋亡率,噻唑蓝(MTT)法检测细胞增殖率。结果慢性光损伤成纤维细胞转染GFP-CatD质粒96 h,可见绿色荧光蛋白组织蛋白酶D在慢性光损伤细胞胞质内表达。Western印迹结果显示,慢性光损伤成纤维细胞转染GFP-CatD质粒后,组织蛋白酶D蛋白表达为未转染细胞的1.28倍。细胞凋亡检测结果发现,转染后的光老化成纤维细胞凋亡细胞率为4.29%±1.30%,与无转染的空白对照组凋亡细胞率3.03%±1.70%比较,差异无统计学意义(P>0.05)。MTT细胞增殖检测结果发现,转染后的光老化成纤维细胞的细胞增殖率为45.20%±4.70%,无转染质粒的光老化成纤维细胞为43.60%±3.90%(P>0.05)。结论GFP-CatD复合质粒转染慢性光损伤成纤维细胞可示踪到组织蛋白酶D荧光蛋白,且不影响慢性光损伤成纤维细胞原有的正常生物活性和周期。
组织蛋白酶D;成纤维细胞;质粒;细胞衰老;皮肤衰老;紫外线
近年来研究发现,除了基质金属蛋白酶(MMP)家族外,溶菌酶、胶原酶、组织蛋白酶(cathepsin)等多种酶类均参与皮肤光老化发生[1-5]。我们的前期研究发现,组织蛋白酶D(CatD)与皮肤光老化发生密切相关[2-3]。但CatD究竟是通过诱导细胞老化、抑制光诱导变性的细胞外基质清除、减弱正常细胞分裂修复功能作用还是其他途径参与光老化发生机制,尚不清楚。在本研究中,我们用CatD绿色荧光蛋白复合(GFP-CatD)质粒技术,为更好示踪、调控CatD在光老化细胞中的表达及迁移,进一步阐明CatD在皮肤光老化中的作用机制奠定基础。
一、材料
胰酶、胎牛血清(FBS)、LB培养基、DMEM培养基(美国Gibco BRL公司)。链霉素、氨苄西林(美国Sigma公司)。紫外光源为德国沃曼UV801KL。一抗兔抗人CatD单克隆IgG抗体,内参照兔抗人GAPDH多克隆IgG抗体,二抗HRP-羊抗兔IgG(美国Santa Cruz公司)。BCA蛋白定量试剂盒(美国Pierce公司)。ECL显色试剂盒,预染标准参照物(加拿大Ferments公司)。噻唑蓝(MTT)试剂盒(美国Sigma公司)。细胞凋亡试剂盒(南京凯基公司)。质粒提取试剂盒(德国Qiagen公司)。内切酶及连接酶(美国New England Biolabs公司)。
二、方法
1.构建GFP-CatD质粒:用EcoRI、XhoI进行酶切,同时选择PEGF-N1作为克隆表达载体。酶切反应体系(总体系量40 μl)包括 EcoR 1 μl、缓冲液 4 μl、ddH2O 25 μl、10 × BSA 4 μl、Xho I 1 μl及克隆表达载体 PEGF-N1 5 μl。酶切后进行PCR扩增,随后进行连接反应。连接反应体系(总量10 μl)包含酶切回收的载体 DNA(100 ng/μl)1 μl、退火双链 DNA(100 ng/μl)1 μl、10 × T4 DNA 连接酶缓冲液 1 μl、T4 DNA 连接酶 1 μl、ddH2O 去离子水 6 μl。42 ℃水浴热休克 90 s。快速将管转移至冰浴中,冰浴2 min。分别加入500 μl LB培养基,混匀,37℃、30×g,振荡培养 40 min 后,将 150 μl菌液涂布于含氨苄西林(100 mg/L)的LB平板表面,室温下放置,至液体吸收。倒置平板,转移入37℃生化培养箱过夜培养。然后从平板上面挑取大肠杆菌单菌落进行扩增培养,加入含有相应抗生素的3 ml LB培养液中37℃过夜培养,用高纯质粒小量提取试剂盒,按试剂说明书步骤提取质粒,质粒进行酶切鉴定并送广州莱德尔生物科技有限公司测定分析。
2.构建慢性光损伤成纤维细胞模型:取3~6岁小儿包皮环切术包皮,参照文献[3]分离,DMEM培养基培养成纤维细胞,3~5代细胞冻存。细胞复苏后用长波紫外线(UVA)每天照射人皮肤成纤维细胞1次,照射剂量为25 J/cm2,共21 d。照射期间,细胞常规5~7 d进行传代。诱导后的慢性光损伤成纤维细胞分为3组:①处理组:为转染GFP-CatD质粒的慢性光损伤成纤维细胞;②空白对照组:为转染空白GFP质粒(即不含CatD片段的GFP质粒)的慢性光损伤成纤维细胞;③阴性对照组:为不转染质粒的慢性光损伤成纤维细胞。
3.复合质粒转染慢性光损伤成纤维细胞模型:转染前1d,将慢性光损伤细胞以3×106接种于培养板中。用50 μl不含血清培养基Opti-MEM®稀释1.25 ml(20 μmol/L)的GFPCatD质粒储存液,轻轻混匀,室温孵育5 min。将稀释后的GFP-CatD质粒贮存液及lipo2000轻轻混匀,制备成GFPCatD-lipo2000混合液室温孵育20 min。同时设置不含CatD片段的GFP空白质粒为对照,制备GFP-lipo2000混合液。将GFP-CatD-lipo2000混合液及GFP-lipo2000混合液分别加入含有慢性光损伤细胞的400 μl培养基(v2)的培养孔中,轻轻混匀,培养4~6 h,待GFP-CatD转染入细胞,将孔中剩余的GFP-CatD-lipo2000混合液的培养基移去,更换新培养基,将培养板置于37℃的CO2培养箱中培养96 h。
4.示踪荧光标记的CatD:转染后96 h,细胞开始表达目的蛋白,用510 nm波长光激发,荧光显微镜观察绿色荧光蛋白细胞内表达。
5.Western印迹:GFP-CatD质粒以及空白GFP质粒转染后96 h,提取细胞总蛋白保存-70℃冰箱。BCA法蛋白定量。制备不连续SDS-PAGE,加样孔注入提取液(目的蛋白25~30 μg)及5 μl标准蛋白90 V衡压30 min,后120 V衡压90 min条件下SDS-PAGE电泳。电泳凝胶上的蛋白质100 V 50 min电转印到PVDF膜。一抗兔抗人CatD-IgG(浓度1∶1 000),内参照兔抗人 GAPDH-IgG(浓度 1∶1 500),4 ℃孵育12 h,TBST液洗膜,加入 HRP-羊抗兔 IgG(浓度 1∶1 000)37℃孵育1 h,TBST液洗膜。ECL显色试剂盒,A液及B液1∶1混合,孵育膜2~3 min,见到荧光即与X线片一起置于暗盒曝光,显影液显影,定影液定影。所有实验重复3次。
6.MTT法检测细胞增殖:GFP-CatD质粒以及空白GFP质粒转染细胞后96 h,用含10%胎小牛血清得培养液配成单一细胞悬液,以每孔5 000个细胞接种到96孔板,每孔体积200 μl。培养 3~ 5 d后,每孔加 MTT 溶液(5 g/L)20 μl。继续孵育4 h,终止培养,吸弃孔内培养上清液,每孔加150 μl DMSO,振荡10 min。酶联免疫监测仪490 nm波长测定各孔吸光度值。
7.细胞凋亡检测:转染后的慢性光损伤成纤维细胞细胞用5%胰酶消化,调整细胞浓度为1×106个/ml。根据细胞凋亡试剂盒内的凋亡检测说明书步骤,每组取1 ml细胞,300×g,4℃离心10 min,弃上清。加入1 ml预冷的PBS,轻轻振荡使细胞悬浮,300×g,4℃离心10 min,弃上清。重复PBS洗涤3次。将细胞重悬于200 μl结合缓冲液。加入10 μl Annexin V-FITC 和 10 μl PI,轻轻混匀,4 ℃反应 30 min。加入 300 μl结合缓冲液,即刻于流式细胞仪上检测细胞凋亡率。

图1 人成纤维细胞UVA每天照射1次,照射剂量为25 J/cm2,共21 d,构建慢性光损伤成纤维细胞模型(×40) 1A:照射前;1B:照射7 d;1C:照射14 d;1D:照射21 d。显微镜下观察,成纤维细胞逐渐出现细胞体积变大,形状扁平,过度伸展,伸展末端细长有分支,细胞颗粒增加,胞质空泡化
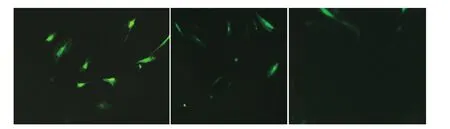
图2 荧光显微镜下(×40),慢性光损伤成纤维细胞转染GFP-CatD质粒后96 h(2A),胞质内可见绿色荧光蛋白标记的CatD表达。转染空白GFP质粒后96 h(2B),慢性光损伤成纤维细胞胞质内可见单绿色荧光蛋白表达。未转染质粒的成纤维细胞(2C)未见荧光表达
8.统计学处理:采用SPSS 15.0统计软件,各组数据均以±s表示。所有实验重复3次,重复结果用方差齐性检验。各组间比较用单因素方差分析,P<0.05表示差异有统计学意义。
三、结果
1.慢性光损伤成纤维细胞模型建立:成纤维细胞经25 J/cm2UVA诱导处理7、14、21 d,细胞逐渐出现慢性光损伤的特征性改变,表现为细胞体积变大,形状扁平,过度伸展,伸展末端细长有分支,细胞颗粒增加,胞质空泡化(图1)。
2.荧光示踪GFP-CatD蛋白:慢性光损伤成纤维细胞转染GFP-CatD质粒后96 h,目的蛋白表达,荧光显微镜下可见GFP-CatD在慢性光损伤细胞胞质内表达(图2)。
3.Western印迹:慢性光损伤细胞转染GFP-CatD质粒96 h后,CatD表达高于未转染质粒的慢性光损伤成纤维细胞及转染空白GFP质粒的慢性光损伤成纤维细胞。阴性对照组的CatD表达低于无UVA诱导成纤维细胞的CatD蛋白表达。灰度值分析结果显示,慢性光损伤细胞转染GFP-CatD质粒后CatD蛋白表达为阴性对照组的1.28倍。空白对照组与阴性对照组的CatD蛋白表达无明显差异。见图3。
4.流式细胞仪检测:转染CatD-GFP质粒后的光老化成纤维细胞活细胞率为93.06%±5.10%,空白对照组为90.69%±5.50%,阴性对照组为97.97%±4.20%,3组间差异无统计学意义(P>0.05)。细胞凋亡检测结果发现,转染质粒后的光老化成纤维细胞凋亡率为4.29%±1.30%,转染GFP空白质粒的对照组为5.22%±1.90%,无转染质粒的阴性对照组为3.03%±1.70%,3组间差异无统计学意义(P>0.05)。见图4。
5.细胞增殖检测:MTT法检测细胞增殖结果发现,转染GFP-CatD质粒后的慢性光损伤细胞增殖率为45.20%±4.70%,与空白对照组(46.60%±4.20%)、阴性对照组(43.60%±3.90%)比较,差异无统计学意义(P>0.05)。
四、讨论
在我们前期研究中,检测到无论是光老化成纤维细胞还是人体老化皮肤,CatD表达都是降低的,且CatD的低表达发生在基因阶段[2-3]。随之,我们在CatD外源性蛋白表达上调层面研究发现,在人体皮肤使用CatD凝胶外源性补充CatD蛋白,可修复慢性光损伤皮肤屏障[6],为了在基因表达层面进一步阐明CatD在慢性光损伤皮肤中的作用,在本研究中我们使用了一种新的绿色荧光蛋白复合质粒(GFP)示踪技术。
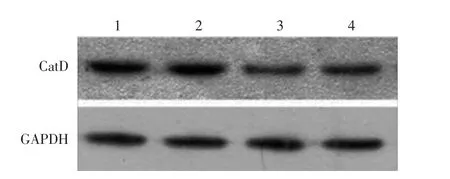
图3 Western印迹结果显示慢性光损伤成纤维细胞组织蛋白酶D(CatD)表达 1:未诱导细胞;2:转染CatD-GFP质粒的慢性光损伤成纤维细胞;3:转染空白GFP质粒的慢性光损伤成纤维细胞;4:无转染质粒的慢性光损伤成纤维细胞

图4 流式细胞仪检测各处理组光老化成纤维细胞活细胞率 转染GFP-CatD质粒组活细胞率为97.97%±4.20%,转染空白GFP质粒组为90.69%±5.50%,阴性对照组为93.06%±5.10%
绿色荧光蛋白是一种稳定自发荧光的标记分子,已成为研究蛋白质相互作用和构象变化、检测蛋白质表达、蛋白质和细胞示踪的重要标记物[7]。GFP-CatD复合质粒,即在同一真核质粒中组装入GFP mRNA和CatD的mRNA,转染入细胞后,表达出CatD绿色荧光蛋白复合蛋白,通过追踪荧光蛋白,即可记录到CatD的表达及迁移轨迹。本研究将该技术用于研究皮肤慢性光损伤机制,将GFP-CatD转染细胞后,在慢性光损伤成纤维细胞中示踪到CatD荧光蛋白。我们的研究一方面在诱导慢性光损伤的活成纤维细胞中示踪到CatD,另一方面在CatD表达、迁移的同时,实时监测慢性光损伤细胞的生物学活性改变。该技术与以往研究蛋白酶表达及定位的免疫组化、免疫荧光相比,具有荧光及目的蛋白均在慢性光损伤活细胞内表达、可同时实时定位示踪目的蛋白并检测活细胞生物学状态、外源污染小等优点,可用于成纤维细胞慢性光损伤机制的动态生物学研究及动态修复治疗机制的研究,特别是用于包括组织蛋白酶家族在内的多种蛋白酶在慢性光损伤细胞内定位、迁移及功能研究。
已有研究表明,将仅表达GFP的空载质粒转入皮肤成纤维细胞,细胞正常生物活性和周期不受影响[8],本研究结果与该研究结果一致。我们的研究发现,GFP-CatD复合质粒转染入慢性光损伤成纤维细胞,细胞凋亡率及细胞增殖率与空白对照相比,差异无统计学意义,说明GFP-CatD复合质粒不影响慢性光损伤成纤维细胞原有的正常生物活性和周期,可用于CatD在皮肤慢性光损伤(光老化)中作用机制的研究。
CatD与皮肤角化、屏障功能及颜色有关[9-10],其在慢性光损伤皮肤及成纤维细胞中表达下调,可通过皮肤角化异常、屏障功能受损及加剧ROS聚集等机制参与皮肤慢性光损伤发生机制。在本研究中,我们用GFP-CatD复合质粒技术,从基因表达层面外源性上调了CatD在慢性光损伤成纤维细胞中的表达,由于本研究是在监测生物学活性下的活慢性光损伤成纤维细胞内,对CatD进行外源诱导上调表达,并对其动态示踪,为进一步研究外源性调控减缓甚至逆转细胞及皮肤的慢性光损伤过程,外源性导入的组织蛋白酶如何通过调控光损伤皮肤活细胞角化过程、修复光损伤皮肤屏障、参与光损伤皮肤胶原蛋白及弹性蛋白的合成及分解动态平衡等途径修复皮肤慢性光损伤过程及机制研究提供一种新的技术参考。
[1]Yaar M,Gilchrest BA.Photoageing:mechanism,prevention and therapy[J].Br J Dermatol,2007,157(5):874-887.
[2]Zheng Y,Lai W,Wan M,et al.Expression of cathepsins in human skin photoaging[J].Skin Pharmacol Physiol,2011,24:10-21.
[3]赖维,郑跃,陆春,等.天冬氨酸/半胱氨酸组织蛋白酶在光老化成纤维细胞中的表达变化[J].中华皮肤科杂志,2010,43(3):192-195.
[4]Lai W,Zheng Y,Ye ZZ,et al.Changes of cathepsin B in human photoaging skin bothin vivoandin vitro[J].Chin Med J(Engl),2010,123(5):527-531.
[5]郑跃,赖维,苏向阳,等.组织蛋白酶B在光老化皮肤的表达变化及意义[J].中华皮肤科杂志,2010,43(1):31-34.
[6]Zheng Y,Chen H,Lai W,et al.Cathepsin D repairing role in photodamaged skin barrier[J].Skin Pharmacol Physiol,2014,28(2):97-102.
[7]段青,王倩,祁庆生.绿色荧光蛋白在蛋白质研究中的应用[J].生命的化学,2007,27(1):48-51.
[8]果磊,刘波,张恒术,等.增强型绿色荧光蛋白基因转染对原代培养的人成纤维细胞细胞周期的影响[J].激光杂志,2007,28(3):93-95.
[9]Yamasaki R,Zhang J,Koshiishi I,et al.Involvement of lysosomal storage-induced p38 MAP kinase activation in the overproduction of nitric oxide by microglia in cathepsin D-deficient mice[J].Mol Cell Neurosci,2007,35(4):573-584.
[10]Egberts F,Heinrich M,Jensen JM,et al.Cathepsin D is involved in the regulation of transglutaminase 1 and epidermal differentiation[J].J Cell Sci,2004,117(Pt 11):2295-2307.
Performance of transfection with a complex plasmid encoding green fluorescent protein tagged cathepsin D in researches on chronic photodamaged fibroblasts
Zheng Yue,Chen Haiyan,Xu Qingfang,Ye Congxiu,Liu Huixian,Yi Jinling,Lai Wei.Department of Dermatovenereology,Third Affiliated Hospital,Sun Yat-sen University,Guangzhou 510630,China
ObjectiveTo evaluate the performance of transfection with a complex plasmid encoding green fluorescent protein tagged CatD (GFP-CatD)in researches on chronic photodamaged fibroblasts.MethodsHuman dermal fibroblasts(HSFs)were irradiated with ultraviolet A (UVA)at 25 J/cm2once a day for 21 consecutive days to establish a chronic photodamaged cell model.A plasmid encoding GFP-CatD was constructed and transfected into some chronic photodamaged fibroblasts (experimental group).The photodamaged HSFs receiving no treatment served as the blank control group,and those transfected with the negative plasmid encoding GFP only as the negative control group.After additional culture,fluorescence microscopy and Western-blot analysis were performed to observe and measure the expression of GFP-CatD in HSFs respectively,flow cytometry and methyl thiazolyl tetrazolium (MTT)assay to evaluate the apoptosis and proliferation of chronic photodamaged fibroblasts respectively.ResultsFluorescence microscopy showed the expression of GFP-CatD in cytoplasm of chronic photodamaged fibroblasts at 96 hours after transfection with the GFP-CatD-encoding plasmid.Western-blot analysis revealed that the expression of CatD in the experimental group was 1.28 times that in the blank control group.There were no significant differences in the apoptosis rate(4.29%±1.30%vs.3.03% ±1.70%,P>0.05)or proliferative rate(45.20% ±4.70%vs.43.60±3.90%,P>0.05)between the experimental group and blank control group.ConclusionCatD could be traced in chronic photodamaged fibroblasts with no changes in biological activity or cell cycle after transfection with the GFP-CatD-encoding complex plasmid.
Cathepsin D;Fibroblasts;Plasmids;Cell aging;Skin aging;Ultraviolet rays
Lai Wei,Email:drlaiwei@163.com
作者单位:510630广州,中山大学附属第三医院皮肤性病科
10.3760/cma.j.issn.0412-4030.2015.12.013
国家自然科学基金(81201241、81171523);广东省自然科学基金(S2012040007202);中华医学会-欧莱雅中国人健康皮肤/毛发研究项目(S2011080818)
赖维,Email:drlaiwei@163.com
2015-03-20)
(本文编辑:吴晓初)
