纤细裸藻Δ9-脂肪酸延长酶基因在解脂耶氏酵母中的表达
2015-11-05霍欢欢柳相鹤史吉平刘志文张保国大连工业大学生物工程学院辽宁大连116034中国科学院上海高等研究院上海0110
霍欢欢,柳相鹤,史吉平,刘志文,张保国,*(1.大连工业大学生物工程学院,辽宁大连116034;.中国科学院上海高等研究院,上海0110)
纤细裸藻Δ9-脂肪酸延长酶基因在解脂耶氏酵母中的表达
霍欢欢1,2,柳相鹤2,史吉平2,刘志文1,*,张保国2,*
(1.大连工业大学生物工程学院,辽宁大连116034;2.中国科学院上海高等研究院,上海201210)
从纤细裸藻cDNA中克隆出Δ9-脂肪酸延长酶基因,与解脂耶氏酵母整合载体pINA1297连接构建重组质粒pINA1297-Δ9E,用电击转化法将重组质粒转化到解脂耶氏酵母中,筛选得到阳性表达菌株YLΔ9E。在酵母浸出粉胨葡萄糖培养(YPD)条件下,工程酵母YLΔ9E的菌体生长速率高于对照菌株polf。对工程酵母YLΔ9E进行脂肪酸成分分析,结果表明Δ9-脂肪酸延长酶基因获得表达,产生了二十碳二烯酸(EDA),其含量可高达14.8%。
纤细裸藻,Δ9-脂肪酸延长酶,二十碳二烯酸,解脂耶氏酵母
多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是指含有2个或者2个以上双键的长链脂肪酸,碳原子数目一般为18~22个。除了作为结构成分和信号分子,对维持细胞膜正常功能和一些基本的细胞过程具有重要的调节作用外,还具有重要的生理功能,如降低心血管疾病风险、提高免疫力、抗癌等[1-3]。因此,PUFAs的生物合成以及合成途径中的一些关键酶受到广泛的关注,PUFAs的合成从硬脂酸(Stearic acid,SA)开始,经过一系列的脱氢和延长反应,形成各种不同的PUFAs,主要包括Δ-6脱氢酶合成途径和Δ9-延长酶合成途径[4]。目前,已经有多个PUFAs合成途径中的关键酶基因如:Δ5-脂肪酸脱氢酶基因、Δ8-脂肪酸脱氢酶基因、ω-3脂肪酸去饱和酶基因等在不同模式微生物中成功表达[5-8]。
Δ9-脂肪酸延长酶(Δ9E)是Δ9-延长酶合成途径中第一个关键酶,它可以将亚油酸(LA,C18∶2n-3)转化为二十碳二烯酸(Eicosadienoic acid;EDA),EDA又可以通过相关酶的作用合成为其他功能性的PUFAs,如二高-γ-亚油酸(DGLA)、花生四烯酸(ARA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)等[9]。另外,EDA是白三烯B4受体拮抗物,对于轻度哮喘、过敏性鼻炎有很好的治疗效果[10]。同时母乳中n-6型PUFAs,如EDA、γ-亚麻酸含量较高时,会相应的降低婴儿被母亲传染HIV的几率[11]。因此,PUFAsΔ9-延长酶合成途径中的关键酶基因Δ9E是重要的研究对象,利用基因工程手段提高Δ9E基因的表达活性,对于构建高产EDA工程菌株及研究PUFAs合成路径中相关基因调控机制具有重要意义。
解脂耶氏酵母(Yarrowa Lipolytica)是一种非常规酵母,被认为是安全的(GRAS:generally regarded as safe),因此能够用于食品生产,同时解脂耶氏酵母的基因操作平台已经建立,使得基因敲除及其他分子水平的操作或研究成为可能[12-15]。作为产油酵母,解脂耶氏酵母可以在胞内积累大量的油脂,某些情况下油脂积累量可超过其自身干重的50%[16]。但是由于野生型解脂耶氏酵母没有较为完整多不饱和脂肪酸合成途径,只能从头合成亚油酸(C18∶2n),而不能够合成其他重要的PUFAs,因此通过基因工程手段改造解脂耶氏酵母使其作为细胞工厂生产具有重要生物活性的PUFAs(如:EDA、GLA、DHA、ARA、EPA等)具有重要的意义[17-19]。本研究拟将纤细裸藻(Euglena gracilis)Δ9E基因转入解脂耶氏酵母中,研究该基因在解脂耶氏酵母中的表达,建立目的基因在解脂耶氏酵母中的表达体系,为今后通过基因工程手段构建高产PUFAs解脂耶氏酵母菌株打下基础。
1 材料与方法
1.1材料与仪器
纤细裸藻(Euglena gracilis)FACHB-849中国科学院淡水藻种库;大肠杆菌DH5α本实验室保藏;质粒pINA1297和解脂耶氏酵母polf(leucine-,uracil-)均由法国国家科学研究中心微生物学和分子遗传学实验室的Catherine Madzak教授赠送;PCR克隆载体pMD19-T simple载体TaKaRa公司;KOD DNA聚合酶ToYoBo公司;T4 DNA连接酶及PCR产物纯化试剂盒和质粒提取试剂盒TaKaRa公司;YNB(Yeast Nitrogen Base Without Amino Acids)Simga公司;DNA限制性内切酶Thermo公司;TRIzol试剂Ambion公司;反转录试剂盒(Reverse Transcription System)Promega公司;其他常规试剂国产分析纯;引物合成和测序由苏州金唯智生物科技有限公司完成;YPD培养基1%葡萄糖、1%酵母粉、1%蛋白胨;YNBcasa培养基1%葡萄糖、0.67%YNB、75 mg/mL亮氨酸;LB培养基0.5%酵母粉、1%蛋白胨、1%NaCl;HTC培养基KH2PO40.02 g/L,蛋白胨0.6 g/L,MgSO4·7H2O 0.025 g/L,酵母抽提液0.4 g/L,乙酸钠0.4 g/L,维生素B120.5 μg/L,柠檬酸钾0.04 g/L,维生素B10.04 mg/L。
S1000 PCR仪、Gel Dox XR+凝胶成像系统、PowerPac Basic核酸电泳仪美国BIO-RAD公司;Centrifuge 5430低温离心机德国Eppendorf公司;DU730紫外分光光度计德国Beckman;ZHWY-2102C恒温培养振荡器上海智城仪器制造有限公司;GC-MS HP6890气相色谱、HP5973质谱美国安捷伦公司;光照培养箱上海飞域实验室设备有限公司。
1.2实验方法
1.2.1纤细裸藻(Euglena gracilis)Δ9脂肪酸延长酶基因(Δ9E)片段的克隆采用TRIzol试剂法,提取纤细裸藻的总RNA,利用Promega公司的反转录试剂盒反转录得到cDNA。根据纤细裸藻Δ9E基因(GenBank登录号:FW504137)序列[20]设计引物:EgΔ9EF-5’-GCCTAGGCATGGAGGTGGTGAATGAAATAGTC-3’(下划线为Bln1酶切位点);EgΔ9ER-5’-CGGATCCG CTGAATCTTTTTGGCTC CCTTGT-3’(下划线为BamH1酶切位点)。以反转录获得的cDNA为模版进行PCR扩增,获得带有酶切位点的目的片段。PCR扩增条件为:94℃5 min;94℃30 s,57℃35 s,72℃1.5 min,30个循环;72℃10 min。扩增产物用DNA回收试剂盒回收后连接pMD19-T载体,转化E.coli DH5α感受态细胞,以100 μg/mL氨苄青霉素(Amp)的LB平板筛选阳性克隆子。通过菌落PCR、酶切验证,送金唯智生物科技有限公司测序,克隆质粒名为pMD-Δ9E。
1.2.2重组表达质粒pINA1297-Δ9E的构建将构建的克隆质粒pMD-Δ9E和质粒pINA1297同时经限制性内切酶BlnⅠ/BamHⅠ双酶切,纯化回收片段后,用T4 DNA连接酶将Δ9E基因片段与pINA1297相连,得到质粒pINA1297-Δ9E,转入DH5α感受态细胞,通过菌落PCR、酶切验证及测序分析后得到重组表达质粒pINA1297-Δ9E。
1.2.3解脂耶氏酵母的转化及阳性重组子的筛选与鉴定利用限制性内切酶BglⅡ将重组表达质粒pINA1297-Δ9E线性化,以电转化法将线性化的重组表达载体转化解脂耶氏酵母polf感受态细胞[21]。由于解脂耶氏酵母polf是尿嘧啶营养缺陷型的菌株,将含有尿嘧啶筛选标记基因的重组表达载体pINA1297-Δ9E转化到解脂耶氏酵母polf后,以尿嘧啶营养缺陷的YNBcasa平板筛选阳性克隆,通过提取阳性克隆的基因组,利用引物P1-5’-ATG GAGGTGGTGAATGA AATAGTC-3’;P2-5’-CTGAATCTTTTTGGCTCCCT TGT-3’进行PCR验证及测序分析,获得相应的基因工程酵母,命名为解脂耶氏酵母YL-Δ9E。
1.2.4生长曲线测定将活化后的对照菌株polf和工程酵母YLΔ9E单克隆分别接种于5 mL的YPD培养基中,当OD600值约为0.5时转接至100 mL YPD培养基中,30℃,200 r/min培养,每4 h取样,于波长600 nm处测定吸光度,测定时确保OD600值在0.2~0.8之间。
1.2.5生物量的测定当对照菌株polf和工程酵母YLΔ9E处于生长稳定期时,在104r/min下离心10 min,分别收集菌体,用去离子水清洗两次后,再次离心收集菌体,真空冷冻干燥后用于生物量的测定。
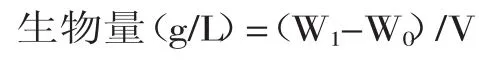
式中,W0为空瓶重,W1为干菌体重量,V为菌体总体积。
1.2.6油脂含量测定将对照菌株解脂耶氏酵母polf和工程酵母YLΔ9E分别接种到500 mL三角瓶装有100 mL的YPD的液体培养基中,在30℃和200 r/min培养条件下培养至生长稳定后期,离心收集菌体,真空冷冻干燥后得到干菌体,利用Folch方法提取油脂[22]。取1 g酵母干菌体,加入5 mL氯仿∶甲醇(2∶1),置于35℃水浴振荡1 h后,离心,取出上清保存,继续向残存的菌体中加入5 mL氯仿∶甲醇(2∶1),置于35℃水浴振荡1 h后,离心,取出上清。将两次的上清液混合后,加入3 mL蒸馏水,离心后,油脂留在下层有机相中,取出下层有机相,使用氮吹仪将有机溶剂吹干至恒重,称重并计算油脂含量。
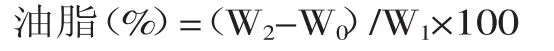
式中,W0为空瓶重,W1为冻干的菌体重量,W2为装有油脂的瓶重。
1.2.7脂肪酸组分分析分别称取约25 mg酵母粉末于酯化瓶中,加入2 mL含2%硫酸的甲醇溶液。充氮气后,于82℃水浴锅酯化反应1 h,酯化反应结束后,向酯化瓶中分别加入1 mL去离子水和1 mL正己烷,充分混匀,然后在6000 r/min下离心10 min,收集上清液至样品瓶中,氮气浓缩后用于气相色谱-质谱联用仪(GC-MS)分析[23]。
GC-MS检测中,进样量为1 μL,色谱柱的型号为DB-FFAP,进样口温度为240℃。升温程序如下:进样后在50℃保持1 min,之后以12℃/min的速率升到180℃,保持2 min后,以6℃/min的速率上升到220℃停留2 min后,以15℃/min的速率上升到240℃保持1 min后,以15℃/min的速率达到最终温度260℃,并在此保持15 min。气相色谱与质谱之间的连接温度为280℃,用高纯氮气(1 mL/min)作载气。质谱仪采用电子电离(EI)方式,电子能量为70 eV。采用面积归一法计算不同单体脂肪酸相对组百分含量。
1.3数据处理
采用Excel 2010软件进行数据处理和绘图,采用SPSS 17.0数据处理系统进行单因素方差分析(oneway ANOVA),显著性水平设为0.05。
2 结果与分析
2.1△9-脂肪酸延长酶基因(△9E)片段的克隆与分析
根据已经发表的纤细裸藻Δ9E基因序列(GenBank登录号:FW504137)设计引物,以纤细裸藻cDNA为模板,通过PCR扩展目的片段,电泳结果如图1所示,(图1中泳道1)表明克隆条带与预期大小(Δ9E:774)相一致。经TA克隆构建至载体pMD-19T后得到质粒pMD-Δ9E,经测序验证,表明其序列与该基因的目的片段完全一致。

图1 纤细裸藻Δ9E基因的cDNA扩增产物及重组质粒的限制性内切酶酶切凝胶电泳图Fig.1 Electrophoresis patterns of cDNA amplified product of Euglena gracilis Δ9E gene and the endonuclear restrictive digestion of the recombinant vectors
2.2△9-脂肪酸延长酶基因(△9E)重组表达载体pINA1297-△9E的构建
将构建的克隆质粒pMD-Δ9E和载体pINA1297(见图1泳道2)同时经限制性内切酶BlnⅠ/BamHⅠ双酶切,纯化后,用T4 DNA连接酶将Δ9E基因目的片段与pINA1297连接得到重组质粒pINA1297-Δ9E,并转化大肠杆菌DH5α感受态细胞,挑取阳性克隆经菌落PCR、提取质粒(图1泳道3)、酶切验证(图1泳道4、泳道5)及测序确认,图1结果显示,pINA1297-Δ9E质粒经BlnⅠ/BamHⅠ双酶切产生约5.3、0.7 ku两条带,说明已成功地将Δ9E基因的ORF构建到pINA1297载体的hpd4和XPR双启动子下游(见图3)。
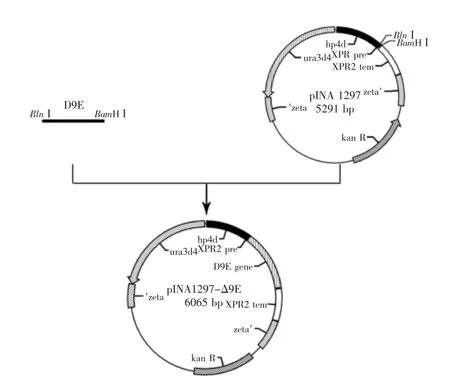
图2 重组质粒pINA1297-Δ9E的构建Fig.2 Construction of recombinant plasmids pINA1297-Δ9E
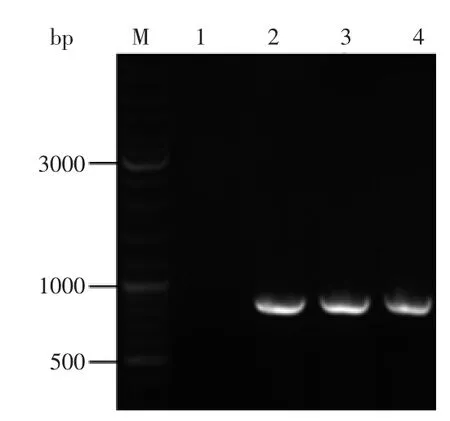
图3 转Δ9E基因解脂耶氏酵母的PCR扩增产物凝胶电泳图Fig.3 Electrophoresis pattern of amplified product from the transgenic Yarrowa Lipolytica containing recombinant vector pINA1297-Δ9E
2.3重组表达质粒pINA1297-△9E转化与筛选
pINA1297-Δ9E载体上有编码尿嘧啶的URA3基因,在被整合到解脂耶氏酵母polf(leucine-,uracil-)后,可以表达并产生尿嘧啶供酵母的生长。因此将重组表达载体pINA1297-Δ9E经线性化处理后转化解脂耶氏酵母polf,经过YNBcasa平板筛选得到重组解脂耶氏酵母的转化子。将筛选得到的阳性克隆,在不含尿嘧啶的YNBcasa培养基上继续培养10代,发现所筛选的转化子仍能够在不含尿嘧啶的YNBcasa培养基上生长,表明重组表达载体pINA1297-Δ9E已经插入酵母基因组中并随着菌体的生长能够稳定的遗传。
提取酵母基因组总DNA并作为模板,用目的片段所连接的部分载体基因序列作为引物进行PCR扩增,结果如图3所示,得到约774 bp的电泳带,测序结果表明与克隆的目的基因序列完全一致,证明重组表达载体已经成功整合入酵母基因组DNA中。
2.4转△9E基因脂耶氏酵母YL△9E细胞的生长情况
YPD液体平行培养对照菌株polf和过表达Δ-9脂肪酸延长酶基因的工程酵母YLΔ9E绘制生长曲线,结果见图4。从图4中可以看出,工程酵母YLΔ9E的生长速率显著高于对照菌株polf(p<0.05)。分析原因可能是工程酵母YLΔ9E中过表达了编码尿嘧啶的URA3基因,自身可产生尿嘧啶供酵母的生长。对照菌株polf由于尿嘧啶基因缺陷,自身不能产生尿嘧啶,而YPD培养基中没有充足的尿嘧啶维持菌株更好的生长,因此工程酵母YLΔ9E的生长速率显著高于对照菌株polf。当两株菌分别达到稳定期时,菌株polf和YLΔ9E的生物量分别达到9.5 g·L-1和10.2 g·L-1。
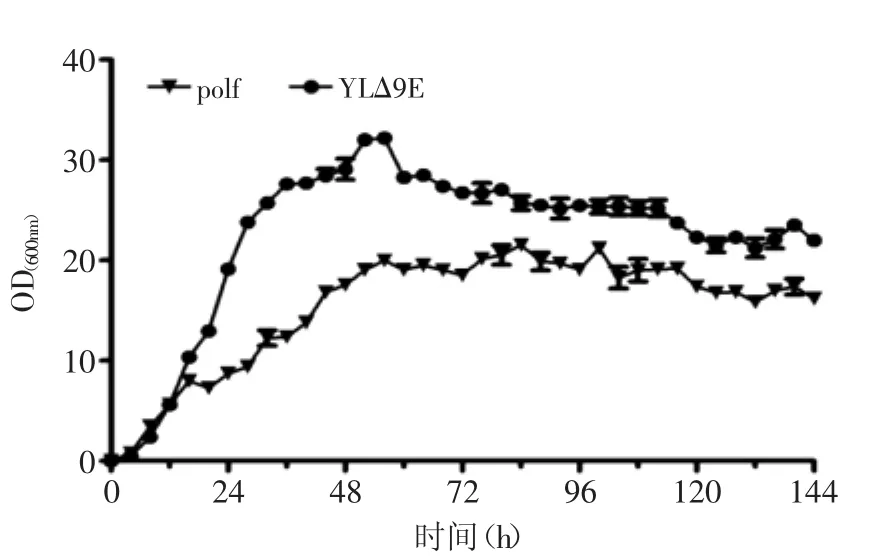
图4 转基因和野生型解脂耶氏酵母生长曲线Fig.4 Comparisons of growth curves of the transgenic Yarrowa Lipolytica(YLΔ9E)and polf
2.5转△9E基因脂耶氏酵母YL△9E脂肪酸成分分析
由表1可知,工程酵母YLΔ9E细胞中油脂含量为8.3%,与对照菌株polf相比没有显著差异,表明在解脂耶氏酵母中过表达Δ9E基因并不能提高其油脂总含量。GC-MS分析结果表明,工程酵母YLΔ9E在25.57 min左右中出现了一个新的脂肪酸峰,经鉴定为二十碳二烯酸(EDA)(见图5),表明纤细裸藻Δ9-脂肪酸延长酶基因在解脂耶氏酵母polf中获得表达,其表达量占总脂肪酸的14.8%左右(见表1)。EDA的出现与亚油酸(C18∶2)和十八碳一烯酸(C18∶1)含量的降低呈明显的一致关系,对照菌株中亚油酸和十八碳一烯酸含量分别为24.75%和44.09%,而转基因菌株中,亚油酸和十八碳一烯酸含量分别减少至16.92%和39.9%。
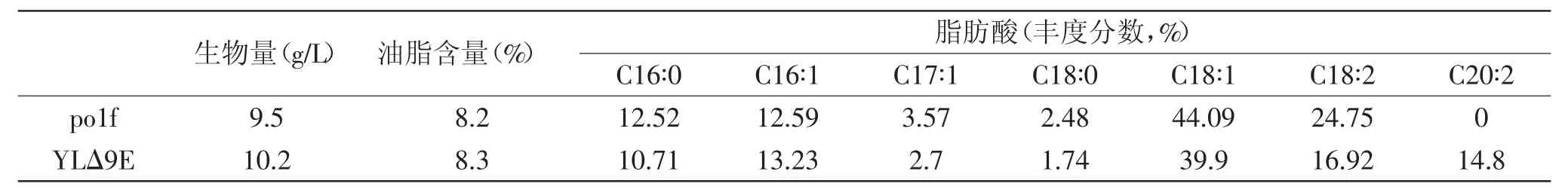
表1 转基因解脂耶氏酵母YLΔ9E细胞脂肪酸组成分析Table 1 Fatty acid compositions of total lipid from transgenic Yarrowa Lipolytica YLΔ9E
3 结论与讨论
本研究借助于质粒pINA1297将纤细裸藻(Euglena gracilis)Δ9-脂肪酸延长酶基因整合到导入解脂耶氏酵母polf中。pINA1297是一种整合型表达质粒,无需加入诱导剂,避免了对诱导物浓度、诱导时间和温度等条件进行优化的繁琐工作,使目的基因的表达更高效方便。通过营养缺陷性筛选、PCR验证,结果表明目的基因已经整合到解脂耶氏酵母基因组中,进一步利用GC-MS对转基因酵母中单体脂肪酸种类进行分析鉴定,结果表明:由于野生解脂耶氏酵母polf中含有比较丰富的油酸,所以当外源Δ9-脂肪酸延长酶基因转入后,转基因菌株可以将内源的油酸转化为亚油酸,亚油酸在总油脂中的含量达到约14%左右,表明纤细裸藻Δ9-脂肪酸延长酶在解脂耶氏酵母中获得了功能表达。同时发现,转基因菌株中油酸的含量仍然有17%左右,表明可能是由于转入的Δ9-脂肪酸延长酶基因表达活性不高,不能够将更多的油酸转化为亚油酸。因此,下一步工作应该对转入的Δ9-脂肪酸延长酶进行密码子优化,使用强启动子等方法提高外源基因在解脂耶氏酵母中更加高效的表达。本研究将在进一步的实验中继续表达PUFAs合成途径中关键酶基因,为日后以解脂耶氏酵母作为细胞工厂生产PUFAs提供理论基础与技术支持。
[1]孙翔宇,高贵田,段爱莉,等.多不饱和脂肪酸的研究进展[J].食品工业科技,2012,33(7):418-427.
[2]Lau B Y,Cohen D J,Ward W E,et al.Investigating the role of polyunsaturated fatty acids in bone development using animal models[J].Molecules,2003,18:14203-14227.
[3]Bartl J,Walitzaa S,Grünblatta E.Enhancement of cell viability after treatment with polyunsturated fatty acids[J]. Neurosci Lett,2014,559:56-60.
[4]李会珍,张志军.植物合成长链多不饱和脂肪酸研究进展[J].中国生物工程杂志,2008,28(12):112-115.
[5]杨哲,魏东盛,邢来君,等.三角褐指藻Δ5-脂肪酸脱氢酶基因的克隆及在酿酒酵母中的表达[J].生物工程学报,2009,25(2):195-199.
[6]Pollak D W,Bostick M W,Yoon H,et al.Isolation of a D5 Desaturase Gene from Euglena gracilis and Functional Dissection of Its HPGG and HDASH Motifs[J].Lipids,2012,47:913-926.
[7]李慧,欧阳珑玲,周志刚.缺刻缘绿藻ω-3脂肪酸去饱和酶基因(ω-3FAD)在酿酒酵母的低温诱导表达[J].农业生物技术学报,2012,20(7):735-744.
[8]黎明,欧秀元,杨向东,等.小眼虫藻Δ8-脂肪酸脱氢酶基因的克隆及其在酿酒酵母中的表达[J].生物工程学报,2010,26(11):1493-1499.
[9]Huang Y S,Huang W C,Li C W,et al.Eicosadienoic acid differentially modulates production of pro-inflammatory modulators in murine macrophages[J].Mol Cell Biochem,2011,358:85-94.
[10]Yagaloff K A,Franco L,Simko B,et al.Essential fatty acids are antagonists of the leukotriene B4 receptor[J].Prostaglandins Leukot Essent Fatty Acids,1995,52(5):293-297.
[11]Villamor E,Koulinska I N,Furtado J,et al.Long-chain n6 polyunsaturated fatty acids in breast milk decrease the risk of HIV transmission through breastfeeding[J].American Society for Nutrition,2007,86:682-689.
[12]赵鹤云,汪小锋,潘小幸,等.解脂耶氏酵母新型表达载体构建及癌基因rho在其中的表达[J].微生物学通报,2011,38(12):1778-1785.
[13]Blazeck J,Liu L,Redden L,et al.Tuning Gene Expression in Yarrowia lipolytica by a Hybrid Promoter Approach[J].Appl Environ Microb,2011,77(22):7905-7914.
[14]赵鹤云,黄瑛,杨江科,等.解脂耶氏酵母表达系统研究进展[J].生物加工过程,2008,6(3):10-16.
[15]Nicaud J M,Madzak C,Gysler C,et al.Protein expression and secretion in the yeast Yarrowia lipolytica[J].FEMS Yeast Research,2002(2):371-379.
[16]Beopoulos A,Cescut J,Haddouche R,et al.Yarrowia lipolytica as a model for bio-oil production[J].Prog Lipid Res,2009(48):375-387.
[17]Xue Z X,Sharpe P L,Hong S P,et al.Production of omega-3 eicosapentaenoic acid by metabolic engineering of Yarrowia lipolytica[J].Nature Biotechnology,2013,31(8):734-740.
[18]纳幕尔杜邦公司.在含油酵母中生产多不饱和脂肪酸:中国,200480019580.3[P].2010-09-08.
[19]纳幕尔杜邦公司.解脂耶氏酵母的高产花生四烯酸生产菌株:中国,200580045910.0[P].2009-05-20.
[20]Xue Z X,S Yadav,Zhu Q Q.Optimized strains of Yarrowia lipolytica for high Eicosapentaenoic acid production:United States,8,323,935B2[P].2012-12-04.
[21]Wang J H,Hung W P,Tsai S H.High fficiency transformation by electroporation of Yarrowia lipolytica[J].The Journal of Microbiology,2011,49(30):469-472.
[22]Axelsson M,Gentili F.A Single-Step Method for Rapid Extraction of Total Lipids from green Microalgae[J].PLOS ONE,2014,9(2):6.
[23]Zhang B G,Bai Z H,Hoefel D,et al.Assessing the impactof thebiologicalcontrolAgentBacillusthuringiensisonthe indigenousmicrobialcommunitywithinthepepperplant phyllosphere[J].FEMS Microbiol Lett,2008(284):102-108.
Expression of Euglena gracilis△9 fatty acid elongase gene in Yarrowa Lipolytica
HUO Huan-huan1,2,LIU Xiang-he2,SHI Ji-ping2,LIU Zhi-wen1,*,ZHANG Bao-guo2,*
(1.School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China;2.Lab of Biorefinery,Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai 201210,China)
The△9-fatty acid elongase was cloned from cDNA of the Euglena gracilis.The sequence from cDNA was ligated into pINA1297,yielding the recombinant pINA1297-△9E.Yarrowa Lipolytica Po1f was transformed with pINA1297-△9E by electroporation method and the positive transformants YL△9E were obtained by YNBcasa plates.The growth rate of transgenic strains was much higher than that of wild strain in YPD medium. Analysis of gas chromatography/mass spectrometer(GC-MS)showed that eicosadienoic acid(EDA;C20∶2n-6)
Euglena gracilis;△9-fatty acid elongase;eicosadienoic acid;Yarrowa Lipolytica
TS201.3
A
1002-0306(2015)20-0183-05
10.13386/j.issn1002-0306.2015.20.030
2015-01-22
霍欢欢(1989-),女,硕士研究生,研究方向:微生物油脂代谢调控,E-mail:huohuanhuan540@126.com。
刘志文(1972-),男,博士研究生,研究方向:植物分子生物学,E-mail:alzw@dlpu.edu.cn。张保国(1979-),男,博士研究生,研究方向:微生物油脂代谢调控,E-mail:zhangbg@sari.ac.cn。
国家自然科学基金项目(41106125)。
was detected and their percentage to total fatty acids in transgenic Yarrowa Lipolytica was 14.8%,which indicated that Euglena gracilis△9-fatty acid elongase gene was expressed in transgenic Yarrowa Lipolytica.
