嗜麦芽窄食单胞菌42-2降解黄曲霉毒素B1的效果研究
2015-11-05郝修震岳晓禹李长滨李军霞河南牧业经济学院质检系河南郑州450046中国农业大学食品学院北京00083
郝修震,岳晓禹,*,李长滨,辛 婷,李军霞(.河南牧业经济学院质检系,河南郑州450046;.中国农业大学食品学院,北京00083)
嗜麦芽窄食单胞菌42-2降解黄曲霉毒素B1的效果研究
郝修震1,岳晓禹1,*,李长滨1,辛婷1,李军霞2
(1.河南牧业经济学院质检系,河南郑州450046;2.中国农业大学食品学院,北京100083)
黄曲霉毒素B1(AFB1)对人类和家畜的健康危害很大。本文以嗜麦芽窄食单胞菌(Stenotrophomonas sp.42-2)为研究菌株,对其进行了急性毒理实验,并利用该菌的上清液、发酵液和胞外蛋白粗提取液分别进行了发霉玉米、饲料、生大黄、柏子仁和怀山药的黄曲霉毒素B1降解实验。结果表明:活菌制剂在2.56×1010CFU个/mL剂量以下不会引起急性毒性反应。在菌株42-2的上清液、发酵液和胞外蛋白粗提取液的毒素降解实验中,三者对发霉玉米中AFB1的降解率分别为:74.90%、82.60%和65.40%;对饲料中AFB1的降解率分别为:77.60%、82.50%和71.20%;对生大黄中AFB1的降解率分别为:73%、78.10%和68.40%;对柏子仁中AFB1的降解率为:76%、79.50%和70.50%;对怀山药中AFB1的降解率分别为:65.30%、69.10%和61.10%。
嗜麦芽窄食单胞菌,黄曲霉毒素B1,毒素降解,应用
黄曲霉毒素(Aflatoxin,AFT)是由Aspergillus flavus、Aspergillums nomius、Aspergillus parasiticus等多种真菌产生的次级代谢产物,其中黄曲霉毒素B1(AFB1)分布范围最广且化学性质最稳定,具有很强的毒性、致癌性、致突变性和致畸性,对人类和家畜的健康危害很大[1-3]。采用微生物或其分泌的代谢产物来对其进行生物脱毒处理条件相对温和,不会破坏产品的品质,而且具备专一性强、转化效率高、对环境没有污染等优势,代表了生物解毒的新方向,而且有些还能增加产品的风味和营养价值,从而备受研究者关注[4-8]。Liu等发现真菌假密环菌(Armillariella tabescens)的粗提液具有降解黄曲霉毒素B1的功能,并分离出一种黄曲霉毒素脱毒酶[9-10]。Teniola等从Rhodococcus erythopolis和Mycobacterium fluoranthenivorans细胞内获得的提取物具有黄曲霉毒素B1降解能力[11]。Zjalic等对白腐菌(Trametes versicolor)进行了研究,认为其具有降解黄曲霉毒素的能力[12]。Alberts等对Rhodococcus erythropolis降解毒素进行了研究,并说明其AFB1降解能力是通过酶解作用实现的[8]。对Flavobacterium Aurantiacum的文献报道表明,其不仅能显著降低液体培养基中的黄曲霉毒素,并且没有毒性副产物的生成[13-14]。利用嗜麦芽窄食单胞菌对具体实物中黄曲霉毒素进行降解效果的研究,目前国内外文献中尚不多见。本研究以实验室分离保存的嗜麦芽窄食单胞菌(Stenotrophomonas sp.42-2)为研究菌株,对其急性毒理进行了初步研究,同时利用Stenotrophomonas sp.42-2的上清液、发酵液和胞外蛋白粗提取液,选择黄曲霉毒素含量较高的样品发霉的玉米、发霉的饲料及中草药进行毒素降解实验,以分析其应用价值,为实现其商品化提供依据。
1 材料与方法
1.1材料与仪器
Stenotrophomonas sp.42-2本实验室保存;发霉玉米、发霉饲料实验室自制;怀山药、生大黄、柏子仁购自中药市场;实验动物成熟SD种小鼠40只,雌雄各半,四周龄,体重(20±2)g,SPF级,河南省农业科学院动物实验室提供;饲料SPF级小鼠生长发育标准饲料,北京科澳协力饲料有限公司。
HSX-250恒温恒湿培养箱上海和呈仪器制造有限公司;HZQ-Q全温振荡器哈尔滨东联电子设备有限公司。
1.2实验方法
1.2.1发酵液的制备果糖1.0%、胰蛋白胨1.0%、MgCl20.05 mol/L,起始pH为7.5,装液量为25 mL/300 mL三角瓶,种子液培养时间为12 h,接种量为5%,控制降解温度为35℃,摇床转速140 r/min。
1.2.2发霉玉米及饲料的制备将购自饲料兽药市场的玉米、饲料,置于恒温恒湿培养箱中,28℃、90%相对湿度条件下培养10 d,备用。
1.2.3急性毒性实验
1.2.3.1菌悬液的制备发酵液经离心处理得到菌体沉淀,用无菌水洗涤2次,涂布平板,参考依据GB/T 4789.2《食品卫生微生物学检验》进行菌落总数测定,计算出原始菌数,依次倍比稀释,配制成含三个梯度活菌数的活菌悬浮液。
1.2.3.2最大耐受量的测定菌悬液采用最大耐受实验,灌胃量为0.2 mL/只。
实验小鼠适应性饲养2 d,以了解其健康状况和正常活动情况。饲养室气温25℃,相对湿度45%。观察其毛色光亮、行动敏捷、无异常分泌物、健康活泼的动物留作正式实验用。取40只健康小鼠,雌雄各半。以体重为指标随机分成四组,每组雌雄各5只。雌雄小鼠同时进行实验。实验前全体动物隔夜禁食16 h,不限制饮水。正式实验时,按照0.2 mL/只体重经口灌喂给予受试小鼠。密切注意观察2 h,看是否有急性毒性发作,记录动物中毒症状及死亡情况,由此可推断样品引起动物哪些器官异常反应。2 h后常规饮食,连续观察7 d,每日早晨定时观察记录。根据各剂量组小鼠死亡情况查表计算最大耐受量[15-16]。
1.2.4胞外蛋白粗提取液及离心上清液的制备取发酵液置于大离心管中,6000 r/min离心15 min,得到上清液和菌体沉淀。取部分上清液进行硫酸铵沉淀,取沉淀各添加pH8.0磷酸缓冲液使沉淀溶解。溶解后将溶液装入透析袋中,置于4℃下,用pH8.0缓冲液透析除盐约24 h,得到胞外蛋白粗提取液,备用。
1.2.5发霉玉米中黄曲霉毒素降解实验
1.2.5.1发霉玉米毒素降解培养取发霉玉米样品进行粉碎,之后过20目筛,称取80.0 g,取四个250 mL具塞锥形瓶,每个瓶中加20.0 g的玉米样品,然后分别加入50 mL的上清液、胞外蛋白粗提取液以及发酵液,并以50 mL去离子水作为阴性对照,混合均匀,37℃降解72 h。每个处理做3个重复。
1.2.5.2玉米样品中黄曲霉毒素B1的测定将玉米样品液体置于80℃的烘箱中烘干,准确加入50.0 mL甲醇-水(80∶20)溶液和15.0 mL石油醚(沸程60~90℃),盖塞后150 r/min振荡30 min。用快速定性滤纸过滤于125 mL分液漏斗中,待分层后,放下下层甲醇-水溶液于50 mL烧杯内,从中取10.0 mL(相当于4.0 g样品)于蒸发皿中,65℃水浴通风挥干。用20%(20+80)甲醇-PBS2.0 mL分三次(0.8、0.7、0.5 mL)溶解并彻底冲洗蒸发皿中凝结物,移至小离心管加盖振荡后静置待测。
1.2.5.3黄曲霉毒素降解率的计算黄曲霉毒素降解率AFB1(%)=(降解前样品中黄曲霉毒素含量-降解后样品中毒素剩余量)/降解前样品中黄曲霉毒素含量×100
降解前样品中黄曲霉毒素含量单位、降解后样品中毒素剩余量单位均为μg/kg。
发霉饲料中黄曲霉毒素降解率、中草药中黄曲霉毒素降解率计算方法同上。
1.2.6发霉饲料中黄曲霉毒素降解实验
1.2.6.1发霉饲料毒素降解培养结合GB/T 5009.22法进行毒素的提取。取发霉饲料样品进行充分混匀,过20目筛,称取20.0 g,取四个250 mL具塞锥形瓶,每个瓶中加5.0 g的饲料样品,然后分别加入15 mL的上清液、胞外蛋白粗提取液以及发酵液,并以15 mL去离子水作为空白对照,混合均匀,37℃降解72 h。每个处理做3个重复。
1.2.6.2饲料样品中黄曲霉毒素B1的测定结合GB/T 17480法进行毒素的提取。首先将样品液体置于80℃的烘箱中烘干,将处理好的样品,加甲醇水溶液(1∶1)25 mL,加塞振荡10 min,过滤于50 mL磨口试管中,弃掉1/4初滤液,再收集滤液,该滤液为待测的样品提取液。
1.2.7霉变中草药中黄曲霉毒素降解实验
1.2.7.1目的中草药的筛选从实验室保存的中草药中筛选出黄曲霉毒素含量较高的中草药。具体操作是,将中草药置于PDA培养基中,在30℃条件下培养一周,从中选出长有霉菌的中草药。取霉变中草药样品进行粉碎成粉末状,充分混匀,过20目筛。取所选药材粉末各80.0 g,每种取四个250 mL具塞锥形瓶,每个瓶中加20.0 g的中草药样品,然后分别加入50 mL的上清液、胞外蛋白粗提取液以及发酵液,并以50 mL去离子水作为空白对照,混合均匀,37℃降解72 h。每个处理做3个重复。
1.2.7.2中草药样品中黄曲霉毒素B1的测定首先将样品液体置于80℃的烘箱中烘干,加甲醇水溶液(45∶55)100 mL,再加正己烷30 mL,振摇,过滤,取下层20 mL于分液漏斗中,加氯仿20 mL,振摇后静置分层,放出氯仿层,立即经盛有10 g氯仿湿润过的无水硫酸铵的定量快速滤纸过滤于蒸发皿中,65℃水浴蒸干,用20%(20+80)甲醇-PBS 2.0 mL分三次(0.8、0.7、0.5 mL)溶解并彻底冲洗蒸发皿中凝结物,移至小离心管加盖振荡后静置待测。
1.3数据处理与分析
所得数据均为3次的平均值,用SAS 9.0进行数据分析。
2 结果与分析
2.1活菌计数结果
按照要求,经过菌落总数测定后,得到原始菌数为:2.56×1010CFU/mL。
2.2灌胃结果及最大耐受量的测定
灌胃结果观察:灌胃后2 h观察,小鼠均反应正常,无异常现象。连续观察7 d,无死亡现象,均正常存活,存活7 d的小鼠解剖,无异常。结果见表1。
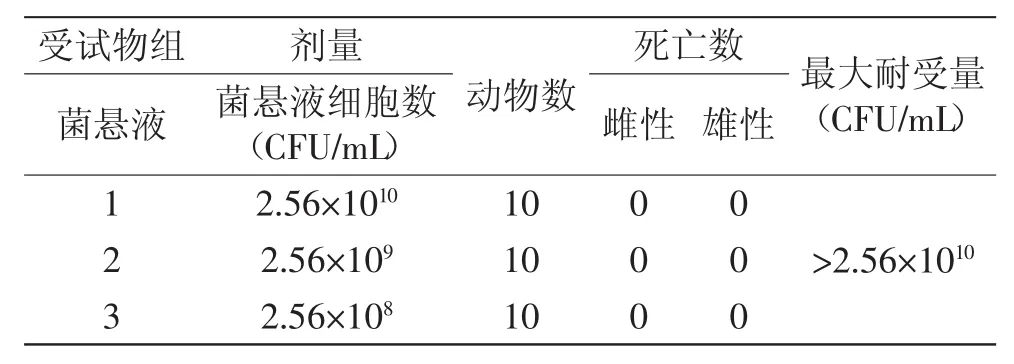
表1 菌悬液的最大耐受量Table 1 The maximum tolerance of the cells solution
小鼠对菌悬液的最大耐受量为细胞数大于2.56× 1010CFU/mL,考察成人服用益生菌活菌制剂的实际用量为每日2 g,以及FAO/WHO颁布实施的《食品益生菌评价指南》,目前商品化生产的活菌制剂的活细胞数大约为108个/mL,因此2.56×108CFU/mL是安全无毒的。在以后的研究中可以进行后续的遗传毒性实验、亚慢性毒性实验和慢性毒性实验,以确保其应用安全性。
2.3发霉玉米中黄曲霉毒素降解实验
由图1和表2可知,发酵液对发霉玉米中AFB1的降解作用最强,高达82.6%,其次为上清液,胞外蛋白粗提液的降解效果最差。可以推断出起主要作用的是降解黄曲霉毒素活性蛋白,但是在降解初期,可能由于菌体对毒素具有较强的吸附作用,此时解吸附作用不明显。分析胞外蛋白粗提液的降解效果差的原因,可能在毒素提取的过程中由于蛋白含量比较高,会出现乳化现象,这对ELISA检测试剂盒造成影响,会导致出现假阳性的结果,因而测出毒素含量较前两种要高。
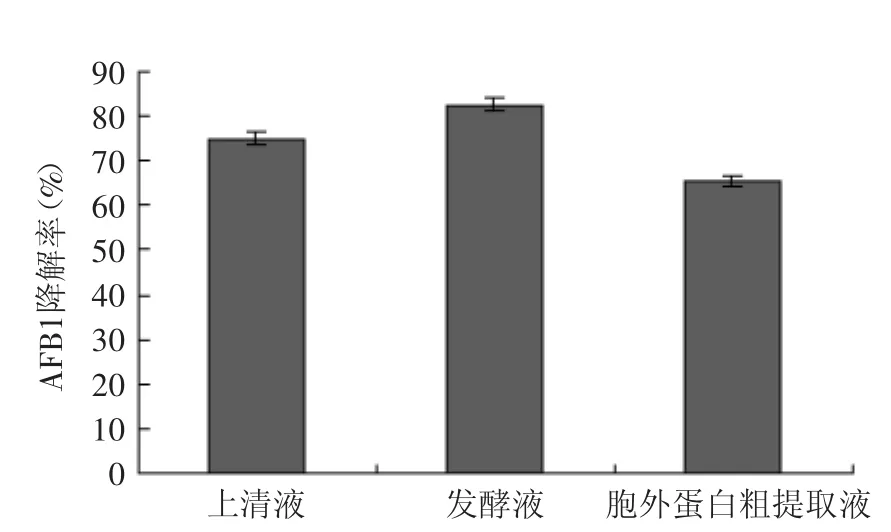
图1 不同处理对玉米中AFB1的降解效果Fig.1 The AFB1 degradation results in maize
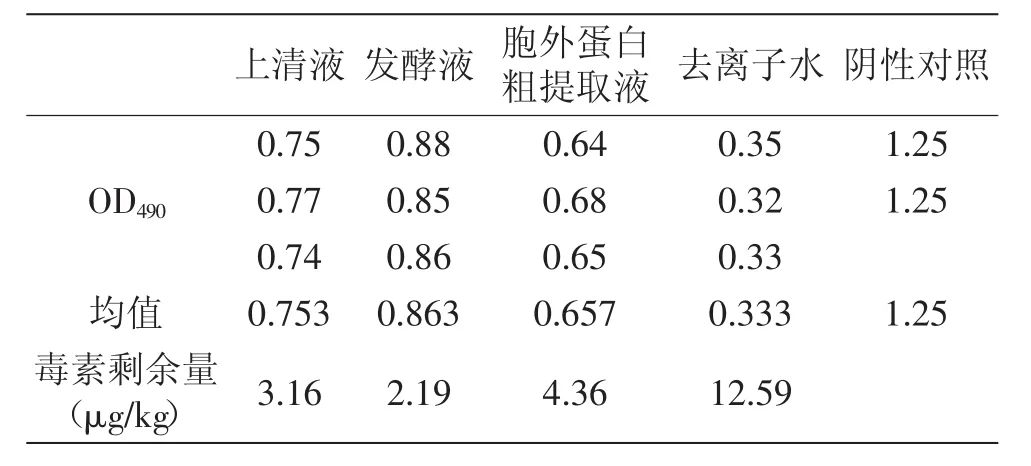
表2 ELISA检测玉米中AFB1Table 2 The results of AFB1 in maize by ELISA method
2.4发霉饲料中黄曲霉毒素降解实验

图2 不同处理对饲料中AFB1的降解效果Fig.2 The AFB1 degradation results in feed
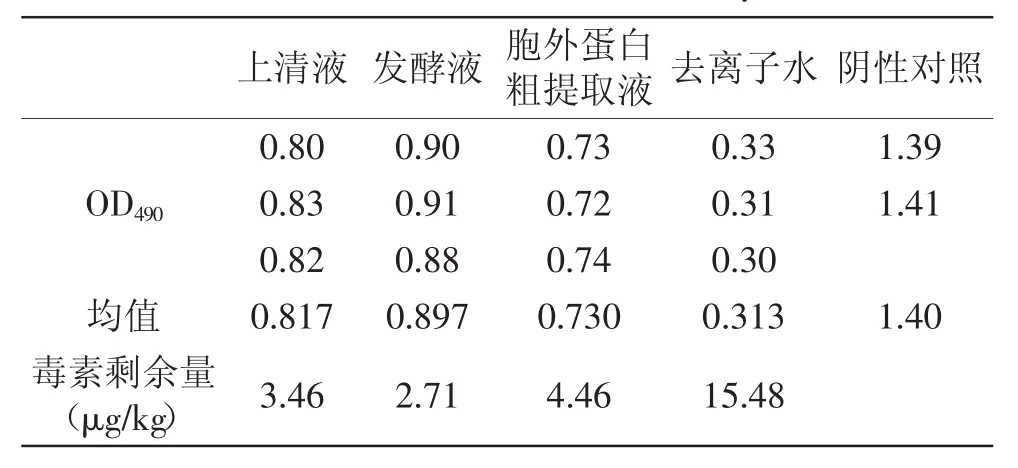
表3 ELISA检测饲料中AFB1含量Table 3 The results of AFB1 content in feed by ELISA method
由图2和表3可知,发酵液对发霉饲料中AFB1的降解作用最强,高达82.5%,其次为上清液,胞外蛋白粗提液的降解效果最差。这一趋势和降解玉米中的黄曲霉毒素基本一致。并且在实验过程中,发现加有三种不同溶液的饲料里面没有霉菌的生长,这可能是由于Stenotrophomnas sp.的活性代谢产物能有效抑制霉菌的生长,以后的实验过程中可以加深活性产物对霉菌生长机理的研究。
2.5霉变中草药中黄曲霉毒素降解实验
从实验室保存的中草药中选出三种长有霉菌的中草药,分别为生大黄、柏子仁和怀山药。然后分别用上清液、胞外蛋白粗提取液以及发酵液对其进行解毒,实验结果见表4~表6和图3。
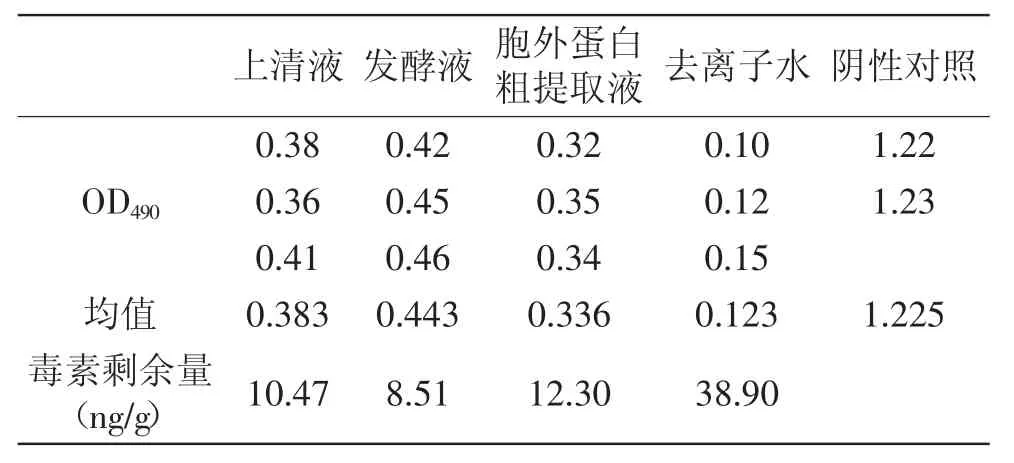
表4 ELISA检测生大黄中AFB1的结果Table 4 The results of AFB1 in rhubarb by ELISA method
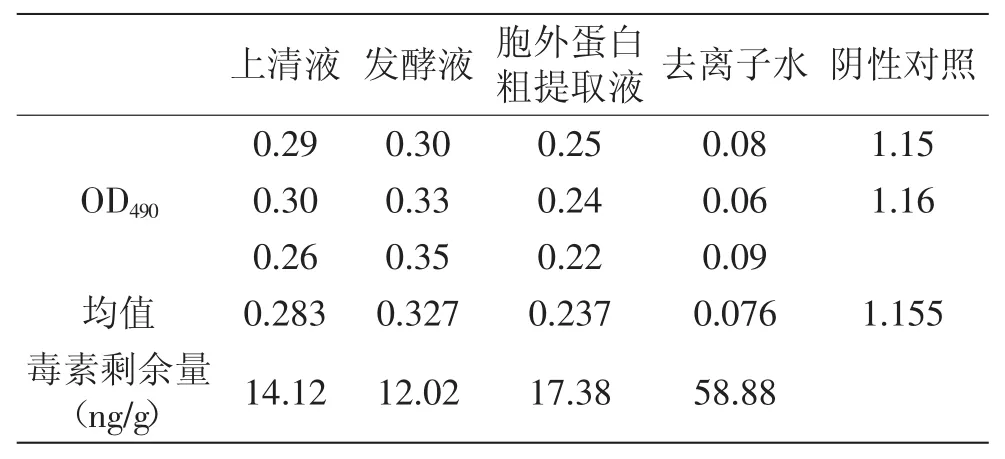
表5 ELISA检测柏子仁中AFB1的结果Table 5 The results of AFB1 in Seman Biotae by ELISA method
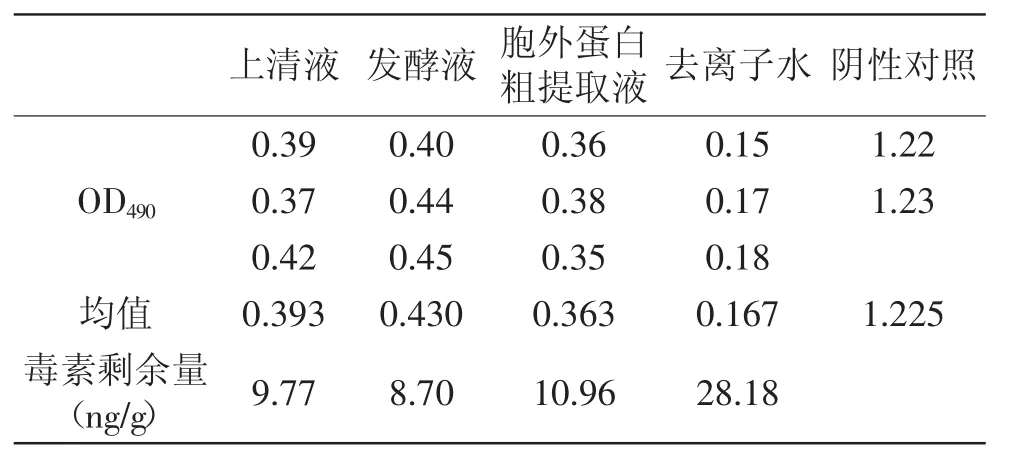
表6 ELISA检测怀山药中AFB1的结果Table 6 The results of AFB1 in yam by ELISA method

图3 不同处理对不同中草药中AFB1的降解效果Fig.3 The AFB1 degradation results in different herbal medicines
从结果可以看出,上清液、发酵液和胞外蛋白粗提取液对生大黄中AFB1的降解率分别为:73%、78.10%和68.40%;对柏子仁中AFB1的降解率为:76%、79.50%和70.50%;对怀山药中AFB1的降解率分别为:65.30%、69.10%和61.10%。从中可知,发酵液降解三种中草药中的AFB1能力最强,其次是上清液,最差的是胞外蛋白粗提取液。中草药多为植物的根、茎、叶、花、果实或全草类,含有适宜霉菌生长的成分,如糖、淀粉、蛋白质及其他营养物质,在采集的过程中,常因不能及时处理,或在贮藏过程中受潮等因素而长霉,从而产生AFB1。采用生物活性蛋白制剂来进行中草药的解毒可以达到不破坏中草药成分的目的。对毒素的降解,某些微生物可以吸附黄曲霉毒素,形成菌体黄曲霉毒素复合体,从而降低毒素的危害[17-18]。自然界中生物产生的某些酶或活性蛋白也具有分解毒素分子的功能性基团,可以把霉菌毒素转化为无毒化合物[9-11]。本研究结果初步表明,Stenotrophomonas sp. 42-2菌株分泌的胞外蛋白活性物质具有降解黄曲霉毒素的功能,与有关报道一致。Alberts等对红串红球菌降解AFB1的机理进行研究,认为其分泌的胞外酶对黄曲霉毒素产生生物降解作用[8]。Teniola等从污染的土壤中分离得到红串红球菌,其分泌的胞外酶具有较高的降解AFB1的能力[11]。Hormisch等从煤田附近污染的土壤样品中分离到一株能够AFB1的分支杆菌,进一步实验证明其对黄曲霉毒素的降解是生物酶解作用[19]。
3 结论
实验表明活菌制剂在2.56×1010CFU/mL剂量以下不会引起急性毒性反应。
使用Stenotrophomonas sp.42-2的上清液、发酵液和胞外蛋白粗提取液分别进行了发霉玉米、饲料和3种中草药的降解实验。结果表明,对发霉玉米中AFB1的降解率分别为74.90%、82.60%和65.40%;对饲料中AFB1的降解率分别为77.60%、82.50%和71.20%;对生大黄中AFB1的降解率分别为73%、78.10%和68.40%;对柏子仁中AFB1的降解率为76%、79.50%和70.50%;对怀山药中AFB1的降解率分别为65.30%、69.10%和61.10%。对黄曲霉毒素降解起到了较好的效果,为进一步开展应用研究提供了有益探索。
[1]岳晓禹,张恒业,辛婷,等.储粮预测微生物模型的研究进展[J].中国粮油学报,2012,27(5):118-123.
[2]赖先文,张荷,刘承兰.稻米中黄曲霉毒素和赭曲霉毒素A的研究进展[J].食品工业科技,2014,35(22):386-390.
[3]Kohli E,Raj H G,Kumari R,et al.Comparison of the Prevention of Aflatoxin B1-lnduced Genotoxicity by Quercetin and Quercetin Pentaacetate[J].Bioorganic&Medicinal Chemistry,2002,12(18):2579-2582.
[4]Kabak B,Dobson A D W,Var I.Strategies to prevent mycotoxin contamination of food and animal feed:a review[J].CriticalReviews in Food Science and Nutrition,2006,46(8):593-619.
[5]Smiley R D,Draughon F A.Preliminary evidence that degradation of aflatoxin B1 by Flavobacterium aurantiacum is enzymatic[J].Journal of Food Protection,2000,63(3):415-418.
[6]Motomura M,Toyomasu T,Mizuno K,et al.Purification and characterization of an aflatoxin degradation enzyme from Pleurotus ostreatus[J].Microbiological Research,2003,158(3):237-242.
[7]陈卫,翟齐啸.益生菌对食品安全危害因子的拮抗与减除[J].中国食品学报,2014,14(11):1-10.
[8]Alberts J F,Engelbrecht Y,Steyn P S,et al.Biological degradation of aflatoxin B1 by Rhodococcus erythropolis cultures[J].International Journal of Food Microbiology,2006,109(1/2):121-126.
[9]Liu D L,Yao D S,Liang R,et al.Detoxification of Aflatoxin B1 by Enzymes Isolated from Armillariella tabescens[J].Food and Chemical Toxicology,1998,36:563-574.
[10]Liu D L,Yao D S,Liang Y Q,et al.Production,purification,and characterization of an intracellular aflatoxin-detoxifizyme fromArmillariella tabescens(E-20)[J].Food andChemical Toxicology,2001,39(5):461-466.
[11]Teniola O D,Addo P A,Brost I M,et al.Degradation of aflatoxin B1 by cell-free extracts of Rhodococcus erythropolis and Mycobacterium fluoranthenivorans sp.nov.DSM44556T[J]. International Journal of Food Microbiology,2005,105:111-117.
[12]Zjatic S,Reverbefi M,Ricelli A,et al.Trametes versicolor:a possible tool for aflatoxin control[J].lnternational Journal of Food Microbiology,2006,107(3):243-249.
[13]Hao Y,Brackett R E.Removal of aflatoxin B1 from peanut milk inoculated with Flavobacterium aurantiacum[J].Journal of Food Science,1988,53:1384-1386.
[14]Line J E,Brackett R E.Factors affecting aflatoxin B1 removal by Flavobacterium aurantiacum[J].Journal of Food Protection,1995,58:91-94.
[15]龙菲,文嫱华,杨慧,等.硫酸铝钾对小鼠的急性毒性和蓄积毒性实验[J].毒理学杂志,2014,28(4):298-300.
[16]刘晓风,刘琳,王晓力,等.罂粟籽油毒理学研究与安全性评价[J].中国粮油学报,2014,29(5):65-69.
[17]Nagendra S,Xiaorong W.Aflatoxin B1 Binding Abilities of Probiotic[J].Bioscience Microflora,1999,18(1):43-48.
[18]El-Nezami H,Kankaanpaa P,Salminen S,et al.Ability of dairy strains of lactic acid bacteria to bind a common food carcinogen,aflatoxin B1[J].Food and Chemical Toxicology,1998,36:321-326.
[19]Hormisch D,Brost I,Kohring G W,et al.Mycobacterium fluoranthenivorans sp.nov.,a fluoranthene and aflatoxin B1 degrading bacterium from contaminated soil of a former coal gas plant[J].Systematic and Applied Microbiology,2004,27(6):653-660.
Study on the degradation of aflatoxin B1 by Stenotrophomonas sp.42-2
HAO Xiu-zhen1,YUE Xiao-yu1,*,LI Chang-bin1,XIN Ting1,LI Jun-xia2
(1.Department of Quality Detection and Management,Henan University of Animal Husbandry and Economy,Zhengzhou 450046,China;2.College of Food,China Agricultural University,Beijing 100083,China)
Aflatoxin B1(AFB1)does great harm to human and animal health.The test of the acute toxicity of the strain had been done.The degradation tests of the AFB1 in mould maize,feed,rhubarb,semen boitae and yam had been implemented by using the strains’culture supernatant,the fermentation broth and the extracellular enzyme extract respectively.The results showed that the microbe cells didn’t cause the reaction of the acute toxic if the biomass was lower than 2.56×1010CFU/mL.The results of the degradation test of the AFB1 were as follows.In maize,the degradation rates were 74.90%,82.60%and 65.40%respectively.In feed the degradation rates were 77.60%,82.50%and 71.20%respectively.In rhubarb the degradation rates were 73%,78.10%and 68.40%respectively.In semen boitae the degradation rates were 76%,79.50%and 70.50%respectively.In yam the degradation rates were 65.30%,69.10%and 61.10%respectively.
Stenotrophomonas sp.;aflatoxin B1;toxin degradation;application
TS201.1
A
1002-0306(2015)20-0092-05
10.13386/j.issn1002-0306.2015.20.010
2015-02-02
郝修震(1967-),男,副教授,研究方向:食品安全,E-mail:hxz3098@163.com。
岳晓禹(1974-),男,博士研究生,副教授,研究方向:食品安全,E-mail:yuerain@163.com。
国家自然基金项目(U1404332);郑州市科研攻关项目(131PPTGG422-1);河南省高等学校青年骨干教师资助计划;校科技创新团队项目(HUAHE2015015)。
