具有脱氮除硫能力的假单胞菌的筛选·鉴定与活性研究
2015-11-05黎志深王志来黄素娟贾源宾周长林
黎志深,王志来,黄素娟,贾源宾,周长林*
(1.中国药科大学生命科学与技术学院,江苏南京210009;2.南京曜动节能环保科技有限公司,江苏南京210046)
当前农业化肥的大量使用和工业污水的大量排放,导致我国水体富营养化日益严重,其中尤其以高浓度的氮、磷、硫化物引起的水污染最为严重。高浓度的氨氮和硝态氮会对许多水生动物有直接的毒害作用,使其免疫力下降,更会导致大量水产病害的发生,不利于水产养殖业的发展。
在养殖水体中大量死藻、残饵以及养殖生物排泄物等沉到水底增加了底部有机物含量,从而增加了硫化物的含量[1]。作为重要污染物之一的硫化物,同时也是监测养殖水体的重要化学指标,对鱼虾类的生长繁殖危害较为严重,有很大的毒性。硫化物通过与养殖生物血液中的血红蛋白结合从而产生硫血红蛋白,使机体中血液的携氧能力下降。另外,硫化物对养殖生物的鳃组织具有很强的刺激和腐蚀作用,可使组织产生凝血性坏死,引起生物呼吸困难,血液、肾中硫代硫酸盐水平增加,当硫化物含量于2 mg/L可导致养殖生物死亡[2]。因此,有效解决水体富营养化这个难题已成为当今亟需解决的环境问题之一,也是当今水产养殖业的研究热点之一。
生物脱氮除硫是微污染水治理和水生态调控的重要技术,一般需要反硝化细菌和硫细菌2种菌种同时参与,分别以脱氮、除硫2个过程完成[3]。生物脱氮主要在厌氧条件下以异养型反硝化细菌,以有机物为碳源和电子供体,以为电子受体,将转化为N2,从而从水体中除去[4]。A/O或A2/O工艺是生物脱氮最常用的方法,其操作工艺相对复杂,而且经常需要额外添加有机物以便进行异养反硝化,这大大提高了工程运行成本。硫化物的脱除一般是在通气条件下利用硫细菌的硫化作用将其氧化除去。据报道,近年来发展起来的生物氧化脱硫工艺多采用无色硫细菌或光合硫细菌去除硫化物,因其负荷低,单质硫黏附于细胞表面难以分离等问题而限制其实际工程应用,因此大多数研究仍停留在实验室的小试阶段而难以实际应用[5]。
研究表明,一些微生物能以硝酸盐为电子受体将硫化物氧化成单质硫[6]和硫酸盐[7]。笔者从自然环境中分离筛选出1株同时具有脱氮除硫能力的菌株,并对其活性进行了初步研究。
1 材料与方法
1.1 材料
1.1.1 土壤来源。从污水处理厂旁水沟获得淤泥。
1.1.2 培养基。①基本培养基:Na2S2O3·5H2O 5 g、KNO32 g、NaHCO31 g、KH2PO42 g、MgSO4·7H2O 0.5 g、CaCl20.05 g、NH4Cl 0.5 g,用蒸馏水定容至1 L,调节pH至 7.0,121 ℃灭菌30 min备用。②富集培养基:2X基本培养基组分。③平板、斜面培养基:在基本培养基中加入2% 琼脂。④生理生化培养基:配制方法参照文献[8]中方法。
1.1.3 仪器。FE-20pH计、TD16-W离心机、KH-500SP型双频数控超声波清洗器、721型可见分光光度计、BL600电子天平、厌氧培养盒、New Brunswick Scientific摇床、SFC-182AQLED-MS光学显微镜。
1.2 方法
1.2.1 菌株的富集分离。将从污水厂旁水沟取来的泥土5 g加入到含有100 ml富集培养基的250 ml锥形瓶中,于30℃培养箱中静置培养7 d。采用倍比稀释法将菌液稀释为10-1、10-2、10-3、10-4、10-5、10-6和 10-7梯度的菌悬液,取稀释度为10-5、10-6、10-7菌悬液各0.2 ml均匀涂布于含10 ml基本培养基的平板上。将平板用封口膜封好后倒置于30℃培养箱中培养。待菌落长出后,挑取不同形态的单菌落采用划线分离法反复进行分离纯化,直到得到单菌落的纯培养物。纯化后的菌株保存于含有基本培养基的斜面上。
1.2.2 菌株脱氮除硫能力的检测。挑取各菌株的单菌落接种到含有5 ml筛选培养基的试管中,将试管置于厌氧培养盒中30℃下培养。测定其5 d后硝态氮(NO3--N)和硫酸根(SO4
2-)浓度的变化,筛选出脱氮除硫能力强的菌株。硝态氮含量的检测采用水杨酸光度法,硫酸根浓度的检测采用铬酸钡比色法[9]。
1.2.3 菌株形态及生理生化检测。观察平板培养基中筛选菌株的菌落特征,同时进行革兰染色后在显微镜中观察。将筛选出的菌株在半固体穿刺培养基中进行穿刺培养,检测其动力活性。制备筛选菌株的菌悬液,分别接种到葡萄糖培养基、麦芽糖培养基、蔗糖培养基、硝酸盐培养基和硫酸亚铁琼脂培养基等进行生理生化检测。
1.2.4 16S rDNA测序。将纯化好的菌株斜面送交北京金唯智公司进行测序。16S rDNA检测的通用引物序列如下:27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3'。
1.3 温度、pH和金属离子对筛选菌株脱氮除硫能力的影响。
1.3.1 温度对筛选菌株脱氮除硫能力的影响。将筛选菌株进行液体培养后接种10% 到含有5 ml基础培养基的试管中置于厌氧培养盒中,分别于20、25、30、35和40℃中培养,5 d后检测其硝态氮和硫酸根浓度的变化。
1.3.2 初始pH对筛选菌株脱氮除硫能力的影响。将筛选菌株进行液体培养后接种10%到含有5 ml pH分别为5.0、6.0、6.5、7.0、7.5、8.0 和9.0 的基础培养基的试管中并置于厌氧培养盒中培养,5 d后检测其硝态氮和硫酸根浓度的变化。
1.3.3 金属离子对筛选菌株脱氮除硫能力的影响。在基础培养基中分别加入2.5 mmol/L的CuSO4和CoCl2·6H2O,将筛选菌株进行液体培养后接种10%到这2个培养基中培养,5 d后检测其硝态氮和硫酸根浓度的变化。
2 结果与分析
2.1 菌株的脱氮除硫能力 从淤泥的富集物中分离出50个菌株,经初筛挑选出10株进行硝态氮和硫酸根浓度的检测试验。培养5 d后检测其硝态氮和硫酸根的浓度(图1),与培养前对比,得出硝态氮降解率和硫酸根生成率(表1)。在初始硝态氮浓度为270.8 mg/L,硫酸根浓度为402.1 mg/L的条件下经过5 d培养后,与对照相比所有菌株硝态氮浓度都有一定程度下降,最低降解率为15.2%,硝态氮浓度为229.5 mg/L;最高降解率为93.9%,硝态氮浓度下降到16.6 mg/L。硫酸根浓度与对照相比也有一定程度上升,最低生成率为12.7%,硝态氮浓度上升为453.1 mg/L,最高生成率达到74.9%,此时硝态氮浓度为703.2 mg/L。结果表明,所有筛选出的菌株都具有一定程度的脱氮或除硫能力,但两者效果不一样。JD4的硝态氮降解率和硫酸根生成率都超过70%,因此选择JD4作为后续的试验对象。
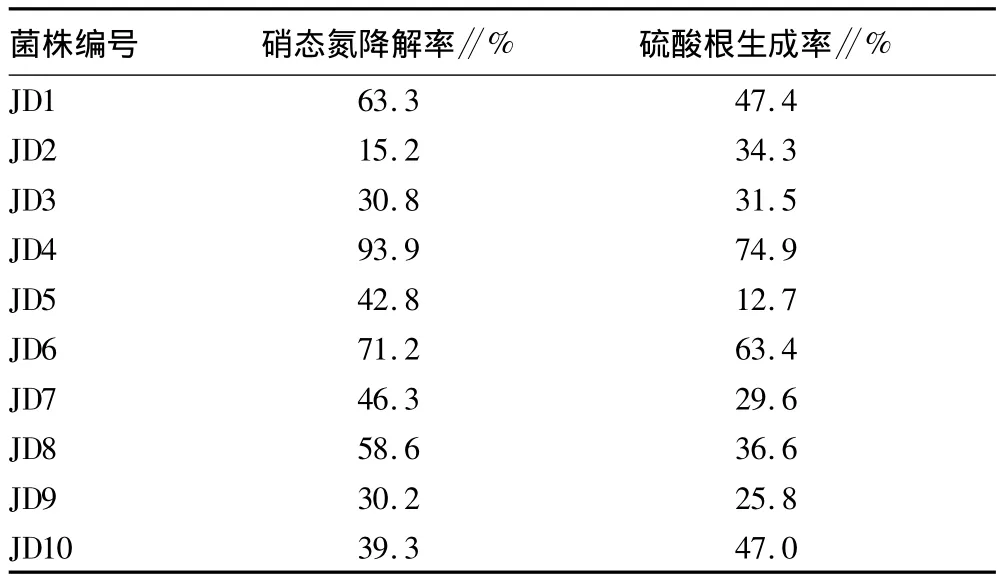
表1 培养5 d后菌株硝态氮降解率和硫酸根生成率的变化

表2 菌株JD4的生理生化鉴定结果
2.2 菌株形态及生理生化检测结果 从图2可以看出,JD4在平板中培养2 d后发现菌落呈针尖状,透明,扁平湿润,菌落直径约为1.0~1.5 mm。经革兰染色后用光学显微镜观察,JD4的细胞呈杆状,单个或短链状排列,有鞭毛,无芽孢,革兰阴性(表2)。
2.3 16S rDNA测序结果 将筛选到的菌株委托北京金唯智公司进行16S rDNA扩增及序列测定,得到全长为1 421 bp碱基对核苷酸序列。将测得的序列在NCBI网站上用BLAST程序进行比对,对其进行了同源分类鉴定,发现其与假单胞菌属(Pseudomonassp.)的多个菌株序列的相似性都达到99%以上。将其与部分参考菌株进行了DNA序列的对比,并通过Mega 6.0软件做出了菌株JD4的系统发育树(图3)。
2.4 温度对筛选菌株脱氮除硫能力的影响 从图4可以看出,温度范围在20~40℃内JD4在30℃下硝态氮降解率为91.2%,硫酸根生成率为83.9%,均为最大值,表明30℃为JD4脱氮除硫的最适温度。
2.5 初始pH对筛选菌株脱氮除硫能力的影响 从图5可以看出,硝态氮降解率和硫酸根的生成率随pH的增大而增大,在pH 7.0时硝态氮降解率达到最大值(92.2%),而硫酸根生成率为61.7%;在pH 7.5时,硝态氮降解率为84.0%,硫酸根生成率达到最大值(66.8%)。这表明JD4在pH为7.0~7.5时脱氮除硫效果最好。
2.6 金属离子对筛选菌株脱氮除硫能力的影响 在实际的养殖水体中很可能含有浓度不一的金属离子,其中比较常见的是Cu2+和Co2+。从图6~7可以看出,Cu2+和Co2+的存在能明显抑制JD4的脱氮除硫能力。因此,该菌株不适合用于高浓度金属离子污水的治理。
3 小结
笔者通过使用选择性培养基从污水淤泥中分离到具有同步脱氮除硫作用的菌株10株,各菌株脱氮除硫能力不同。其中硝态氮最高降解率为93.9%,硫酸根最高生成率达到74.9%。根据菌落形态特征、生理生化鉴定及16SrDNA序列测序,脱氮除硫效果最好的JD4被认为属于假单胞菌属(Pseudomonassp.)。
该试验结果表明JD4脱氮除硫的最适温度为30℃,最适pH为7.0~7.5,不适用于含有高浓度金属离子的养殖水处理。
与化学物理法处理养殖水和污水相比,利用微生物不仅省时省力而且不再对环境进行二次污染。该研究筛选出的假单胞菌JD4具有良好的脱氮除硫能力,可以碳酸氢盐为碳源、硫化物为能源和硝态氮为氮源生长,对营养要求不高,其在厌氧条件下能以S2-为电子供体使硫化物氧化为S或、以 NO3-为电子受体使硝酸盐还原为N2、S 和少量的SO42-都是在自然水生态中可接受的无毒物质,因此该菌株在水处理工程、微污染水的脱氮除硫和在自然水体的生态调控中具有应用价值[11]。该菌在自养条件下即可发挥作用,后续可以通过驯化获得能在低温进行脱氮除硫的菌株,更有利于实际应用。同时,假单胞菌可与脱氮硫杆菌[12]、芽孢杆菌[13]等具有净水能力的菌株制成微生物混合制剂,能更全面有效治理各种污染水体。
[1]吴伟,范立民.水产养殖环境的污染及其控制对策[J].中国农业科技导报,2014,16(2):26-34.
[2]王琼,吴伟.脱氮硫杆菌及其在水产养殖中的应用[J].现代农业科技,2012(14):252-256.
[3]辛明秀,赵颖,周军,等.反硝化细菌在污水脱氮中的作用[J].微生物学通报,2007,34(4):773-776.
[4]陈子爱.同步脱氮除硫菌株的筛选、分离和鉴定[J].中国沼气,2008,26(6):3-7,12.
[5]王爱杰,杜大仲,任南琪.脱氮硫杆菌同步脱硫反硝化技术的关键因素研究[J].地球科学进展,2004,19(S1):533-536.
[6]蔡靖,郑平,胡宝兰,等.pH和碱度对同步厌氧生物脱氮除硫工艺性能的影响[J].化工学报,2008,59(5):1264-1270.
[7]GONZALEZ-SANCHEZ A,REVAH S.The effect of chemical oxidation on the biological sulfide oxidation by an alkaliphilic sulfoxidizing bacterial consortium[J].Enzyme and Microbial Technology,2007,40(2):292-298.
[8]周德庆.微生物学实验手册[M].上海:上海科技出版社,1981:122-132,137-163.
[9]邓礼明,黄俊锋,张为朋.超声-酸性铬酸钡分光光度法测定水中硫酸盐[J].中国热带医学,2009,9(2):363-364.
[10]李献,马光庭.生物脱氮除硫(S2-)菌株的分离和特征[J].广西农业生物科学,2006,25(1):52-64.
[11]席婧茹,刘俊新,徐爽,等.脱氮硫杆菌的脱硫特性及其处理恶臭物质硫化氢的应用[J].微生物学通报,2014,41(7):1402-1409.
[12]叶良涛,左胜鹏.脱氮硫杆菌自养反硝化及其影响因素研究进展[J].环境科学与管理,2011,36(3):58-63.
[13]YANG SP,WANG SM,ZHANG DW,et al.Isolation and nitrogen removal characteristics of an aerobic heterotrophic nitrifying-denitrifying bacterium,Bacillus subtilisA1[J].Bioresource Technology,2011,102:854-862.
