进展期帕金森病的脑深部刺激治疗
2015-11-04蒋顶徐俊章文斌
蒋顶 徐俊 章文斌
进展期帕金森病的脑深部刺激治疗
蒋顶 徐俊 章文斌

章文斌 教授
帕金森病(Parkinson disease,PD)是发生于中老年人群的进展性神经系统疾病。其主要病理改变为黑质部位为主的多巴胺能神经元的进行性丢失以及残存神经元内路易氏包涵体的形成。主要临床特征为静止性震颤、肌强直、运动迟缓和姿势反射障碍。进展期PD常常被定义为Hoehn-Yahr分期的4期和5期,但更多的学者认为在持续的药物和行为治疗基础上出现运动并发症是疾病进展的标志[1]。
我国≥65岁老人中PD的发病率达1.7%。PD诊断后早期应该进行有效的药物治疗,但病程5年后大约有40%、病程10年后大约有80%的患者出现运动并发症,主要包括以开关现象和剂末衰竭为主的运动波动以及异动症等,此时应考虑进行脑深部刺激(deep brain stimulation,DBS)治疗。DBS手术适应证包括:(1)原发性PD;(2)服用复方左旋多巴曾经有良好的效果;(3)疗效已明显下降或出现严重的运动波动或异动症以及难以控制的震颤;(4)排除痴呆和严重的精神疾病。
1 DBS治疗PD
DBS是将电极植入到脑深部特定区域,起搏器根据设定参数发放连续电脉冲,经过植入电极刺激脑内相关神经核团,控制引起疾病症状的异常脑活动,达到治疗疾病的目的[2]。DBS自1987年发展至今,已成为功能神经外科领域中的重要手术方法之一,其对PD、肌张力障碍、特发性震颤等运动障碍疾病治疗的有效性和长期稳定性已得到世界公认,具有选择性好、靶点明确、微创、可调、可逆等优点[3]。截至2014年,全球已有超过100,000例患者接受DBS治疗[4],但仍有数以百万计的患者正在等待接受该项治疗。
在我国,PD成为DBS技术应用最多的病种,可以全面改善PD 3大主要症状:静止性震颤、肌僵直、运动减少。丘脑底核(STN)是目前DBS治疗PD的首选靶点,其次为苍白球内侧部(GPi)、脚桥核(PPN),不同治疗靶点对PD症状改善情况有所不同。近年来,有3项随机对照临床研究对比GPi与STN-DBS与最佳药物治疗对进展型PD患者的疗效,认为DBS优于药物治疗,并且显著改善患者生活质量,术后6月手术组可以达到每天4.6 h的无症状开期,而药物治疗组为0 h,术后1年代表生活质量的PDQ-39评分手术组为5.0,而药物组为0.3,均具有显著差异(P<0.001)[5-7]。
NSTAPS随机对照试验对比了65例GPi-DBS和63例STN-DBS,从改善症状的角度,GPi与STN具有同样的效果,认为2个靶点在不良反应方面没有差别,但STN在改善关期症状方面优于GPi,STN和GPi刺激均还可以减轻运动波动和左旋多巴诱导的运动障碍(1evodopa-induceddyskinesia,LID),STN-DBS术后患者能够减少抗PD药物的用量,从而减轻LID;而GPi-DBS术后并未见到药量减少,其作用是直接的,虽然2个靶点效果相同,考虑到核团大小以及耗电量的问题,作者认为进展期PD患者应当优先选择 STN-DBS[8]。也有学者认为STN-DBS适合于术前药物剂量比较大而认知功能基本正常的患者,GPi-DBS适合于运动障碍及术前已经存在认知功能问题的患者,同时应考虑患者临床表现的亚型,采取针对性的个体化的治疗方案[9]。PD晚期可出现姿势异常步态障碍(postural instability gait difficulty,PlGD),也称为中线症状,可在DBS术后短期内缓解,但长期效果并不理想,远远低于震颤症状的改善程度[10],PPN-DBS对姿势不稳和步态障碍有特异性的治疗作用,还有待进一步的验证[11]。
PD的非运动症状涉及多个系统:神经精神症状如抑郁、焦虑、记忆力下降;睡眠障碍如失眠、嗜睡、不安腿;自主神经功能障碍如体位性低血压、便秘、尿急尿频、多汗;胃肠道症状如流涎、吞咽困难;此外,还有疼痛、嗅觉减退等等。值得注意的是,DBS术后部分患者非运动障碍症状减轻,其原因可能是运动障碍症状改善或者抗PD药物剂量的减少,DBS对于非运动障碍症状尤其是认知和精神症状的改善仍缺乏证据支持,但可以明显改善PD相关疼痛以及睡眠症状[12-14]。
总体来讲,DBS手术是安全和有效的,手术相关的并发症主要是谵妄与意识错乱,往往是一过性的,在STN-DBS术后较GPi-DBS术后更容易出现,颅内出血的比例大约为1%~2%,手术或设备相关的感染比例大约为10%,此外,可能出现的并发症还包括幻想、幻觉、抑郁、焦虑、淡漠、体质量增加,以及轻度的视野缺损等[15]。
2 DBS靶点定位技术
在DBS治疗方法的临床应用中,电极植入靶点的精确定位是直接决定疗效的关键因素。而脑深部神经核团结构复杂,许多核团几何结构仅仅为数毫米至十余毫米(图1),电极植入的微小偏差将会导致治疗效果的显著降低,同时刺激非治疗靶点有可能引起构音障碍、癫、异动症、认知、情绪改变等不良反应。在电极植入有误时,临床上往往通过加大电刺激强度以达到预期治疗效果,但这将减少植入装置的电池使用寿命,而且大范围刺激将进一步带来更多潜在不良反应。对于手术而言,电极植入到预定脑功能区靶点的精度与准确性是手术治疗效果的决定性因素,同时也是降低并发症、减小不良反应的关键因素。需要说明的是,即使是在最好的中心接受治疗,DBS电极也有可能会被植入到不满意的位置,有可能需要通过再次手术在一个更加满意的位置植入电极[16]。
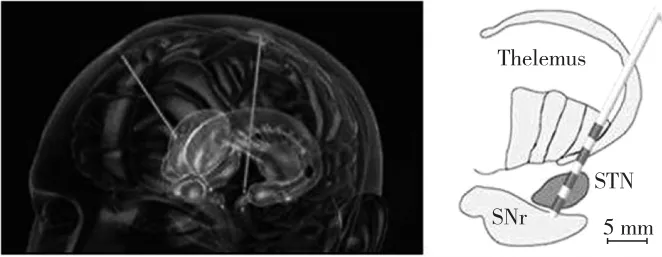
图1 DBS靶点定位
目前临床上DBS电极植入定位方法主要可以分为以下2大类,一种是基于解剖学的影像学定位,另外一种是基于电生理学的微电极记录。
影像学定位主要是利用手术前脑室造影、CT影像、核磁共振影像方法并与标准图谱进行比对分辨神经核团的结构,标出靶点并计算靶点位置坐标,换算成立体定向系统上的三维坐标,安装立体定向仪,利用立体定位脑支架系统预先设定植入位置的坐标,然后在术中以微推进器导入至靶点,针道的角度和方向依赖于立体定向仪上的三维坐标值[17]。此外也有医院利用术中核磁共振对电极植入位置进行确认。尽管术前核磁共振能够提供高空间分辨率的图像,但是由于磁场不均匀、磁场强度非线性梯度及框架类型不同所致的图像失真[18]、在术中开颅后会有脑移位[19]等原因,导致预先设定的靶点位置与术中DBS电极植入位置会有偏差,误差可达到2.5~3.2 mm[20-21]。术中核磁共振可以克服脑组织移位的问题,但其缺点为由于使用1.5 T核磁扫描所致分辨率较低;此外,核磁共振图像中电极周围因金属触点形成椭圆形的阴影[22],影响了周围神经核团结构的识别[23]。因手术室设备复杂和成本较高等因素,中国仅有个别医院开展了DBS植入术中核磁共振扫描[24]。此外,基于影像的定位分析也存在个体差异大的问题[25],并且在一定程度上会受到所用坐标系统或者图谱的影响。
电极植入靶点的精确定位技术是临床的迫切需求。目前临床主要使用微电极单神经元记录或者影像学方法进行电极靶点功能和结构定位[26]。微电极记录是将尖端约几微米的针插入脑中记录单神经元放电,根据对微电极记录的神经元放电的特征,对靶点及其周围结构的电生理特性进行监测,在术中对靶点进行功能定位。
通过植入到脑深部的DBS电极可直接记录神经电活动,这些脑深部场电位神经活动信号具有高时间和空间分辨率,它反映了神经核团的集群同步化或去同步化神经波动,蕴涵了丰富的与生理和病理功能相关的信息。脑深部局部场电位具有神经波动特性,由多个频率成分组成,如3~8 Hz与PD震颤症状相关,10~30 Hz的Beta成分与运动、PD的行动迟缓相关,并且与药物、DBS的治疗效果相关。在多巴胺受体激动剂的作用下,STN的Beta成分明显降低,其降低幅度与症状的改善程度相关。DBS作用于STN,可显著抑制场电位的Beta成分,且降低程度与症状的改善密切相关[27]。
3 影响手术效果的重要因素
在行DBS治疗前,应对PD的诊断及适应证进行再次确认。并确定DBS手术治疗的最佳时机。由于PD是一种进行性的疾病,而DBS手术冶疗也仅是对症治疗手段,因此过早进行手术并不可取,但盲目延迟手术时机同样是不明智的,早期手术患者无论在生活质量的改善以及运动功能的提高方面明显好于晚期手术者,与手术前相比,术后8年早期手术组生活能力下降28.7%,而晚期手术组下降43.8%[28],从另一个侧面说明DBS手术对PD病程的发展具有一定的延缓作用。年龄和疾病病程是患者选择DBS手术的重要因素,年龄较轻的患者有更多提高生活质量和改善运动障碍症状的机会,以及更少的认知并发症和更为缓慢的中轴症状的恶化;病程>5年,特别是出现药物疗效已明显下降或出现严重的运动波动或异动症时,均是考虑接受DBS植入的合适时机[29]。
4 PD患者的全程管理
神经内科、神经外科、精神科、心理科以及康复科医师的密切配合与合作对于DBS治疗的顺利实施十分重要。术前要对患者的病情进行正确诊断,判断患者是否适合手术、是否合并认知及精神障碍。手术风险与近远期疗效的评估,最佳手术靶点的确定、手术后DBS刺激参数的程控、抗PD药物的调整、心理治疗、功能康复训练、随访等一系列工作均需要神经外科、神经内科、精神科、心理科医师的参与和合作来共同完成。在一些专业的中心,甚至成立了多科联合门诊,为PD患者提供全面综合的治疗方案,术前由神经内科和精神、心理医师进行评估,康复科医师在手术前即着手制定有针对性的康复计划,手术中神经内科医师配合神经外科医师进行手术效果的评定。手术后神经内科医师进行药物调整,大多数患者手术后可以减少抗PD药物的用量,并且药物的调整和刺激器参数的程控需要相互配合。术后需要通过多次随访来调整DBS刺激参数(大约需要3~6月),直到刺激参数达到最佳,并且仍然需要6~12月进行随访和参数调整(具体情况与患者治疗模式密切相关)。当神经刺激器的电池快要耗尽时,需要进行更换,但电极和导线无须更换。强调团队协作,建立一支由神经外科、神经内科、精神科、心理科,康复科组成的DBS团队,对患者实施术前及术后的全程管理,以确保接受DBS治疗取得满意的疗效[30]。
5 设备研发与发展
随着DBS的发展,脑深部电刺激器的性能和实用性等方面也不断得到改进。三维多触点电极已经在研发过程中,它可以实现更精确的、不良反应更小的刺激模式[31]。可兼容高场强磁共振的脉冲发生器相信在不久的将来也会面世,刺激器也向小型化发展,目前非充电式电池寿命可达9年,充电式刺激器电池寿命可达10年以上。刺激方式在原有“开环刺激”(open-loop stimulation)的模式上,开发“闭环刺激”(close-loop stimulation),依据大脑功能变化情况形成反馈环路,进行实时反馈刺激治疗,这将有效降低电池能耗,更适用于一些特殊病种的治疗。术后远程程控已经成为现实。随着人类脑计划的开展,DBS技术有望成为了解大脑功能和神经网络结构的有力工具。
[1] Schrag A,Dodel R,Spottke A,et al.Rate of clinical progression in Parkinson's disease.aprospective study[J].Mov Disord,2007,22 (7):938-945.
[2] Deep-BrainStimulationfor Parkinson's DiseaseStudyGroup. Deep-brain stimulation of the subthalamic nucleus or the pars interna of the globus pallidus inParkinson's disease[J].N Engl JMed,2001,345(13):956-963.
[3] Benabid AL.Deep brain stimulation for Parkinson's disease[J].Curr OpinNeurobiol,2003,13(6):696-706.
[4] Deuschl G,Schade-Brittinger C,Krack P,et al.A randomized trial of deep brain stimulation for Parkinson's disease[J].N Engl JMed,2006,355(9):896-908.
[5] Weaver FM,Follett K,Stern M,et al.Bilateral deep brain stimulation vs bestmedical therapy for patientswith advanced Parkinson disease:a randomized controlled trial[J].JAMA,2009,301(1):63-73.
[6] Williams A,Gill S,Varma T,et al. Deepbrainstimulationplus best medical therapy versus best medical therapyaloneforadvanced Parkinson'sdisease(PDSURG trial):arandomised,open-label trial[J].Lancet Neurol,2010,9 (6):581-591.
[7] Odekerken VJ,van Laar T,Staal MJ,et al.Subthalamicnucleus versus globuspallidus bilateral deep brainstimulationforadvanced Parkinson'sdisease(NSTAPS study):a randomised controlled trial [J].Lancet Neurol,2013,12(1):37-44.
[8] Williams NR,Okun MS.Deep brain stimulation(DBS)at the interface of neurology and psychiatry[J].JClin Invest,2013,123(11):4546-4556.
[9] Katz M,Luciano MS,Carlson K,et al.Differential effects of deep brain stimulation target on motor subtypes inParkinson'sdisease[J].Ann Neurol,2015,77(4):710-719.
[10]Kim SD,Allen NE,Canning CG,et al.Postural instability inpatients with Parkinson's disease.Epidemiology,pathophysiologyand management[J].CNS Drugs,2013,27(2):97-112.
[11]Smith H,Gee L,Kumar V,et al. Deep brain stimulation significantly decreases disability from lowback paininpatientswithadvanced Parkinson's disease[J].Stereotact Funct Neurosurg,2015,93(3):206-211.
[12]Cury RG,GalhardoniR,Fonoff ET,etal.Effectsofdeepbrain stimulationonpainandother nonmotor symptoms in Parkinson disease[J].Neurology,2014,83(16):1403-1409.
[13]KimHJ,JeonBS,PaekSH. Nonmotor symptoms and subthalamic deep brain stimulation in Parkinson's disease[J].JMov Disord,2015,8 (2):83-91.
[14]Da Cunha C,Boschen SL,Gómez-A A,et al.Toward sophisticated basal ganglia neuromodulation:Review on basal ganglia deep brain stimulation [J].Neurosci Biobehav Rev,2015,pii:S0149-7634(15)00048-2.
[15]高国栋,王学廉,李楠.脑深部电刺激-帕金森病外科治疗适宜技术-《中国帕金森病脑深部电刺激疗法专家共识》解读[J].中华医学信息导报,2012,27(18):22-23.
[16]杨岸超,马羽,刘焕光,等.Leksell三维手术计划系统联合3.0T核磁共振辅助丘脑底核脑深部电刺激手术[J].中国微侵袭神经外科杂志,2011,16(2):56-59.
[17]SumanaweeraTS,Adler JRJr,Napel S,et al.Characterization of spatialdistortioninmagnetic resonanceimagingandits implications for stereotactic surgery [J].Neurosurgery,1994,35(4):696-704.
[18]Khan MF,Mewes K,Gross RE,et al.Assessment of brain shift related to deep brain stimulation surgery[J]. Stereotact Funct Neurosurg,2008,86 (1):44-53.
[19]Guo T,Finnis KW,Deoni SC,et al. Comparisonofdifferenttargeting methodsforsubthalamicnucleus deep brainstimulation[J].Med Image Comput Comput Assist Interv,2006,9(Pt 1),768-775.
[20]Toda H,Sawamoto N,Hanakawa T,et al.A novel composite targeting method using high-fieldmagnetic resonanceimagingforsubthalamic nucleus deep brain stimulation[J].J Neurosurg,2009,111(4):737-745. [21]Pollo C,Villemure JG,Vingerhoets F,et al.Magnetic resonance artifact inducedbytheelectrodeActiva 3389:an in vitro and in vivo study [J].ActaNeurochir(Wien),2004,146(2):161-164.
[22]Rezai AR,Baker KB,Tkach JA,et al.Is magnetic resonance imaging safeforpatientswith neurostimulationsystemsusedfor deep brain stimulation?[J].Neurosurgery,2005,57(5):1056-1062.
[23]Derrfuss J,Mar RA.Lost in localization:The need for a universal coordinatedatabase[J].Neuroimage,2009,48(1):1-7.
[24]Anderson JS,Dhatt HS,Ferguson MA,et al.Functional connectivity targeting for deep brain stimulation in essential tremor[J].Am J Neuroradiol,2011,32(10):1963-1968.
[25]Caire F,Ranoux D,Guehl D,et al. A systematic review of studies on anatomicalpositionofelectrode contacts used for chronic subthalamic stimulationinParkinson's disease [J].Acta Neurochir(Wien),2013,155(9):1647-1654.
[26]Verhagen R,Zwartjes DG,Heida T,et al.Advanced target identification in STN-DBSwith beta power of combinedlocalfieldpotentialsand spiking activity[J].JNeurosci Methods,2015,253:116-125.
[27]Merola A,Romagnolo A,Bernardini A,et al.Earlier versus later subthalamicdeepbrainstimulationin Parkinson's disease[J].Parkins Relat Disord,2015,21(8):972-975.
[28]Krüger R,Hilker R,Winkler C,et al. AdvancedstagesofPD:interventional therapies and related patient-centered care[J].J Neural Transm,2015.[Epubaheadof print]
[29]中国帕金森病脑深部刺激疗法专家组.中国帕金森病脑深部电刺激疗法专家共识[J].中华神经科杂志,2012,45(7):541-543.
[30]Bour LJ,Lourens MA,Verhagen R,et al.Directionalrecordingof subthalamic spectral power densities in parkinson's disease and the effect of steering deep brain stimulation [J].Brain Stimul,2015,8(4):730-741.
[31]Fasano A,Lozano AM.Deep brain stimulation for movement disorders:2015 and beyond[J].Curr Opin Neurol,2015,28(4):423-436.
R 742
A
10.3969/j.issn.1003-9198.2015.12.004
2015-08-20)
南京市卫生青年人才培养第一层次(QRX11009)
210029 江苏省南京市,南京医科大学附属脑科医院神经外科(蒋顶,章文斌);225001江苏省扬州市,苏北人民医院神经内科(徐俊)
