基于量子点的荧光传感微流纸基芯片离子印迹法检测铜离子
2015-11-03王欣然等
王欣然等


摘 要 基于离子印迹技术,采用3-氨丙基三乙氧基硅烷(APTES)作为功能单体,正硅酸乙酯(TEOS)作为交联剂,以铜离子(Cu2+)为模板离子,利用表面印迹法在室温下pH=6.5的水溶液中反应,于玻璃纸的表面合成印迹聚合物。玻璃纤维纸的表面经过活化、接氨基处理,接枝碲化镉量子点,成为具有荧光传感性能的基底,而接枝在其表面的离子印迹聚合物增强了体系的选择性,线性范围为0.032~3.20 mg/L,检出限为0.012 mg/L。将其应用于湖水及海水样品中加标Cu2+含量的检测,并与ICP-MS检测的结果进行了比较,结果表明,这种基于荧光传感的印迹纸芯片具有良好的分析性能。
关键词 纸芯片; 离子印迹聚合物; 铜离子; 碲化镉量子点
1 引 言
铜作为一种重金属元素,是一种生命有机体必需的微量元素,与人类健康密切相关[1,2]。但当体内铜含量过高时,会对肝脏等器官造成负担,新陈代谢发生紊乱,造成肝腹水、肝硬化等疾病。目前,在机械制造、建筑工业、医疗等领域中,铜材料的过度使用和不恰当处理导致其成为重金属污染物之一,控制和监测水体中Cu2+的含量已成为人们关注的热点问题。
人们已将离子印迹聚合物作为高选择性材料,分离水体样品中的Cu2+[3,4]。离子印迹技术是在分子印迹技术基础上发展起来的,对模板离子具有高选择性识别能力[5,6]。金属离子与配合物通过螯合作用结合,在交联剂、引发剂的作用下发生聚合,聚合后将金属离子洗脱,可得内部含有孔穴的印迹聚合物,该孔穴与模板离子的形状和大小相符,可与特定的金属离子结合[7]。微流控芯片(Microfluidic chip)又称为芯片实验室,将多种单元技术灵活组合并规模化集成在微小可控的平台上,实现了仪器设备的便携化、高效化、智能化[8,9]。纸芯片作为微流控芯片的分支,是当前研究的热点之一[10~12]。它利用纸张作为基底,代替了常见的玻璃、PDMS等加工材料,通过紫外光刻[13]、喷蜡打印[13,14]、等离子体处理[15]、丝网印刷[16]等加工技术,可在纸上加工出具有一定结构的亲/疏水微细通道网络及相关分析器件,构建微流控纸分析设备,与其它材料相比,纸芯片具有很多优势:轻薄、易变形,方便运输和储存;生物相容性好,可降解;自身多孔结构无需外力驱动运输样品;便于实现大规模生产等[17,18]。自 2007年Martinez等[19]首次提出微流控纸芯片概念后,微流控纸芯片分析技术得到了快速发展[19]。对一些发展中国家、偏远地区的临床医学检验有重大意义,在医学、生物学、化学领域有良好的应用前景。
本研究将碲化镉量子点(CdTe QDs)接枝在经处理的玻璃纤维纸表面,制得荧光响应基底。利用表面印迹技术在量子点表面合成以Cu2+为模板的印迹聚合物(Cu-IIP@ CdTe QDs),所得到的纸片能够选择性吸附溶液中的Cu2+,由于 Cu2+对碲化镉量子点的荧光有猝灭作用,因此可以通过荧光信号的变化对溶液中Cu2+的含量进行分析。研究结果表明,此印迹纸芯片可以准确、快速检测水体样品中的Cu2+。
2 实验部分
2.1 仪器与试剂
S-4800冷场发射扫描电镜(日本Hitachi公司);FluoroMax-4荧光光谱仪(Horiba Scientific公司);Milli-Q超纯水系统(美国 Millipore公司);PHS-3C数字酸度计。
NaBH4、CdCl2、N-羟基琥珀酰亚胺(NHS)和1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸(EDC)均购自阿拉丁公司;3-氨丙基三乙氧基硅烷(APTES, Sigma-Aldrich公司);其它试剂均为国产分析纯试剂,玻璃纤维滤纸购于山东德州蓝天环境监测用品厂。实验用水为二次蒸馏水。
2.2 合成水溶性碲化镉量子点
根据Xu等[20]报道的方法合成CdTe QDs。称取68.4 mg CdCl2溶于75 mL二次蒸馏水水中,加入药 63 μL巯基乙酸,用1 mol/L NaOH快速调节至pH 9.0~9.2,通氮气20 min。另取38.3 mg碲粉和40.0 mg NaBH4,加入1.5 mL乙醇和0.5 mL二次蒸馏水后密封,放置于40℃水浴中加热反应4 h。取1 mL淡紫色上层清液(NaHTe),迅速加入到之前制备的CdCl2溶液中,氮气保护下回流2 h,便得到黄绿色的CdTe QDs,其发射波长在545~560 nm之间。量子点溶液需避光保存,60天内荧光强度不会发生明显变化。
2.3 制作荧光传感的玻璃纸基底
将玻璃纤维纸裁剪成1.5 cm×1.5 cm,浸于0.2 mol/L HCl溶液中活化30 min。取出后浸于20 mL 50%(V/V)乙醇中,并加入200 μL APTES进行接氨基处理,培育2~4 h,取出并以去离子水洗去多余乙醇,纸片留存备用。
经巯基乙酸修饰的CdTe QDs需要经过EDC/NHS催化才能接枝在含有大量氨基的玻璃纤维纸上。EDC及NHS均以pH=5.2的MES缓冲溶液配制而成,取10 mL制备好的量子点溶液,加入6 mL 20 mg/mL EDC及6 mL 10 mg/mL NHS。将接氨基处理后的纸片浸泡到此溶液中,避光培育12 h以上,得到表面接枝量子点的纸片。
2.4 合成铜离子印迹聚合物(Cu-IIP)
取1 mL 100 mg/L CuCl2溶液于20 mL水中,加入APTES 40 μL,振荡20 min,进行预聚合。加入50 μL氨水和50 μL TEOS,继续振荡30 min。开始聚合后,将接有量子点的纸片浸入其中,选择80~100 r/min转速振荡4 h,得到接枝Cu-IIP的纸片,此过程体系需避光处理。另配制不加CuCl2的无模板对照组(NIP),其它条件不变,培育同样的荧光纸片。选择EDTA作为洗脱剂洗脱Cu2+。
2.5 吸附性能
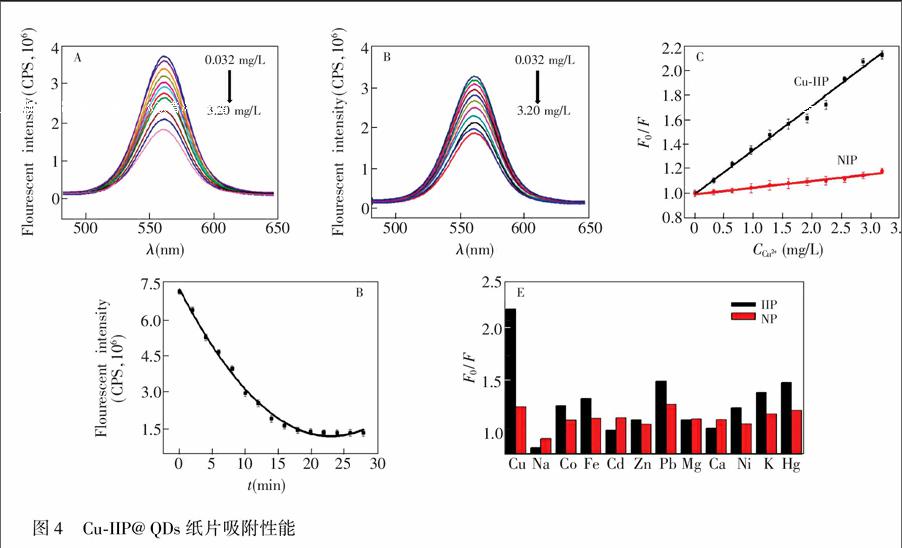
静态吸附实验:将Cu-IIP@QDs纸片浸泡于10 mL,pH=6.5的不同浓度Cu2+溶液中,浓度分别为0, 0.032, 0.32, 0.64, 0.96, 1.28和1.60 mg/L。室温条件下振荡培育纸片,15 min后将纸片取出,用荧光光谱仪检测荧光强度。将培育前后纸芯片荧光的变化F0/F作为参数,绘制标准曲线,考察纸芯片的性能。
动态吸附实验:称取10 mL 0.96 mg/L Cu2+溶液,室温条件下振荡培育Cu-IIP@QDs纸片0~28 min,测定不同时间的荧光强度,绘制动力学吸附曲线。3 结果与讨论
3.1 形貌表征
采用冷场发射扫描电镜(SEM)对纸片上量子点及Cu-IIP的形貌进行表征,由图1可见,未处理的玻璃纤维表面存在杂质且纤维之间空隙较大(图1A);接枝量子点后,量子点黏附在纸纤维表面,并悬挂在纤维之间(图1B);合成的Cu-IIP与量子点连接,黏附于玻璃纤维(图1C);量子点和Cu-IIP均匀分散在玻璃纤维上(图1D)。
3.2 纸芯片荧光猝灭机理
如图2A所示,Cu-IIP经过交联剂的作用可以与量子点连接,在量子点表面形成印迹层,Cu2+可以通过配合物中的化学键与CdTe QDs相互作用,其电荷与量子点表面发生电子转移,弥补量子点表面的电荷空穴,因而导致量子点荧光猝灭[21],而洗去Cu2+后,荧光可以恢复。图2B显示了量子点、未洗模板时的Cu-IIP@QDs纸芯片、洗去模板后的Cu-IIP@QDs纸芯片以及未加模板的NIP纸芯片的荧光强度对比。当Cu2+聚合物与量子点接枝后,对量子点的荧光猝灭效果十分明显(图2B中未洗模板),而洗脱Cu2+后荧光得到部分恢复(图2B中洗去模板),未加入模板的NIP对照组荧光较强,但仍然低于量子点溶液的荧光强度。
3.3 实验条件的优化
裸纸的预处理经过活化和接氨基两步。为暴露玻璃纤维表面的羟基,保证有足够的位点接枝量子点,需用HCl浸泡进行活化。将裸纸浸泡在0.05, 0.1, 0.2和0.3 mol/L HCl溶液中30 min,得到的荧光强度如图3A所示,选择0.2 mol/L HCl作为活化溶液。接氨基时,每片1.5 cm×1.5 cm大小的纸片使用200 μL APTES即可得到足够强的荧光(图3B)。考察pH值对Cu-IIP@QDs纸芯片的影响时,将Na2HPO4-NaH2PO4作为缓冲体系,由于过酸或过碱的条件都会对量子点的荧光强度有影响,因此选择在5.25~8.35范围内调节pH值(图3C)。在pH=6.5时,荧光强度变化最大,印迹聚合物对Cu2+的结合效果最好。由于采用表面印迹法进行聚合,使用EDTA可以在很短时间内将Cu2+洗脱下来,而当EDTA浓度过高时,会猝灭量子点的荧光(图3D)。因此, 选择使用0.1 mmol/L EDTA快速漂洗的方法进行模板洗脱。最后用水漂洗,除去多余的EDTA。
3.4 Cu-IIP@QDs纸芯片吸附性能
静态吸附实验考察了Cu-IIP@QDs纸芯片的检出限和线性范围。Cu-IIP@ QDs纸芯片检测Cu2+浓度范围为0.032~3.20 mg/L的荧光强度(图4A),吸附15 min。与NIP(图4B)相比,在同样的浓度范围内,强度降低较为明显,荧光猝灭效果显著;纸芯片初始荧光强度F0与培育后荧光强度F的比值随着Cu2+浓度的增加而增大(图4C),Cu-IIP标准曲线的斜率较大, 而NIP标准曲线的斜率较小,且Cu-II标准曲线的线性系数为0.9953,最低检测浓度可以达到0.012 mg/L,5次重复测定的相对标准偏差(RSD)为4.9%。实验证明了Cu-IIP@QDs纸芯片对Cu2+有较为灵敏的响应能力。动态吸附实验表明,Cu-IIP@QDs纸芯片吸附在15 min后达到平衡,因此本实验中考察其它性能时的吸附时间为15 min。
3.5 选择性和稳定性
选择浓度均为20 μmol/L的Na+, K+, Ca2+, Mg2+, Zn2+, Ni2+, Co2+, Cd2+, Hg2+, Pb2+, Fe3+和Cu2+,对Cu-IIP@QDs纸芯片的选择能力进行考察,吸附时间均为15 min。如图4E所示,在考察的11种离子中,只有Cu2+能显著降低荧光强度,除Cu2+外,只有Pb2+和Hg2+能使纸芯片的荧光稍有猝灭。另外,纸片的稳定性也是影响实际应用的重要指标之一。选择了同一张纸芯片的20个位点进行检测。结果表明,荧光强度差异小于15%。纸芯片需在低温(4℃)避光环境下保存,检测前使其湿润,此荧光传感纸片的有效时间可达到30天。
3.6 实际样品中Cu2+含量的检测
取自然环境中的水样对铜离子印迹纸芯片的实际应用能力进行检测。水样取自烟台大学三元湖湖水及烟台市莱山区附近海水,进行4个浓度水平加标实验,浓度分别为2, 15, 30和50 μmol/L,为对比方便,换算为mg/L。将样品过滤并以Na2HPO4-NaH2PO4缓冲溶液调节pH至6.5~7.5,吸附时间为15 min。对湖水、海水加标样品检测的回收率和RSD如表1所示,印迹纸芯片的检测结果与ICP-MS的检测结果一致。
4 结 论
本研究制作了荧光纸基芯片,并利用表面印迹技术,将APTES作为功能单体, TEOS作为交联剂,在玻璃纤维纸的表面合成了铜离子印迹聚合物层,通过Cu2+与碲化镉量子点之间的电子转移作用导致荧光猝灭,从而定量分析水体样品中Cu2+。这种Cu-IIP@QDs纸片制作方法简单、成本较低、便于携带并且具有较高的选择性和灵敏度,在现场即时检测方面具有良好的应用前景。
References
1 LI Zi-Fan, MEI Ling, XIANG Yu, TONG Ai-Jun. Chinese J. Anal. Chem., 2008, 36(7): 915-919
李紫凡, 梅 岭, 向 宇, 童爱军. 分析化学, 2008, 36(7): 915-919
2 Jung H S, Kwon P S, Lee J W, Kim J I, Hong C S, Kim J W, Yan S H, Lee J Y, Lee J H, Joo T, Kim J S. J. Am. Chem. Soc., 2009, 131(5): 2008-2012
3 Wang Z Q, Wu G H, Wang M, He C Y. J. Mater. Sci., 2009, 44(10): 2694-2699
4 Tobiasz A, Walas S, Trzewik B, Grzybek P, Zaitz M M, Gawin M, Mrowiec H. Microchem. J., 2009, 93(1): 87-92
5 HOU Lin-Xi, GUO Zhi-Yong, WANG Sui. Spectroscopy and Spectral Analysis, 2008, 28(10): 2446-2449
侯琳熙, 郭智勇, 王 邃. 光谱学与光谱分析, 2008, 28(10): 2446-2449
6 LI Su-Ping, GUAN Huai-Min, XU Guo-Bao, TONG Yue-Jin. Chinese J. Anal. Chem., 2015, 43(2): 294-299
李素萍, 关怀民, 徐国宝, 童跃进. 分析化学, 2015, 43(2): 294-299
7 Segatelli M G, Santos V S, Presotto A B T, Yoshida I V P, Tarley C R T. React.Funct.Polym., 2010, 70(6): 325-333
8 CHEN Xing, YANG Zhao-Xia, ZHANG Zhao-Hui, RAO Wei, LIU Yu-Nan, CHEN Hong-Jun, HU Xiao-Yun, CAI Ron, NIE Li-Hua. Chinese J. Anal. Chem., 2013, 41(9): 1406-1412
陈 星, 杨朝霞, 张朝晖, 饶 维, 刘玉楠, 陈红军, 胡晓云, 蔡 蓉, 聂利华. 分析化学, 2013, 41(9): 1406-1412
9 Lee H, Sun E, Ham D, Weissleder R. Nat. Med., 2008, 14(8): 869-874
10 Li B W, Jiang L, Xie H, Gao Y, Qin J H, Lin B C. Electrophoresis, 2009, 30(17): 3053-3057
11 YAN Wei, ZHANG Qiong, CHEN Bin, LIANG Guang-Tie, LI Wei-Xuan, ZHOU Xiao-Mian, LIU Da-Yu. Chinese J. Anal. Chem., 2013, 41(6): 822-827
严 伟, 张 琼, 陈 斌, 梁广铁, 李伟萱, 周小棉, 刘大渔. 分析化学, 2013, 41(6): 822-827
12 He Q H, Ma C C, Hu X Q, Chen H W. Anal. Chem., 2013, 85(3): 1327-1331
13 Li B W, Zhang W, Chen L X, Lin B C. Electrophoresis, 2013, 34(15): 2162-2168
14 Li B W, Fu L W, Zhang W, Feng W W, Chen L X. Electrophoresis, 2014, 35(8): 1152-1159
15 Zhang W, Li B W, Chen L X, Wang Y Q, Gao D X, Ma X H, Wu A G. Anal. Methods-UK., 2014, 6(7): 2066-2071
16 Li X, Tian J F, Nguyen T, Shen W. Anal.Chem., 2008, 80(23): 9131-9134
17 Wang P P, Ge L, Yan M, Song X R, Ge S G, Yu J H. Biosens. Bioelectron., 2012, 32(1): 238-243
18 Hu J, Wang S Q, Wang L, Li F, Pingguan-Murphy B, Lu T J, Xu F. Biosens. Bioelectron., 2014, 54 : 585-597
19 Martinez A W, Phillips S T, Butte M J, Whitesides G M. Angew. Chem. Int. Edit., 2007, 46(8): 1318-1320
20 Xu S F, Lu H Z, Li J H, Song X L, Wang A X, Chen L X, Han S B. ACS Appl. Mater. Inter., 2013, 5(16): 8146-8154
21 Noipa T, Tuntulani T, Ngeontae W. Talanta, 2013, 105: 320-326
