微流控芯片在心肌标志物检测中的研究进展
2015-11-03苏文涛冯可秦建华
苏文涛 冯可 秦建华

摘 要 心肌损伤标志物是急性心肌梗死、慢性心力衰竭和动脉粥样硬化等心血管疾病的重要检测指标之一。对心肌标志物的监测可直接影响心血管疾病患者的临床诊断、治疗方案选择和预后判断。微流控芯片以其微型化、高通量、集成化及低消耗等特点,为心肌标志物快速检测提供了一种潜在平台。本文主要介绍了微流控芯片技术在心肌标志物检测方面的研究进展,并对其发展前景予以展望。
关键词 微流控芯片; 免疫分析; 心肌标志物; 检测方式; 即时诊断; 综述
1 引 言
急性心肌梗死(Acute myocardial infarction, AMI)、慢性心力衰竭和动脉粥样硬化等心血管疾病是严重危害人类健康的常见疾病。实现快速的早期诊断和有效治疗干预,对挽救心血管疾病患者的生命具有重要意义。随着临床检验技术的进展,心肌损伤的血液生化标志物,从以检测酶活力为主的肌酸激酶等酶学检验,发展到以检测蛋白质为主的多种心肌损伤标志物,诊断价值逐渐提高。目前,这些具有高度特异性和敏感性的心肌损伤标志物检测指标普遍应用于临床实验室诊断,为心血管疾病的临床准确诊断、鉴别诊断和判断治疗效果提供重要依据。
现阶段,针对心肌损伤标志物分析检测的主要方式是基于抗原抗体的免疫反应,其优势在于免疫分析具有较高的选择性和灵敏度,但常规方法也存在着检测时间周期长等局限。研究显示,AMI 发病3 h是挽救濒死心肌梗死病人的“黄金”时间,若发病6 h 后才得到救治, 死亡率将增加10%~12%[1]。至今,检测方法的局限性、基层医院的现状、糖尿病并发症以及患者的自我防护意识欠缺等因素是我国心血管疾病患者发病率居高不下的重要原因。因此,迫切需求发展建立适于快速、简便的高敏感性心肌损伤标志物的方法,为快速早期诊断和心肌梗塞等心血管疾病有效预防提供重要手段。
微流控芯片是近年发展起来的一种新兴技术,具有微尺度液体流动可控、低试剂消耗、分析速度快、多功能集成和高通量等独特优势,已经在生命科学的多个领域显示出应用前景,包括快速生物分析[2~6],生化检验[7,8],病原体检测[9]等。本文着重介绍近年来微流控芯片在心肌损伤标志物检测方面的应用进展,以期为重大疾病监测和快速医学检验提供一种重要潜在平台。
2 心肌标志物概述
心肌损伤标志物主要有心肌肌钙蛋白T(Troponin T, cTnT)、心肌肌钙蛋白I(Troponin I, cTnI)、肌红蛋白(Myoglobin, Myo)、肌酸激酶同工酶(Creatine kinase isoenzyme,CK-MB)、B 型尿钠肽(B-type natriuretic peptide, BNP)和超敏 C 反应蛋白(C-reactive protein, CRP)等。对于隐匿性的心血管疾病,血清中有关标志物的动态变化则具有特殊价值。心肌损伤的早期标志物主要有CRP、Myo和BNP, 在心肌损伤的早期即可出现异常增高。CRP是肝脏合成的一种急性时相反应蛋白,其异常增高反应动脉本身内在性炎症和组织损伤与AMI梗死面积的大小有关[10]。Myo在心肌细胞质含量丰富, AMI发作1~2 h后,心肌受到受损,Myo能够更加迅速地释放到血液循环中,其浓度在6~9 h后达到峰值,是AMI诊断的早期最灵敏的指标[11]。BNP是由心肌细胞合成的具有生物学活性的天然激素,主要在心室表达,当心肌细胞受到刺激,BNP快速合成并释放入血液中,在心力衰竭的早期诊断、监测病程进展等方面有重要的临床意义。
虽然CRP, Myo和BNP在心肌细胞损伤早期有较高的灵敏度,但三者在辅助心血管疾病诊断时缺乏特异性。CRP是血管炎症的标志物,在炎症、创伤和肿瘤浸润时其血清浓度都会显著升高。Myo同样存在于骨骼肌中,骨骼肌损伤、创伤、肾功能衰竭等疾病, 都可导致其升高。升高的血浆BNP浓度也并不一定由心力衰竭引起,某些心脏病、肾功能衰竭、肝硬化等也可使血浆BNP浓度升高。所以CRP、Myo和BNP对冠状动脉综合征、心力衰竭及AMI具有较重要的危险性预测和辅助诊断价值,但不具有确诊价值,还需要结合特异性高的心肌损伤标志物监测,如心肌酶谱中的CK-MB和心肌肌钙蛋白cTn。CK-MB主要存在于心肌中, 对判断心肌损伤具有高度特异性。正常人血清中CK-MB含量极少(低于总活性5%), 当心肌受损时释放入血。AMI发病后3~8 h, CK-MB即开始升高, 在发病12~24 h达到峰值。在无AMI并发症情况下,CK-MB浓度3 d后恢复至正常,而在有AMI梗死的情况下, CK-MB浓度则一直保持高浓度值。CK-MB的检测,对判定AMI梗死发生的时间、面积、部位、梗死的扩展及有无心肌灌注均具有一定的价值[10]。心肌肌钙蛋白是存在于心肌内的蛋白质, 根据结构和功能不同可划分为3种亚型,即cTnT, cTnC和cTnI。其中 cTnT和cTnI只存在心肌组织中, 故在临床广泛用于检测心肌损伤。由于cTnI对心肌损伤的特异性极高, 且仅存在于心肌收缩蛋白的细肌丝上, 是心肌损伤的特异标志物, 一旦检测到cTnI, 即表明病人已出现不可逆的心肌损害,不会因骨骼肌或其它组织的损害而出现假阳性[9]。总体而言,联合检测心肌酶谱、Myo,cTnI及CRP对诊断心血管疾病、疗效观察及预后判断等将具有重要的临床价值, 能为临床医师及时抢救和诊治病人提供快捷有效的依据。
3 微流控芯片心肌标志物检测原理
目前,利用微流控芯片进行心肌标志物检测大多依赖芯片上的免疫分析原理,即将微流控芯片与常规的免疫分析方法相结合,通过芯片微尺度通道的流体控制和抗原抗体反应来完成快速的免疫反应。以芯片为载体的免疫分析具有试剂耗量少、分析时间短、易于集成、自动化等特点。目前,微流控免疫分析芯片材料主要以单晶硅片、玻璃、石英和有机聚合物材料及纸基材料等为主。根据作用介质的均一性,芯片免疫分析包括两种基本类型,均相免疫分析和非均相免疫分析。
3.1 均相微流控免疫分析
均相微流控免疫是指免疫试剂和底物在微流控系统同一液相介质中进行的抗原-抗体复合物形成、实时分离检测的分析方法。该方法集成了微流控芯片多路流体控制与芯片快速电泳分离特点,可实现对抗原-抗体复合物的同步化快速分离及检测。Koutny 等[13]建立了血清中可的松的免疫测定方法, 利用电动力驱动液流,实现芯片外抗原-抗体复合物与游离的抗原、抗体的分离, 因此仅为部分意义上的微流控芯片免疫分析。Wang等[14]在玻璃芯片上先进行抗原、酶标记抗体混合反应, 然后经电泳分离后,在分离通道下游电化学检测鼠免疫球蛋白。均相微流控免疫分析节省了抗体固定和洗涤等步骤,且液流操作方便,有利于实现多种心肌标志物的并行检测和集成分析。
3.2 非均相微流控免疫分析
与均相微流控免疫分析相比, 非均相微流控免疫则是将抗原(或抗体)固定在微流控芯片固相载体表面,经过特异性免疫反应, 目标抗体(或抗原)结合在固相载体表面即形成抗原-抗体复合物。由于在不同介质中形成抗原-抗体复合物,一般通过常规清洗可完成抗原-抗体复合物与游离抗原抗体的分离。非均相微流控免疫方法可以用于心肌标志物的分析检测,其中用于抗原(或抗体)固定的固相载体种类较多,包括芯片通道表面[15~17]、微珠[18~20]、电极表面[21,22]及多聚物薄膜材料[23,24]等。本研究组以具有蛋白吸附功能的聚二甲基硅氧烷、纸基材料及玻璃通道表面为固定载体进行酶联免疫分析,建立了一系列基于多通道的人免疫球蛋白G酶联免疫吸附反应检测体系[8,25,26]。相对于均相微流控免疫分析,非均相微流控免疫分析速度更快,抗体消耗量更少,也更有利于实现阵列式、集成化的心肌标志物检测。但是由于该方式包含第二抗体的反应步骤和多步洗涤过程, 增加了微流控芯片的操作流程,对实际操作提出了较高要求。
4 微流控芯片心肌标志物检测方法
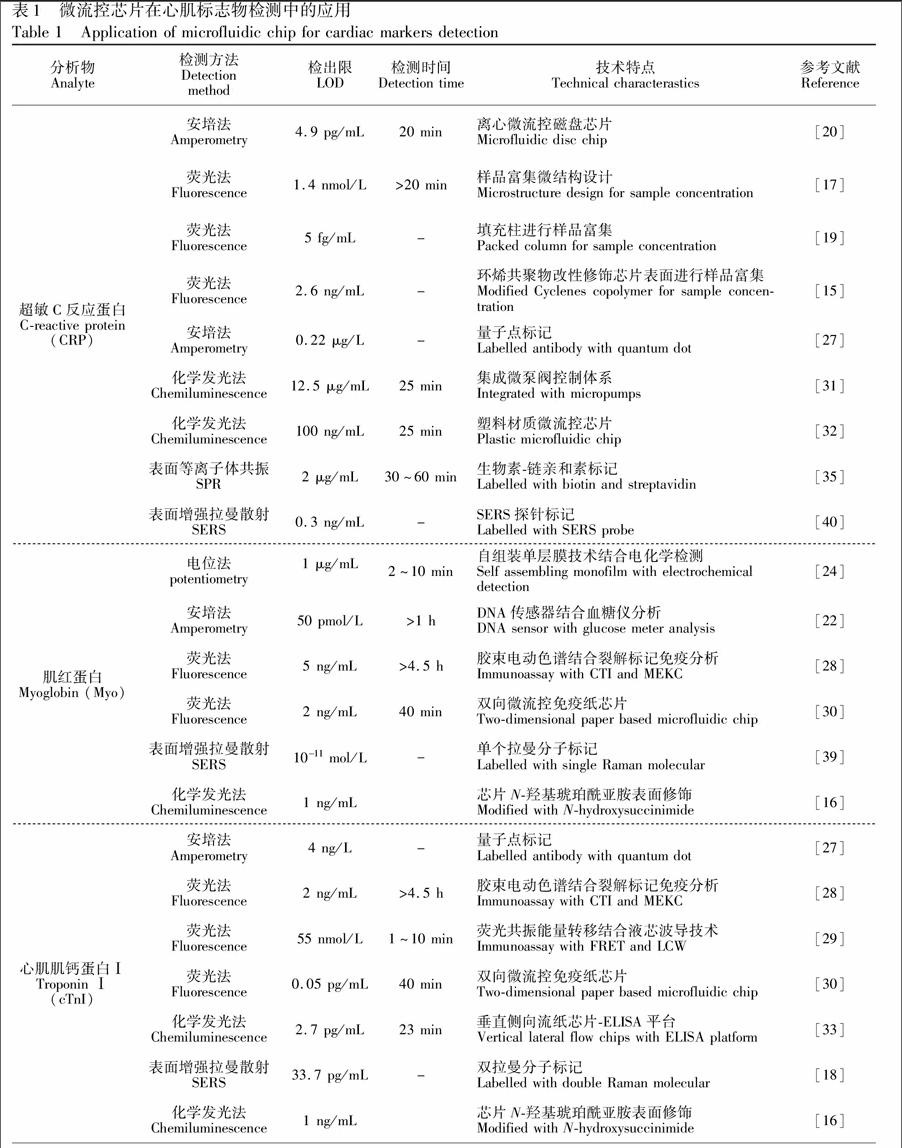
以微流控芯片为平台的心肌标志物免疫分析通常发生在微米尺寸的微结构中,因此对检测方法的要求比传统免疫检验更为严格。与之相匹配, 需要发展灵敏度高、响应速度快、微型化和集成化的检测方法。电化学检测法和光学检测法是目前最常用的检测方式(表1)。
4.1 电化学检测
电化学检测是通过电极将反应液中与待测物含量相关的化学信号转化为电信号,从而实现对待测物组分检测的一种分析方法。电化学检测的主要优势是灵敏度高、选择性好、装置简单且体积小。随着微电极加工技术的发展,研究者经常采用一些特殊技术结合电化学检测方法来达到痕量检测。Wang 等[24]利用自组装单层膜技术结合电化学检测方法,通过检测电势变化而测定样本中的 Myo 和血红蛋白。Zhou等[27]利用量子点标记抗体结合方波溶出伏安法(Sequare wave stripping voltammetry,SWASV)同时检测了两种心肌标志物 cTnI和 CRP。当 cTnI和 CRP 分别在 0.01~50 μg/L 和 0.5~200 μg/L 范围内时,检测电流与检测物浓度具有较好的线性一致性。Abad等[21]加工了具有多个电极的环丙烯聚合物微流控芯片,可同时独立检测6个样本,检出限分别达 0.017 ng/mL,灵敏度大大超过传统手段。电化学检测技术与微流控芯片相结合,将进一步减少待测样本消耗量,缩短分析时间,增加反应灵敏度,易于发展成为潜在的心肌标志物即时诊断平台。
此外,为克服心肌标志物检测需要辅助昂贵检测设备的限制,近年来,研究者开发了一些轻便、成本低、实用性广,并可定量的检测装置。Wang等[22]将能识别Myo抗原的DNA适配体片段与能催化并将蔗糖转化成葡萄糖的转化酶结合,形成功能化的DNA传感器。使用者可以用血糖仪量化血液样本中Myo的含量,检出限达 50 pmol/L。转盘式离心微流控技术是另一种新型免疫分析方式。Kim 等[20]以聚碳酸酯为芯片材料,制成仅靠离心力驱动样本的微流控磁盘,将 CRP 抗体修饰的聚苯乙烯微球预封闭在磁盘的一个微池内,通过离心捕获样本中抗原,利用安培法检测 CRP浓度,检出限达 4.9 pg/mL(图 1)。这些低成本技术的引入将有利于进一步降低检测成本,尤其对偏远地区医疗资源相对缺乏的诊断需求更有意义。
4.2 光学检测
光学法是用于心肌标志物的主要检测方式之一,也是目前微流控芯片研究中应用最广泛的检测方式。根据检测原理的不同,光学检测可分为荧光检测法、紫外-可见吸收光谱检测法、化学发光和生物发光检测法、表面增强拉曼散射检测法、光纤检测法及表面等离子体共振检测法等。
4.2.1 荧光(Fluorescence)法 对于心肌标志物的检测,生物学家通常利用荧光物质标记抗原或抗体或酶标抗体,然后从反应生成物的荧光强度、反应底物比色和捕获化学发光底物微光来定量被检测物的浓度。由于微流控芯片微米级尺度的检测通道,荧光免疫方法有时难以满足对低浓度心肌标志物的检测要求。为了提高微流控光学检测的灵敏度,目前研究主要通过对样品预先处理或者预浓缩方式来实现。利用微流控芯片微米级的检测通道,Shin等[17]创新性地设计了可浓缩荧光标记物的反应池和嵌入式光电倍增管检测装置,用于实现对超敏C反应蛋白(CRP)的低浓度检测(~1.4 nmol/L)。Christodoulides 等[19]将共价键合抗体的琼脂凝胶微珠引入微流控芯片中,结合微球免疫分析,增大抗原抗体的结合面积,检出限达 5 fg/mL,检测灵敏度优于商品化超敏 CRP ELISA 检测试剂盒。Jnsson 等[15]则对芯片表面进行环烯共聚物改性,分别用氧等离子体氧化、APTES硅烷化和右旋糖酐修饰,增加其表面亲水性,结合免疫检测方法,实现血液中 CRP 的低浓度检测,检出限达 2.6 ng/mL。
不同的心肌标志物通常需要进行多种荧光标记,利用微流控芯片高通量分析特点,可以实现多种心肌标记物的同时检测。这种方式将进一步节省试剂成本、缩短反应时间,是未来实现快速生化检验的主要趋势。Caulim 等[28]根据荧光标记在芯片胶束电动色谱中有不同的迁移率,对CK-MB, cTnT, cTnI和Myo 4种心肌标志物进行了定量分析。Stringer 等[29]结合荧光共振能量转移和液芯波导技术,实现了 cTnI 的高灵敏度快速检测。但这些方法的检测装置较复杂,能实现微流控芯片的高通量分析,但不利于开发适合即时诊断的产品。Cho等[30]设计了一种由免疫层析试纸条和微型荧光检测装置组成的微流控免疫纸芯片检测装置,同时分析AMI 的3种心肌标志物CK-MB、cTnI 和 Myo。他们首先以同一荧光染料Alexa Fluor 647对以上3种心肌标志物抗体进行标记,使反应后抗原-荧光抗体复合物在硝酸纤维素膜中层析分离,进而被不同的心肌标志物二抗捕获,通过定量不同荧光标签量来定量各组分标志物浓度。为了避免荧光背景色干扰,作者在微流控免疫纸芯片检测装置中引入两向驱动设计,分别驱动样品的层析分离和荧光背景色的洗脱。利用该平台对CK-MB,cTnI 和 Myo的检出限分别为0.2 ng/mL, 0.05 pg/mL和2 ng/mL(图 2)。这种基于微流控免疫芯片的多种心肌标志物联合检测方式有利于AMI的早期诊断,特别是在家庭医疗中具有潜在应用价值。
4.2.2 化学发光(Chemiluminescence) 化学发光是指在某些特殊的化学反应中,反应的中间体或产物由于吸收了反应释放的化学能而处于电子激发态,当其回到基态时伴随产生的光辐射现象。与传统荧光检测方法相比,由于化学发光无需外来光源,降低了对设备的要求,易于微型化和集成化,符合微流控芯片的发展趋势。微流控化学发光免疫分析将具有高灵敏度的化学发光测定技术与高特异性的免疫反应相结合,通过检测发光强度来确定痕量心肌标志物的含量。Yang 等[31]设计制备了一种包含有液体通道层、气动层和预留空气层的三层 PDMS 芯片,芯片上整合有微泵、微阀和微混合器。基于化学发光原理测定血样中CRP 时,最低检出限为 0.0125 mg/mL,检测时间为 25 min,与医院现有方法相比,检测灵敏度和时间都得到很大改善。Bhattacharyya 等[32]通过热压法制作含八通道的塑料微流控芯片,利用辣根过氧化物酶标记二抗,鲁米诺为化学发光底物,在同一块芯片同时进行标准曲线和 CRP 样本的检测,检测时间仅为 25 min。Cho 等[33]在多层纸基芯片上进行酶联免疫分析(ELISA)用以检测cTnI,检出限达 0.027 ng/mL。该方法通过改变样本引入方向,实现抗原抗体垂直侧向流扩散,酶底物水平侧向流扩散,节省了反应时间。
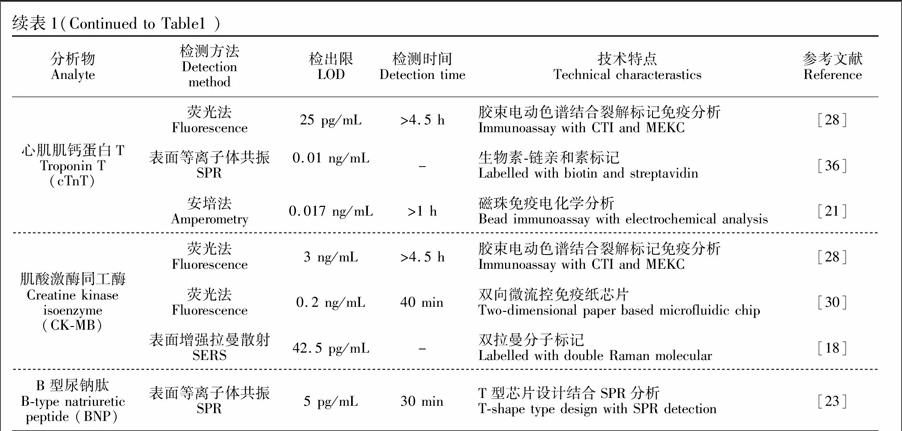
4.2.3 表面等离子体共振( Surface plasmon resonance, SPR) 表面等离子体共振( SPR) 检测是通过监测生物反应过程中SPR 的动态变化,获取生物分子相互作用的特异信号。该方法具有无需标记、可实时快速检测等特点,非常适合与微流控芯片结合,进行生物样本的分析检测。目前,基于SPR 的微流控免疫芯片已经尝试用于多种癌症标记蛋白、病毒抗体蛋白、药物性抗体、药物蛋白以及分子生物标记物的检测[34]。ELISA是医院常规用于人体炎症蛋白CRP的主要检测方法,但其容易受到基质及组成颜色的影响。Meyer等[35]研究建立了一种基于SPR免疫传感器的CRP检测方法, 采用生物素-链霉亲和素的夹心法装置, 对于样品颜色、来源及基质无限制。在Dutra等[36]的研究中,cTnT的单克隆抗体用生物素标记后通过半胱氨酸偶联固定到硫脲自组装单层膜上,SPR传感器检测在0.05~4.5 ng/mL范围内显示出良好的线性相关性和重复性。
在SPR分析过程中,一般将抗原或抗体键合在晶片表面的葡萄糖上,在检测过程中,除抗体与抗原专一性结合外,还有部分蛋白质会吸附在葡萄糖上,造成非特异性信号过高。为降低非特异性结合的信号,Masson等[16,37]利用含N-羟基琥珀酰亚胺的16-巯基十六烷酸固化抗体,在含有血清的液体中,对Myo和cTnI进行检测,实验结果显著抑制非特异性结合的信号,Myo和cTnI的检出限达到1 ng/mL。Kurita 等[23] 则设计通道T型管道结构用以防止待测溶液流过金膜表面,降低非特异性结合的信号。作者通过在通道固定B型促尿钠排泄肽(BNP) 抗原,捕获免疫反应后混合物中过量的游离酶标抗体,而酶标抗体-抗原复合物则直接流过。被捕获的酶标抗体上的酶催化流经的底物反应,生成的带巯基的产物共价结合于通道内的金膜表面,利用表面等离子体共振技术检测,如图3所示, 分析时间为30 min , 检测范围为0.005~100 ng/mL, 覆盖了血液样品中BNP 的浓度范围。这种T型结构的芯片设计能够实现同时对酶催化反应和产物积聚的实时监测,可满足对实际生物样品(如人血清)的检测。
4.2.4 表面增强拉曼散射( Surface-enhanced raman scattering,SERS) 表面拉曼散射主要利用系统中分子振动、转动及低频振荡所提供的“化学指纹”鉴定特定的分析物。该方法具有极高检测灵敏度和选择性,对蛋白质、核酸或其它生物色素的测定低达ng至pg水平的痕量分析[38]。目前,基于SERS的微流控免疫芯片用于心肌相关标志物检测的文献较少,仅有的几项报道研究已经显示出该项技术可用于医学检验的应用潜力。Bizzarri等[39]以单个拉曼分子修饰的纳米银为SERS探针,设计了SERS 检测平台,实现了Myo分子的极微量检测,检出限达1011 mol/L。Campbell等[40]的工作则使用了SERS 探针实现CRP的微量检测,检出限达到0.3 ng/mL,远超出医院常规规定的μg/mL级别的检测能力。
对不同的标志物进行不同的拉曼分子标记,实现多种心肌标志物的联合检测是SERS未来发展的趋势。Chon等[18]设计了一种分支结构的微流控通道,可将分析物在多个通道内逐次稀释,此法可减少样品制备的时间,采用夹心型免疫分析法同时定量检测了cTnI和CK-MB。他们首先将作为拉曼信号分子的孔雀石绿与cTnI抗原结合,拉曼信号分子罗丹明同分异构体(Rhodamine isothiocyanate, XRITC)与CK-MB抗原结合并连接到中空的金纳米球表面; 其次,在磁珠表面连接上cTnI和CK-MB单克隆抗体,当两者分别与抗原结合时即形成夹心结构。收集通道内的磁珠,最后用缓冲液洗去未连接的抗原,磁珠和纳米球即可进行SERS 检测。以孔雀石绿分子在1616 cm1处和XRITC在1650 cm1的相对拉曼强度进行计算,可发现当cTnI和CK-MB浓度在10 pg/mL~1 μg/mL时,该峰强与浓度有良好的线性关系,cTnI和CK-MB检出限分别为33.7和 42.5 pg/mL(图3)。微流控技术与SERS相结合,可快速、高灵敏地同时检测血清中多个心肌标记物的信号,将进一步发挥其临床应用潜力。
5 总结与展望
微流控芯片是近几年发展起来的一种前沿分析技术,它具有分析时间短、样品耗量少、分析通量高和易于集成等特点,已经在心肌损伤标志物检测和与临床相关的多种生化指标监测等方面显示出很大优势,在心血管疾病早期预警和重要标志物的快速筛查等方面具有应用潜力。近年来,随着微纳制造工艺、新材料和多种信息检测等技术的快速发展,微流控芯片设计和集成装置性能将会获得进一步提升,主要表现在:(1) 提高集成微流控芯片的精确分析能力,融合精密制造和自动控制等多种新技术元素,发展具有可与医院大型检测设备相媲美的精确分析定量能力。(2)将移动互联网与微流控芯片技术相结合,开发新型现场床边检测(Point-of-care testing,POCT)装置,并与可视化远程监测系统相融合。微流控芯片系统的微型化、集成化和自动化是实现快速生化检验和重大疾病标志物筛查的重要平台,也是发展低成本健康关键技术的主要途径,预期在未来个性化医疗、疾病早期预警以及社区健康医疗等方面发挥越来越重要的作用。
References
1 McCord J, Nowak R M, McCullough P A, Foreback C, Borzak S, Tokarski G, Tomlanovich M C, Jacobsen G, Weaver W D. Circulation, 2001, 104(13): 1483-1488
2 Wen H, Gao X, Qin J. Integr. Biol., 2014, 6(1): 35-43
3 WEN Xiao-Xia, XU Bang-Lao, WANG Wei-Xin, LIANG Guang-Tie, CHEN Bin, YANG Yin-Mei, LIU Da-Yu. Chinese J. Anal. Chem., 2014, 42(6): 791-798
文小霞, 徐邦牢, 王伟鑫, 梁广铁, 陈 斌, 杨银梅, 刘大渔. 分析化学, 2014, 42(6): 791-798
4 Wen H, Yu Y, Zhu G, Jiang L, Qin J. Lab Chip, 2015, 15(8): 1905-1911
5 LIU Qing, ZHUANG Gui-Sheng, JIA Chun-Ping, JIN Qing-Hui, WANG Hui-Min, ZHAO Jian-Long, YANG Meng-Su. Chem. J. Chinese Universities, 2006,27 (7): 1223-1226
刘 菁, 庄贵生, 贾春平, 金庆辉, 王惠民, 赵建龙, 杨梦苏. 高等学校化学学报, 2006, 27 (7): 1223-1226
6 Zhang M, Li H, Ma H, Qin J. Wound Repair Regen., 2013, 21(6): 897-903
7 Kong J, Jiang L, Su X, Qin J, Du Y, Lin B. Lab Chip, 2009, 9(11): 1541-1547
8 Lu Y, Shi W, Qin J, Lin B. Electrophoresis, 2009, 30(4): 579-582
9 Su W, Gao X, Jiang L, Qin J. J Chromatogr. A, 2015, 1377: 13-26
10 LI Yan, ZHANG Ping-An. Chinese J. Clin. Lab. Sci., 2000, 18(3): 188-189
李 艳, 张平安. 临床检验杂志, 2000, 18(3): 188-189
11 PAN Bo-Shen. Chinese J. Clin. Lab. Sci., 2002, 20(3): 129-132
潘柏申. 临床检验杂志, 2002, 20(3): 129-132
12 Jeremias A, Baim D S, Ho K K, Chauhan M, Carrozza J P, Cohen D J, Popma J J, Kuntz R E, Cutlip D E. J. Am. Coll. Cardiol., 2004, 44(6): 1210-1214
13 Koutny L B, Schmalzing D, Taylor T A, Fuchs M. Anal. Chem., 1996, 68(1): 18-22
14 Wang J, Ibez A, Chatrathi M P, Escarpa A. Anal. Chem., 2001, 73(21): 5323-5327
15 Jnsson C, Aronsson M, Rundstrm G, Pettersson C, Mendel-Hartvig I, Bakker J, Martinsson E, Liedberg B, MacCraith B, hman O. Lab Chip, 2008, 8(7): 1191-1197
16 Masson J F, Battaglia T M, Khairallah P, Beaudoin S, Booksh K S. Anal. Chem., 2007, 79(2): 612-619
17 Shin K S, Lee S W, Han K C, Kim S K, Yang E K, Park J H, Ju B K, Kang J Y, Kim T S. Biosens. Bioelectron., 2007, 22(9): 2261-2267
18 Chon H, Lee S, Yoon S, Lee E, Chang S, Choo J. Chem. Commun., 2014, 50(9): 1058-1062
19 Christodoulides N, Mohanty S, Miller C S, Langub M C, Floriano P N, Dharshan P, Ali M F, Bernard B, Romanovicz D, Anslyn E. Lab Chip, 2005, 5(3): 261-269
20 Kim T H, Abi-Samra K, Sunkara V, Park D K, Amasia M, Kim N, Kim J, Kim H, Madou M, Cho Y K. Lab Chip, 2013, 13(18): 3747-3754
21 Abad L, Javier del Campo F, Muoz F X, Fernndez L J, Calavia D, Colom G, Salvador J P, Marco M P, Escamilla-Gómez V, Esteban-Fernndez de vila B. Electrophoresis, 2012, 33(21): 3187-3194
22 Wang Q, Liu F, Yang X, Wang K, Wang H, Deng X. Biosens. Bioelectron., 2015, 64: 161-164
23 Kurita R, Yokota Y, Sato Y, Mizutani F, Niwa O. Anal. Chem., 2006, 78(15): 5525-5531
24 Wang Y, Zhou Y, Sokolov J, Rigas B, Levon K, Rafailovich M. Biosens. Bioelectron., 2008, 24(1): 162-166
25 Gao X, Jiang L, Su X, Qin J, Lin B. Electrophoresis, 2009, 30(14): 2481-2487
26 Lu Y, Shi W, Qin J, Lin B. Anal. Chem., 2009, 82(1): 329-335
27 Zhou F, Lu M, Wang W, Bian Z P, Zhang J R, Zhu J J. Clin. Chem., 2010, 56(11): 1701-1707
28 Caulum M M, Murphy B M, Ramsay L M, Henry C S. Anal. Chem., 2007, 79(14): 5249-5256
29 Stringer R C, Hoehn D, Grant S A. IEEE Sens J, 2008, 8(3): 295-300
30 Cho J H, Kim M H, Mok R S, Jeon J W, Lim G S, Chai C Y, Paek S H. J. Chromatogr. B, 2014, 967: 139-146
31 Yang Y N, Lin H I, Wang J H, Shiesh S C, Lee G B. Biosens. Bioelectron., 2009, 24(10): 3091-3096
32 Bhattacharyya A, Klapperich C. Biomed. Microdevices, 2007, 9(2): 245-251
33 Cho I H, Paek E H, Kim Y K, Kim J H, Paek S H. Anal. Chim. Acta, 2009, 632(2): 247-255
34 Homola J. Chem. Rev., 2008, 108(2): 462-493
35 Meyer M H, Hartmann M, Keusgen M. Biosens. Bioelectron., 2006, 21(10): 1987-1990
36 Dutra R F, Kubota L T. Clin. Chim. Acta, 2007, 376(1): 114-120
37 Masson J F, Battaglia T M, Cramer J, Beaudoin S, Sierks M, Booksh K S. Anal. Bioanal. Chem., 2006, 386(7-8): 1951-1959
38 Chen L, Choo J. Electrophoresis, 2008, 29(9): 1815-1828
39 Bizzarri A R, Cannistraro S. J. Phys. Chem. B, 2002, 106(26): 6617-6633
40 Campbell F, Ingram A, Monaghan P, Cooper J, Sattar N, Eckersall P, Graham D. Analyst, 2008, 133(10): 1355-1357
