皱纹盘鲍和九孔鲍遗传差异nad2-cox1分析及鲍属系统发育
2015-11-01孟学平王兴强杨玉钗
陈 丽,申 欣,孟学平,王兴强,杨玉钗
(淮海工学院海洋学院//江苏省海洋资源开发研究院//江苏省海洋生物产业技术协同创新中心,江苏 连云港,222005)
皱纹盘鲍和九孔鲍遗传差异nad2-cox1分析及鲍属系统发育
陈丽,申欣,孟学平,王兴强,杨玉钗
(淮海工学院海洋学院//江苏省海洋资源开发研究院//江苏省海洋生物产业技术协同创新中心,江苏 连云港,222005)
基于nad2-cox1核苷酸序列分析了皱纹盘鲍和九孔鲍3个养殖群体的遗传差异,基于cox1分析了鲍属19种鲍的系统发育关系。共获得625 bp的DNA片段,33个片段共检测到17种单倍型,其中皱纹盘鲍2个群体26个个体15种单倍型,九孔鲍7个个体2种单倍型。皱纹盘鲍大连群体与厦门群体有6种交叉共享单倍型,皱纹盘鲍与九孔鲍之间无共享单倍型。皱纹盘鲍群体内个体间的遗传距离(D)为 0.002~0.015,九孔鲍个体间 D值为0.003,两种鲍间的遗传距离为0.300~0.320。鲍属系统发育分析显示,皱纹盘鲍与日本鲍、盘鲍聚为一支(D值为0.000~0.004),而后与大鲍聚在一起(支持率为100%)(D值为0.018),九孔鲍、细纹九孔鲍、杂色鲍聚为一支(D值为0)。九孔鲍与马蹄螺科的Diloma bicanaliculata聚为一支,白鲍、黑鲍、红鲍、北国鲍、堪察加鲍聚为一支(支持率87%)。
皱纹盘鲍;九孔鲍;nad2-cox1
鲍为隶属于软体动物门(Mollusca)腹足纲(Gastropoda)鲍科(Haliotidae)海味珍品[1]。目前世界上发现的鲍近100种,投入养殖生产和处于生产试验阶段的鲍已有20多种[2],其中开展人工养殖的有10余种[3]。我国沿海分布的鲍种类有8个,主要经济种类为皱纹盘鲍、杂色鲍和九孔鲍[4]。皱纹盘鲍与盘鲍、杂色鲍和九孔鲍间的遗传关系尚不清楚。等位酶研究显示亲缘关系较近的盘鲍与皱纹盘鲍间的遗传距离为0.055,九孔鲍与杂色鲍间的遗传距离为0.016,盘鲍与九孔鲍间的遗传距离为0.214,盘鲍与杂色鲍的遗传距离(0.172)[5],等位酶研究显示九孔鲍和杂色鲍在生物遗传上非常相似[6],RAPD研究显示杂色鲍和九孔鲍间亲缘关系近(遗传距离为0.32),皱纹盘鲍和盘鲍间亲缘关系近(遗传距离为0.28)[7]。微卫星分析显示惠来皱纹盘鲍与惠来盘鲍的NEI氏遗传距离为0.030,而东山皱纹盘鲍与惠来皱纹盘鲍间的NEI氏遗传距离为0.044,显示为种内群体间遗传距离大于种间遗传距离的异常情况[8]。关于皱纹盘鲍野生群体与养殖群体遗传差异的微卫星分析[9-10]、RAPD分析[11]、杂色鲍养殖群体遗传多样性的微卫星分析[12]等均有报道,皱纹盘鲍群体间、皱纹盘鲍与九孔鲍种间的nad2-cox1分析鲜有报道。基因核苷酸多态性分析结果受操作技术的影响小,较等位酶,微卫星、RAPD标记更为准确可靠,可为鲍属种的分类鉴定及增养殖提供可靠的种质资源遗传背景分子生物学依据。
1 材料和方法
1.1实验材料
实验样品九孔鲍(xjk)采自厦门培阳水产养殖有限公司养殖场,共7个个体;皱纹盘鲍2个养殖群体 26个个体,分别采自大连海洋岛海利奥水产养殖场(DB)和厦门培阳水产养殖有限公司养殖场(JK)。取斧足肌75%(φ)乙醇固定备用或新鲜组织直接提取DNA。
1.2DNA提取及PCR扩增
取乙醇保存的样本,用蒸馏水洗出乙醇,或新鲜组织用SDS、蛋白酶K裂解组织,酚氯仿抽提蛋白质,乙醇沉淀DNA,获得总DNA。引物设计:从 GenBank检索得到皱纹盘鲍(EU595789)和九孔鲍(HQ832673)线粒体基因组DNA,从中析出NADH脱氢酶亚基2基因(nad2),细胞色素c氧化酶亚基1基因(cox1)全序列,用Primer Primer软件分别设计皱纹盘鲍和九子孔鲍nad2-cox1特异引物。Hal-cox1-F:gAT TCg CCg CAA AAT ggA CA; Hal-cox1-R:CTC CTg CAT ggg CAA ggT TA;nad2-cox1-F:5′Cgg CgC AAT gAA AAC CgA 3′;nad2-cox1-R:5′gCA AgA TCT ACC gAT gCC 3′。
PCR反应体系25μL,模板约50 ng,dNTP(10 mmol/dm3)0.5μL,Taq DNA聚合酶[D0090,生工生物工程(上海)股份有限公司]1U,95℃预变性5min后,进行35个循环扩增:94℃变性45s,52℃退火30s,72℃延伸0.8min。35个循环结束后,72℃延伸10min。
1.3PCR产物测序
PCR产物经琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司进行双向测序。电泳时电压5 V/cm,用GoldView进行DNA染色,电泳时间0.5 h;PCR产物经切胶回收,在ABI公司的 3730xl DNA Analyzer测序仪上测序,试剂为BigDye terminator v3.1。
1.4序列分析
将测序所得DNA序列用DNAStar软件组装,结合测序峰图进行序列人工校对,用 ClustalX软件排序取齐,通过DnaSP 5.0软件统计各群体的单倍型,利用MEGA 4分析序列特征、计算遗传差异和遗传距离(K2-P),构建NJ(Neighbor-joining)系统进化树。分别以皱纹盘鲍和九孔鲍 cox1 序列为查寻序列(Query Sequence)进行搜索,获得鲍属不同种cox1核苷酸序列,序列信息如表1,共获得19种鲍25个cox1序列,与本研究获得的17个单倍型cox1序列合并、以马蹄螺科(Trochidae)的Diloma bicanaliculata为外群构建系统进化树,进行鲍属不同种类的系统发育分析。

表1 鲍属不同物种线粒体cox1序列信息Table 1 The cox1 information of different species from genus Haliotis and outgroup species
2 结果与分析
2.1nad2-cox1序列特征
本实验扩增了鲍属皱纹盘鲍和九孔鲍共33个个体的nad2-cox1序列,包括nad2 3′端、cox15′端和2基因间的非编码区共625 bp的核苷酸序列,其中,nad2序列长度为210 bp,cox1序列398bp。基因间隔区为17bp。皱纹盘鲍nad2 和cox1核苷酸序列的A、G、T、C比率(%)相同,分别为27.4、 19.4、26.9、26.4,A+T比率为54.3%;九孔鲍A、G、T、C比率(%)分别为26.5、20.4、26.7、26.5,A+T比率为53.2%,A比率明显低于皱纹盘鲍,G比率明显高于皱纹盘鲍。
2.2nad2-cox1序列比对
用于核苷酸序列比对的DNA片段长610 bp,33个个体nad2-cox1序列经DnaSPv5分析共得到17种单倍型(hap)(表2)。
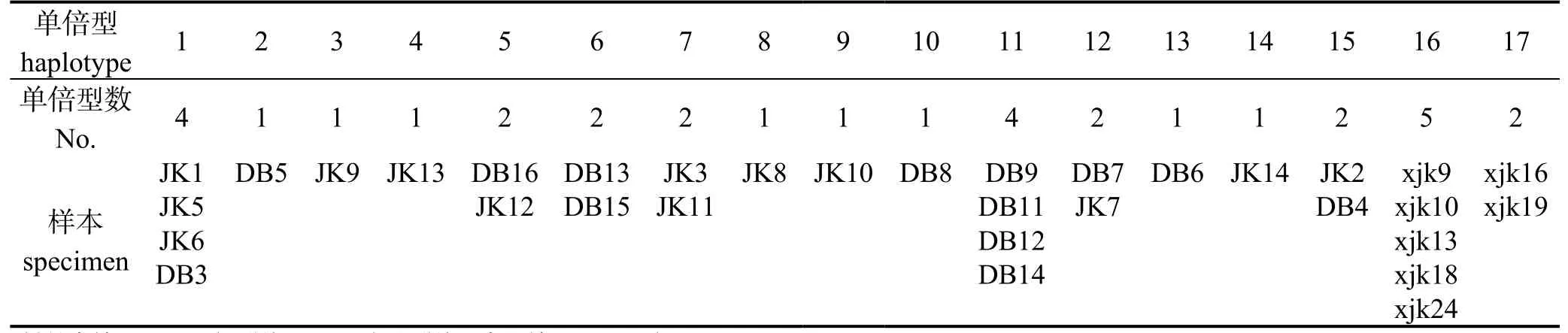
表2 皱纹盘鲍和九孔鲍 3个群体nd2-cox1单倍型分布Table 2 The nad2-cox1 haplotype distribution on three populations of H.discus hannai and H.diversicolor supertexa
皱纹盘鲍26个个体有15种haps(DB,JK),九孔鲍(xjk)7个个体有2种haps(hap16,hap17)。九孔鲍有5个样本共享hap16,2个样本共享hap17;皱纹盘鲍大连群体(DB)(13个个体)有9种单倍型,其中 4种单倍型(hap1,5,12,15)与厦门群体(JK)共享,5种单倍型为群体内独享;厦门群体13个个体,独享单倍型6种(hap3,4,7,8,9,14);hap1的频率最高,为15.2%,hap1和hap11的频率次之,均为12.1%。
17种单倍型核苷酸序列比对结果显示(图1),在625个比对位点中有160个变异位点,占25.6%。其中皱纹盘鲍15种单倍型中,有21个变异位点,占3.4%;九孔鲍2种单倍型变异位点有2个,占0.3%。九孔鲍区别于皱纹盘鲍的变异位点139个,占变异位点的86.9%,这些变异位点可用于九孔鲍和皱纹盘鲍的鉴别。

图1 九孔鲍和皱纹盘鲍cox1(上)和nad2(下)(后8个位点为基因间隔区)核苷酸变异位点Fig.1 The variable sites of cox1(top)and nad2(below)of Haliotis discus hannai and H.diversicolor supertexta
将nad2和cox1核苷酸序列分别比对显示,皱纹盘鲍与九孔鲍间nad2的变位点77个,占36.7%(77/210),cox1的变异位点 75个,占 18.8%(75/398)。两基因之间的非编码区变异位点占47.1%(8/17)。编码区2个基因的变异率明显不同,nad2的变异率是cox1的近2倍,两基因的间隔区变异率最高。
2.3基于nad2-cox1序列的遗传距离
基于nad2-cox1的核苷酸序列,计算了皱纹盘鲍群体间、皱纹盘鲍和九孔鲍种间的遗传距离(K2-P)(表3),由表3可见,皱纹盘鲍种内个体间的遗传距离为 0.002~0.015,九孔鲍种内个体间遗传距离为 0.003。2种鲍间的遗传距离为0.300~0.320。基于nad2核苷酸序列的2种鲍间的距离为 0.480~0.510,与皱纹盘鲍群体内个体间遗传距离(平均为0.009)之比为53.3~56.5。基于cox1的遗传距离为 0.200~0.210,与皱纹盘鲍群体内个体间遗传距离(平均为0.009)之比为22.20~23.30。此结果显示鲍属种间 nad2核苷酸变异率明显比cox1高,且2种鲍间的遗传关系较远。

表3 基于nad2-cox1核苷酸序列的皱纹盘鲍的九孔鲍的遗传距离(k2-p)Table 3 The distance based on nad2-cox1 nucleotide sequences of H.discus hannai and H.diversicolor superrtexa
2.4基于nad2-cox1序列的系统发育分析
基于nad2-cox1的皱纹盘鲍和九孔鲍17种单倍型构建的N-J树显示,九孔鲍2种单倍型聚为一支(hap16,17),且支持率很高(100%),皱纹盘鲍的 15种单倍型聚为另一支,支持率相对低,而且皱纹盘鲍大连群体和厦门群体未聚为单系支,而是交叉聚在一起。说明大连群体和厦门群体有基因交流。
2.5基于cox1序列的鲍属19种鲍的系统演化关系
将鲍属19种鲍的25条cox1基因片段与本研究获取的cox1核苷酸序列一起共获得42条序列。进行系统发育分析,取齐后共获得302个比对位点。系统发育分析结果见图2。

图2 基于Ccox1的鲍属不同种类间的系统发育关系Fig.2 Phylogenetic analysis of differenet species on the genus Haliotis based on cox1
由图2可见,九孔鲍、细纹九孔鲍和杂色鲍聚为一支(支持率99%),本研究的皱纹盘鲍(DB群体和JK群体)与日本鲍和盘鲍的遗传关系很近,聚为1支,支持率较低(86%)。以皱纹盘鲍的cox1全序列(EU595789)在GenBank重新搜索,结果发现,日本鲍与皱纹盘鲍的同源性为99%(534/535),盘鲍与皱纹盘鲍的同源性为 99%(533/535),而与另一皱纹盘鲍(AB2366789)(533/535)的同源性也为99%。这说明皱纹盘鲍、日本鲍和盘鲍可能是一个种的不同种群;H.kamtschatkana kamtschatkana(JF285135)与H.kamtschatkana assimilis(JF285142)聚为一支,重新blast分析后显示这2个序列的同源性为99%(815/816)。堪察加鲍和白鲍聚为一支(84%);澳大利亚黑鲍(H.rubra)和旋风鲍(H.conicopora)的同源性为100%(535bp/535bp),可能是1个种的不同群体;红鲍、黑鲍、白鲍、堪察加鲍、H.kamtschatkana assimilis、H.kamtschatkanakamtschatkana遗传关系近,聚为一大支(支持率为87%)
3 讨 论
3.1鲍遗传背景研究亟待加强
种质资源是遗传育种的基础,清晰的遗传背景是鲍增养殖及良种选育和杂交育种的重要资料。我国沿海鲍分布有8种,主要经济种类为皱纹盘鲍、杂色鲍和九孔鲍[13]。中国是世界上第一养鲍大国,2009年养殖产量(4.23万t)占世界总产量的82.3%。福建是我国的第一养鲍大省,2010年以4.13万t占全国总产量的73.0%[4],2011年占全国的78.7%。2011我国的鲍鱼养殖产量达7.7万t,年产值100多亿[3]。近年来,鲍鱼的研究主要集中在加工[14-15]、天然产物的提取[16-17]、功能基因研究[18-19]等方面,有关鲍鱼遗传结构及遗传多样性的基础研究报道很少,这与我国迅速发展的鲍鱼养殖业不相适应。本研究结果可为鲍的杂交育种、优良种质的选育等鲍养殖业提供有价值的参考资料。
3.2nad2-cox1片段作为群体遗传差异分析的分子标记特点
在同一个物种中,线粒体基因组不同的蛋白质基因变异率不同,不同的物种线粒体同一种蛋白质基因的保守性也不同[20]。研究线粒体不同基因的变异率对于鲍鱼的群体遗传差异及同属不同物种间演化关系的研究具有重要意义,变异率高的基因可用于同种内群体间差异分析,变异率低的基因可用于种间差异分析。关于鲍鱼线粒体全基因组已有报道[21],可为基因片段的扩增引物设计提供资料,为基于线粒体DNA的群体遗传差异分析提供了方便。本研究nad2-cox1片段扩增引物就是根据已有的鲍的线粒体基因组全序列设计。分析结果显示鲍鱼nad2的变异率明显高于cox1,nad2 更适合种内群体间遗传差异分析。在鲍的线粒体DNA中,cox1和nad2是相邻的2个基因,且在两基因间有一段非编码区。两个基因的解析能力不同,将两个基因的片段结合,加之基因间的非编码区(具有更高的解析能力)所得实验结果更说明问题。
3.3鲍属不同种的遗传背景
鲍属的物种相对多,根据形态学进行分类,有的难以辩认。将形态学与分子生物学资料结合,可有效解决鲍属物种系统演化关系。基于线粒体全基因组的贝类遗传距离多数在5%以上,最低的也有2%[22],cox1是线粒体蛋白质基因中相对保守的基因,种间差异水平也应达到5%。本研究显示日本鲍与皱纹盘鲍、盘鲍与皱纹盘鲍cox1的同源性很高,达99%,其差异水平未达到种间差异水平。资料中的日本鲍、盘鲍与皱纹盘鲍是否是一个种,有待深入研究。此外,还发现H.kamtschatkana kamtschatkana(JF285135)与H.kamtschatkana assimilis(JF285142)聚为一支,这2个序列的同源性为99%(815/816),其差异也未达到种间差异的水平;澳大利亚黑鲍和旋风鲍的同源性为100%。鲍属物种的系统演化关系研究结果有诸多不明确之处,需作更多的研究加以澄清。目前我国鲍长途运输频繁,苗种总体质量不高,种质资源退化严重,影响鲍的抗病能力及生产能力,有必要对现存鲍的遗传背景作深入细致的研究,为我国鲍养殖业健康、理性发展服务。
[1]梁爽,骆轩,游伟伟,等.温度骤变对皱纹盘鲍与西氏鲍及其杂交群体的热休克蛋白表达影响[J].厦门大学学报:自然科学版,2013,52(5):687-702.
[2]蔡明夷,柯才焕,周时强,等.鲍遗传育种研究进展[J].水产学报,2004,28(2):201-208.
[3]柯才焕.我国鲍鱼养殖产业现状与展望[J].中国水产,2013,(1):27-30.
[4]王进可,严正凛.鲍养殖现状及发展趋势[J].水产科学,2012,31(12):749-753.
[5]黎中宝,刘文彪,韩芳,等.4种经济鲍遗传多样性与分化的研究[J].中国生态农业学报,2005,13(4):15-19.
[6]黎中宝,田柱,朱冬蕊,等.九孔鲍和杂色鲍等位酶的生化遗传分析[J].海洋科学,2004,28(2):27-31.
[7]黎中宝.应用RAPD技术研究4种鲍的亲缘关系[J].中国生态农业学报,2004,11(2):60-63.
[8]杜博,龚世园,童馨,等.皱纹盘鲍和盘鲍南方养殖群体遗传变异的微卫星分析[J].南方水产,2007,3(6):22-29.
[9]束靖一,李琪,于瑞海,等.皱纹盘鲍野生与养殖群体微卫星标记遗传变异研究[J].中国海洋大学学报,2008,31(1):52-58.
[10]李莉,孙振兴,杨树德,等.用微卫星标记分析皱纹盘鲍群体的遗传[J].遗传,2006,28(12):1549-1554.
[11]李莉,孙振兴,常林瑞,等.皱纹盘鲍野生与养殖群体遗传多样性的研究[J].海洋通报,2005,24(6):82-86.
[12]许新,王江勇,姜敬哲,等.广东沿海杂色鲍养殖群体遗传多样性的微卫星分析[J].海洋科学进展,2012,30(2):284-294.
[13]王进可,严正凛.鲍养殖现状及发展趋势[J].水产科学,2012,31(12):49-753.
[14]袁起新,朱蓓薇,董秀萍,等.鲍鱼腹足胶原蛋白的提取及性质研究[J].,大连工业大学学报,2012,31(1):35-39.
[15]黄菊青,方婷,陈锦权.酱汁鲍鱼硬罐头杀菌工艺及流变学性质研究[J].食品科学,2011,32(14):67-71.
[16]郑瑞生,王则金,陈纯,等.烘烤条件对即食鲍鱼品质影响的研究[J].西南师范大学学报:自然科学版,2013,38(2):116-120.
[17]胡谷平,刘丽红,佘志刚,等.鲍鱼多糖Hal-B的乙酰解研究[J].中山大学学报:自然科学版:2006,45(6):128-130.
[18]Li M Z,Mai K S,He G,et al.Characterization of two Δ5fatty acyl desaturases in abalone(Haliotis discus hannai Ino)[J].Aquaculture,416-417:48-56.
[19]Huang Y T,Cai X H,Zou Z H,et al.Molecular cloning,characterization and expression analysis of three heat shock responsive genes from Haliotis diversicolor[J].Fish & Shellfish Immunology,2014,36(2):590-599.
[20]孟学平,申欣,赵娜娜,田美,梁猛,郝珏,程汉良,阎斌伦,董志国.漳州西施舌线粒体基因组全序列:腔蛤蜊属(Coelomactra)存在新种的证据[J].海洋学报,2013,35(3):204-214.
[21]Xin Y,Ren J F,Liu X.Mitogenome of the small abalone Haliotis diversicolor Reeve and hylogenetic analysis within Gastropoda[J].Marine Genomics,2011,4(4):253-262.
[22]Shen X,Meng X P,Chu K H,et al.Comparative mitogenomic analysis reveals cryptic species:A case study in Mactridae(Mollusca:Bivalvia)[J].Comparative Biochemixtry and Physiology D,2014,12:1-9.
(责任编辑:陈庄)
Genetic differences of Haliotis discus hannai and H.diversicolor supertexta and phylogenetic relationships of genus Haliotis based on nad2-cox1
CHEN Li,SHEN Xin,MENG Xue-ping,WANG Xing-qiang,YANG Yu-chai
(Jiangsu Marine Resource Development Research Institute,Co-Innovation Center of Jiangsu Marine Bioindustry Technology,Marine College of Huaihai Institute of Technology,Lianyungang 222005,China)
The genetic differences among three populations of Haliotis discus hannai and H.diversicolor supertexta was examined by adopting the partial sequences of the mitochondrial NADH dehydrogenase subunit 2-cytochrome coxidase subunit 1 genes(nad2-cox1).And the phylogenetic relationships of genus Haliotiswas analyzed based on cox1 fragments.A total of 625 bp of DNA fragments were obtained.Seventeen haplotypes were identified from 33 samples,among which,fifteen haplotypes were in of 26 samples of Dalian and Xiamen H.discus hannai,two haplotypes were in seven samples of H.diversicolor supertexta.and six haplotypes were shared by two populations of H.discus hannai,however,no shared hyplotypes were found between H.discus hannai and H.diversicolor supertexta.The genetic distance(D value)was 0.002-0.015 withinthe group of H.discus hannai,and was 0.003 withinthe group of H.diversicolor supertexta and reached 0.300-0.320 between H.discus hannai andH.diversicolor supertexta.Phylogenetic analysis showed that H.discus hannai,H.madaka,and H.discus were clustered into one clade(D value 0.000-0.004),then grouped with H.gigantea(Support rate 100%,D value 0.018).H.diversicolor supertexta,H.diversicolor aquatilis formed another clade(D value 0).H.diversicolor supertexta and Diloma bicanaliculata(Gastropoda:Trochidae)formed the third clade and H.sorenseni,H.cracherodii,H.rufescens,H.walallensis and H.kamtschatkana formed the fourth clade(Support rate 87%).
Haliotis discus hannai;H.diversicolor supertexta;nad2-cox1
S917.4
A
1673-9159(2015)01-0028-07
2015-01-15
连云港市产学研究联合研究项目(CXY1219);江苏省自然科学基金项目(BK20131210);江苏省海洋资源开发研究院科技开放基金(JSIMR11B19);江苏省水产三新工程重大项目(DY2012-4-2);江苏高校优势学科建设工程资助项目(PAPD)
陈丽(1970-),女,硕士,副教授,研究方向为水生生物生理生化及天然产物的提取。E-mail:13961380000@163.com
孟学平,教授,主要从事水生生物生化与分子生物学研究。E-mail:mxp2002@hotmail.com
