枸杞多糖对糖尿病大鼠的降血糖作用及血清TNF-α IL-6水平的影响
2015-11-01于蕾崔宏伟
于蕾 崔宏伟*
枸杞多糖对糖尿病大鼠的降血糖作用及血清TNF-α IL-6水平的影响
于蕾崔宏伟*
目的 探讨枸杞多糖(LBP)对链脲佐菌素(STZ)致糖尿病大鼠的降血糖作用以及对其血清炎症因子肿瘤坏死因子(TNF-α)、白介素6(IL-6)水平的影响。方法 分别给予50只健康雄性Wistar-Imamichi大鼠腹腔注射STZ (40mg/kg)制备糖尿病模型。待模型成功后,分别灌胃给予不同剂量的LBP进行干预治疗。在同等条件下,选取罗格列酮为阳性对照药物,给予大鼠腹腔注射生理盐水作为空白对照组。连续灌胃给药30d。对各组大鼠一般行为学、空腹血糖(FBG)、空腹胰岛素(FNS)、胰岛素敏感指数(ISI)以及胰岛素抵抗(HOMA-IR)、血清TNF-α、IL-6的水平进行测定。结果 与正常对照组大鼠体重相比,模型组大鼠的体重显著下降,差异有统计学意义(P<0.05),与模型组大鼠体重相比较,罗格列酮组、LBP组(低、中、高)各组大鼠体重随着实验进程而增加,差异有统计学意义(P<0.05)。药物干预糖尿病模型大鼠后,与模型组比较,罗格列酮组、LBP(低、中、高)组大鼠FBG、FNS、血清IL-6、血清TNF-α水平逐渐降低,差异有统计学意义(P<0.05),ISI指数有所提高,而IR指数下降,差异有统计学意义(P<0.05)。结论 LBP对STZ致糖尿病大鼠模型具有降低血糖的作用,可能的机制与降低血清炎症因子及改善脂质代谢有关。
枸杞多糖 糖尿病 大鼠 IL-6 TNF-α
枸杞多糖(lycium barbarum polysaccharide,LBP)是来源于枸杞的干燥成熟果实含有如阿拉伯糖、葡萄糖及木糖等单糖成分,以及多种微量元素和氨基酸[1,2],具有多样的生物活性,如抗氧化、抗衰老、抗肿瘤、降血糖和增强机体免疫力等功效[3~5]。本资料中,作者着重探讨不同剂量LBP对链脲佐菌素(STZ)致糖尿病大鼠的降血糖作用,以及对于血清炎性因子肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)的影响,分析其在糖尿病中的作用,探讨LBP的降糖机制。报道如下。
1 材料与方法
1.1试剂及仪器 50%LBP精粉(呼和浩特市泽生试剂公司);STZ(美国Sigma公司);罗格列酮(山东鲁抗医药股份有限公司);血糖试剂盒[柏定生物工程(北京)有限公司生产];碘胰岛素(INS)放射免疫分析药盒(北京科美东雅生物公司); TNF-α酶联免疫吸附测定法(ELISA)试剂盒(武汉博士德生物工程有限公司); IL-6 ELISA试剂盒(武汉博士德生物工程有限公司);无水乙醇、氯仿均为分析纯。OLYMPUSAU2700全自动生化分析仪(日本OLYMPUS公司);GC-1200型γ-放免计数器(上海五久自动化设备有限公司);RT-2100型酶标仪(上海Rayto公司);TOMY SX-500高压灭菌锅(日本OTMY公司)。
1.2实验用溶液配制 (1)2.0% STZ溶液的配制:将预先配制的柠檬酸缓冲液A液(2.1g柠檬酸加入100ml双蒸水即得)与B液(2.94g柠檬酸钠加入100ml双蒸水即得)按照1:1的比例混合,调节pH=4.5(pH计调节),即配制成功实验用柠檬酸缓冲液。随即称取112.5mg STZ溶入5ml 上述配制的柠檬酸缓冲液中,即得浓度为 22.5 mg/ml的实验用2.0% STZ 溶液。(2)4.0% LBP溶液的配制:称取8.0g LBP精粉(UV 50%)溶入0.9%的100ml生理盐水溶液,即得4.0%实验用LBP溶液。
1.3实验动物 取健康、雄性Wistar-Imamichi大鼠60只,鼠龄4~6 周,体重(200±20)g。Wistar-Imamichi大鼠由内蒙古大学实验动物中心提供。普通环境下饲养,温度保持在(23±2)℃,相对湿度60%~70%。普通饲料喂养,自由饮水,通风流畅,自然光线照明。
1.4实验方法 参考文献报道方法,制备腹腔注射STZ大鼠糖尿病模型[6]。具体操作方法:于标准动物饲养室适应性饲养动物3d后,禁食12 h(自由饮水),按空腹体重一次性腹腔注射新鲜配制并预冷的 STZ 溶液(40 mg/kg)制备糖尿病模型。注射完毕观察1h未见大鼠异常后,给予自由饮食。注射后3d,采用断尾法,测定大鼠尾静脉血糖即空腹血糖(FBG)。选取FBG≥16.8 mol/L,且尿糖呈现阳性,具备多尿、多饮、多食症状的大鼠作为糖尿病大鼠模型。本次实验中,除10只空白对照组大鼠外,剩余50只大鼠全部制备糖尿病模型成功。分组情况:空白对照组(n=10):灌胃 0.4g/(kg・d)生理盐水;糖尿病大鼠模型组(n=10):灌胃0.4g/(kg・d)生理盐水;LBP低剂量组(n=10):灌胃0.4g/(kg・d)LBP;LBP中剂量组(n=10):灌胃0.8g/(kg・d)LBP;LBP高剂量组(n=10):灌胃1.6g/(kg・d)LBP;罗格列酮对照组(n=10):灌胃0.4g/(kg・d)罗格列酮。实验持续30d。实验期间,观察各组大鼠的整体状况,包括:整体精神活动、毛发光泽度、饮水量及进食量、大小便成色等,同时每隔2天对各组大鼠进行称重,记录体重变化情况及死亡情况等。实验结束前对各组大鼠禁食12h,于给药1 h后,大鼠腹股沟股动脉取血(5ml抗凝及促凝采血管各1支)。对促凝管进行离心(3000r/min,10min),吸取上清液,-20℃冻存,备用;抗凝管血液直接-20℃冻存,备用。
1.5 观察指标 (1)FBG:葡萄糖氧化酶法,测定严格按照GOD-PAP法所用试剂盒说明说进行操作。(2)采用空腹胰岛素(FNS):放射免疫法测定并计算胰岛素敏感指数(ISI)及胰岛素抵抗指数以及降糖效率。(3)TNF-α和IL-6水平:采用ELISA法测定。
1.6统计学方法 采用SPSS 13.0统计软件。计量资料以(x±s)表示,组间比较采用t检验。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠的一般状况 实验期间,对照组大鼠毛色光滑,喜活动,精神状态佳,体重增长明显;而糖尿病大鼠模型毛色粗糙无光泽,形体消瘦,精神萎靡不振,不好动,同时好饮食、饮水且伴有多尿等症状。灌胃给药后,罗格列酮、LBP组的大鼠较模型组表现为体重增长明显,毛色有所改变,精神状况良好,多饮食、饮水及多尿症状有所改变。实验结果显示,各组大鼠体重在实验开始时,差异无统计学意义(P>0.05);实验第15、30天时,与正常对照组大鼠体重比较,模型组大鼠的体重显著下降,差异有统计学意义(P<0.05),而其他各组大鼠体重增长,但差异无统计学意义(P>0.05);而与模型组大鼠体重相比较,罗格列酮组,LBP组(低、中、高)各组大鼠体重随着实验进程而增加,差异有统计学意义(P<0.05)。见表1。

表1 LBP对各组大鼠体重的影响[g,(x±s)]
2.2LBP对糖尿病大鼠模型FBG的影响 见表2。

表2 LBP对各组大鼠模型FBG的影响(x±s)
2.3对糖尿病大鼠模型FNS、ISI、IR的影响 见表3。
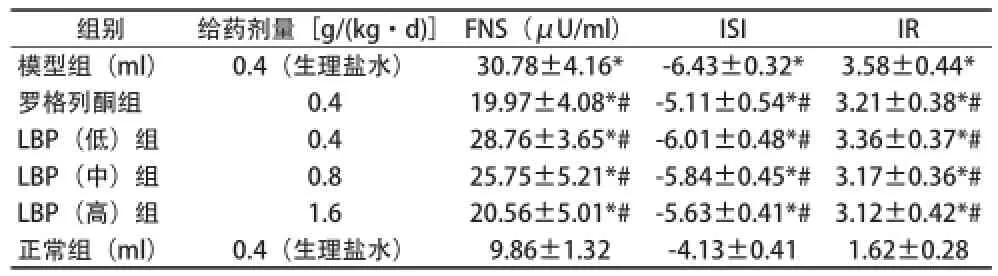
表3 LBP对各组大鼠模型FNS、ISI、IR的影响(x±s)
2.4LBP对糖尿病大鼠血清IL-6、TNF-α水平的影响 见表4。

表4 LBP对各组大鼠血清IL-6、TNF-α水平的影响(x±s)
3 讨论
既往研究表明,糖尿病是由于遗传和环境因素导致的胰岛素分泌绝对不足或相对不足而引起的慢性、全身性、代谢性疾病[7]。近年来炎症致糖尿病的学说受到普遍关注。IL-6、TNF-α广泛地参与人体的许多生物学过程,如参与免疫应答、诱导肝细胞的急性期反应、调节体温、炎症反应、调节肿瘤细胞的生长、促进造血和调节神经内分泌系统等[8]。糖尿病的主要临床表现症状多为“三多一少”,即多饮食、多饮水、多尿液以及体重减轻。而糖尿病的治疗策略主要为降血糖和恢复胰岛素水平[9]。本实验结果表明,阳性对照药物及不同剂量的LBP对糖尿病大鼠有降低血糖,缓解体重下降和改善精神萎靡的作用。李晓冰等[10]研究表明,LBP具有降血糖作用。本资料结果显示,灌胃给予不同剂量的LBP干预30d,药物组较模型组大鼠FBG显著下降,与上述研究结论相一致。
IR是诱发糖尿病发病的基础之一,是指胰岛素的外周靶器官或靶组织,主要是肝脏、肌肉和脂肪组织对胰岛素敏感性及反应性降低,从而导致人体胰岛素难以产生正常的生理效应。IR能提高血浆中胰岛素和血糖的水平,导致代谢综合征和胰岛素分泌的缺陷。目前以IR为靶向的药物干预是抗糖尿病药物研发的新策略之一[11]。宗灿华等[12]灌胃给予Ⅱ型糖尿病IR大鼠LBP干预8周,各组大鼠较模型组大鼠空腹FBG、FINS水平及IR显著下降,ISI指数升高,说明LBP具有较好的改善Ⅱ型糖尿病大鼠胰岛素抵抗、增加胰岛素敏感性的作用。本资料结果显示,给予糖尿病大鼠不同浓度的LBP干预后,各组大鼠较模型组大鼠空腹FBG、FINS水平及IR指数显著下降,ISI指数升高。
研究报道还表明[13,14],TNF-α、IL-6属于血清的炎症因子,LBP通过降低血清炎症因子的水平,发挥改善脂代谢并降低机体脂毒性,从而改善IR作用。黄云兰等[15]研究表明,灌胃给予糖尿病大鼠模型不同剂量的LBP治疗干预,大鼠的胰岛素敏感指数较模型组大鼠有所增加,血清炎症因子如IL-6、TNF-α水平均有下降,差异有统计学意义(P<0.05),显示LBP能有效提高胰岛素敏感指数,改善胰岛素抵抗状态和缓解脂毒性,对糖尿病大鼠有一定的治疗作用。本资料结果显示,给予LBP治疗后,大鼠的胰岛素敏感指数均有所增加,血清中的IL-6、TNF-α水平均有下降,提示LBP可能通过降低血清的炎症因子,从而改善脂质代谢,提高糖尿病大鼠对胰岛素的敏感性。
综上所述,LBP对STZ致糖尿病大鼠模型具有降低血糖的作用,可能的机制与降低血清炎症因子及改善脂质代谢有关,为其临床应用提供理论基础。
1Zhang M,Tang X,Wang F,et al.Characterization of Lycium barbarum polysaccharide and its effect on human hepatoma cells . Int J Biol Macromol, 2013,61(3):270~275.
2王茂山,荀其宁.枸杞功能性成分的提取及其组成的液相色谱分析.化学分析计量,2012,21(3):75~77.
3Qiu S,Chen J,Chen X,et al.Optimization of selenylation conditions for lycium barbarum polysaccharide based on antioxidant activity . Carbohydr Polym,2014,103(1):148~153.
4Yi R,Liu XM,Dong Q.A study of Lycium barbarum polysaccharides(LBP) extraction technology and its anti-aging effect . Afr J Tradit Complement Altern Med,2013,10(4):171~174.
5Zhu CP,Zhang SH.Lycium barbarum polysaccharide inhibits the proliferation of HeLa cells by inducing apoptosis.J Sci Food Agric,2013,93(1):149~156.
6吴元洁,吴元波,郑书国,等.糖尿病大鼠血糖波动模型的建立.南方医科大学学报,2014,34(6):771~776.
7张宸.糖尿病的遗传因素和环境因素.国家中医药管理局、中华中医药学会.第五届国际中医糖尿病大会暨国家中医药糖尿病临床研究联盟成立大会论文集.国家中医药管理局、中华中医药学会,2011.1.
8Du Shuxu,Jia Yongrui,Tang Hong,et al.Immune regulation of hydrogen sulfide in children with acute lymphoblastic leukemia.中华医学杂志(英文版),2014,21:3695~3699.
9翁建平.中国糖尿病治疗策略研究(STRATEGY)进展.中华医学会、中华医学会内分泌学分会.中华医学会第十三次全国内分泌学学术会议会议指南.中华医学会、中华医学会内分泌学分会,2014.2.
10李晓冰,陈玉龙,展俊平,等.LBP对糖尿病大鼠血糖水平及机体免疫功能的影响.中国全科医学,2013,16(27):3208~3210.
11Gong YY, Liu YY, Li J, et al. Hypermethylation of Cox5a promoter is associated with mitochondrial dysfunction in skeletal muscle of high fat diet-induced insulin resistant rats. PLoS One,2014,9(12):e113784.
12宗灿华,田丽梅.LBP对2型糖尿病胰岛素抵抗模型大鼠resistin基因表达的影响.药物生物技术,2008,15(4):275~277.
13Boonloh K,Kukongviriyapan U,Pannangpetch P,et al.Rice bran protein hydrolysates prevented interleukin-6-and high glucose-induced insulin resistance in HepG2 cells.Food Funct,2015,6(2):566~573.
14Schulte D M,Muller N,Neumann K,et al.Proinflammatory wnt5a and anti-inflammatory sFRP5 are differentially regulated by nutritional factors in obese human subjects. PLoS One,2012,7(2):32.
15黄云兰,梁耿,韦凯东,等.LBP对大鼠糖尿病的作用研究.中国实验方剂学杂志,2012,18(22):275~278.
Objective To discuss the effect of lycium barbarum polysaccharide (LBP) on the hypoglycemic activity and the level of serum inflammatory factors as tumor necrosis factor-α (TNF-α),interleukin-6 (IL-6) in the diabetic rats induced by Streptozotocin. Methods Fifty male Wistar-Imamichi rats were injected peritoneally by streptozotocin (STZ) with a dose of 40 mg/kg to establish diabetic rat models. Meantime,ten male Wistar-Imamichi rats were injected peritoneally by normal saline (NS) with a dose of 0.4 g/kg as normal control group. Successful rats’models confirmed by detecting fasting blood-glucose (FBG).The rats in the normal and model control groups were given same volume of normal saline. The drugs were given to mice daily for 30 consecutive days. During the period of experiment,General state and behavioral observation,Fasting blood glucose (FBG),fasting insulin (FNS),the insulin sensitivity index (ISI) and insulin resistance (IR),serum tumor necrosis factor-α(TNF-α) and interleukin-6 (IL-6) of each group rats were observed. Results Compared to the control group,the model group rats body weight reduced obviously,there was significant difference (P<0.05). And then compared to the model group,rosiglitazone positive group group and lycium barbarum polysaccharide (low,medium,high) groups rats body weight gained,there was significant difference (P<0.05). After the drug intervention,the levels of FBG,FNS,serum IL-6 and TNF-α in rosiglitazone positive group and lycium barbarum polysaccharide (low,medium,high) groups rats reduced gradually,but ISI index increased and IR index dropped,there was significant difference (P<0.05). Conclusions The results suggest that lycium barbarum polysaccharide has the obvious hypoglycemic and hypolipidemic effects that could be related to its reducing the level of serum inflammatory factor,improving lipid metabolism.
Lycium barbarum Polysaccharide diabetes Rats TNF-α IL-6
010020 内蒙古自治区中医医院药剂科(于蕾)010050 内蒙古医科大学附属医院临床医学研究中心(崔宏伟)
