黑曲霉-葡萄糖苷酶的分离纯化及酶学性质
2015-10-31刘中美谢梦圆周哲敏
刘中美,谢梦圆,周哲敏
(江南大学生物工程学院,江苏无锡214122)
黑曲霉-葡萄糖苷酶的分离纯化及酶学性质
刘中美,谢梦圆,周哲敏*
(江南大学生物工程学院,江苏无锡214122)
“绿色资源”纤维素广泛应用于能源、医药、食品等领域,β-葡萄糖苷酶(BGL)作为纤维素降解酶系的限速酶是当前研究热点之一。作者对黑曲霉利用豆渣发酵所产的胞外β-葡萄糖苷酶进行分离纯化,并对该酶进行了酶学性质表征。实验结果表明,BGL最适反应温度为55℃,最适反应pH为2.0~2.5,pH稳定范围为2.0~7.5。在最适反应条件下,Km值为8.4×10-4mol/L,kcat为16 s-1,催化效率kcat/Km为1.92×104L/(mmol·s)。相比较其他报道的BGL酶,该酶具有更好的耐酸性能,可为BGL的理论研究与酶制剂的生产应用提供一定基础。
β-葡萄糖苷酶;对硝基苯-β-D吡喃葡萄糖苷;分离纯化;酶学性质
纤维素类物质是自然界中存在的一类最丰富、最廉价的绿色资源,有效科学地利用纤维素资源已经成为当前的热点研究。纤维素可由纤维素酶降解成为单糖,再通过微生物发酵应用于诸多领域,如燃料、食品、医药、化工原料、饲料等[1-2]。纤维素糖化主要通过纤维素酶系中的内切葡聚糖酶(Cx)、外切葡聚糖酶(C1)和β-葡萄糖苷酶的协同作用。纤维素降解时,纤维二糖的积累会抑制内切葡聚糖酶、外切葡聚糖酶的活性,而β-葡萄糖苷酶可以水解纤维二糖,实现纤维素的彻底降解,是纤维素降解的限速酶[3]。除了具有纤维素酶制剂的巨大市场潜力之外,β-葡萄糖苷酶还广泛应用于饲料、饮料增香剂、龙胆低聚糖和红景天等糖苷类物质合成、临床诊断和治疗等多个领域。
β-葡萄糖苷酶(β-glucosidase,BGL,EC 3.2.1.21)可以催化水解非还原性的β-D-糖苷键,同时释放出β-葡萄糖和相应的配基。对β-葡萄糖苷酶的研究可以追溯到1837年,Liebig和Wohler首次在苦杏仁汁中发现该酶[4]。后来大量研究表明,它广泛存在于植物、昆虫、酵母、曲霉、细菌体内,微生物来源的BGL酶活性远远高于植物来源的酶。目前为止,已经有近百个动植物和微生物体内的BGL得到了分离纯化、基因克隆、酶学性质测定。BGL的相对分子质量一般在40 000~250 000之间,最适反应温度一般在30~65℃,最适反应pH值为4~7.5,而在pH 4~9可以保持稳定。大部分的BGL的p I值都在酸性范围内,并且变化不大,一般在3.5~5.5[5-7]。
近年来,国内外多家研究机构致力于BGL的分子生物学研究和开发应用,期望增加其酶活性,提高纤维素酶降解效率,更有效地利用纤维素资源。作者从一株黑曲霉(Aspergillus niger)发酵液中分离纯化出β-葡萄糖苷酶,该酶具有非常好的耐酸性能,在pH 2.0~7.5环境中酶活力稳定,可以为BGL的进一步理论研究和工业应用提供一定基础。
1 材料与方法
1.1材料
1.1.1菌株实验所用菌种为作者所在实验室分离、选育得到的黑曲霉(Aspergillus niger)。
1.1.2试剂与仪器对硝基苯基-β-D-吡喃葡萄糖苷(pNPG),胰蛋白酶:购自上海生物工程公司,其他试剂均为国产或进口分析纯。
Purifier AKTA蛋白纯化系统:通用电气(中国)医疗器械集团;HiTrap Q HP(1 mL):通用电气(中国)医疗器械集团;高速冷冻离心机:THERMO公司;UV1100紫外-可见分光光度计:上海美谱达仪器有限公司;MALDI-TOF/TOF:美国布鲁克道尔顿公司。
1.1.3主要培养基CYM培养基(菌种保藏用):葡萄糖20 g,蛋白胨2 g,酵母膏2 g,七水硫酸镁0.5 g,磷酸氢二钾1.0 g,磷酸二氢钾0.46 g,琼脂20 g。豆渣培养基:豆渣2 g,纯水100 m L于500 mL三角瓶中,氢氧化钠调节pH至5.8。
1.2方法
1.2.1发酵与分离纯化将平板保藏的菌种黑曲霉连同培养基的基内菌丝转接到盛有无菌水和小玻璃珠的三角瓶中,均匀振荡,使菌体破碎并且进入无菌水中。取混有菌体菌丝的的混合液0.5mL接种到豆渣培养基中,28℃、150 r/min摇床培养5 d。
抽滤发酵液,将粗酶液与冰冻乙醇以1∶1.5的比例互溶,在4℃条件下,10 000 r/min离心后用20 mmol/L磷酸缓冲液(pH 7.5)复溶沉淀,再次离心取上清液,用0.22μm过滤膜过滤。利用离子交换层析柱HiTrap Q HP纯化目的蛋白质,用含有0.4 mmol/L NaCl的20 mmol/L磷酸盐缓冲液(pH 7.5)进行线性洗脱。按峰收集样品,将收集的样品进行SDS-PAGE及活性分析。蛋白质定量采用常规的Bradford法,采用牛血清蛋白为标准蛋白质。
1.2.2温度对酶活影响以pNPG为底物,用比色法测定酶活力[8]。取酶液400μL,加入50mmol/L邻苯二甲酸氢钾-盐酸缓冲液(pH 2.5)1.2 mL,50 mmol/L pNPG 400μL,55℃下反应5 min后加入6%碳酸钠4mL终止反应。测定OD400nm处吸光度,用加热灭活的纯酶液作对照。一个单位酶活力定义为:每分钟产生1μmol对硝基苯所需酶量。
将酶反应体系置于25~75℃下进行酶促反应5 min。以酶活最高时的反应温度为最适反应温度作为100%参照酶活,做出相对酶活力随温度变化的曲线图,每组样品做3个平行样实验。
1.2.3pH对酶活影响将酶反应体系在pH 1.0~6.5条件的缓冲液中55℃进行酶促反应5 min。以酶活最高时的反应pH为最适反应温度,记为100%参照酶活,做出相对酶活力随pH值变化的曲线图。
1.2.4酶的热稳定性将纯酶液分别在室温、35、40、45℃的条件下保温20~60 min,加入底物pNPG进行酶促反应。以未保温酶液的酶活为100%参照酶活,做出在不同的温度下残余酶活力随着保温时间的延长而不断变化的曲线图。
1.2.5酶的酸碱稳定性将纯酶液于pH 2.0~8.5的缓冲液中,4℃保温12 h后进行酶促反应。以未处理的酶液的酶活为100%参照酶活,比较不同pH处理后的酶活的残余量。
1.2.6酶促动力学参数测定将纯酶液分别与0.25、0.50、1.00、1.50、2.00 mmol/L pNPG进行酶反应:55℃、pH 2.5、5 min。以灭活纯酶液作为空白组。测定动力学参数,根据米氏方程拟合出Km和Vmax值,并计算出kcat。
1.2.7质谱鉴定切下电泳胶上目标条带和空白胶(对照),加入100 mmol/L NH4HCO3/30%ACN脱色,清洗至透明。加100 mmo/L NH4HCO390μL,100 mmol/L DTT 10μL,56℃孵化30 min,还原蛋白质;去除上清液,加100%ACN 100μL,5 min后吸去;加100 mmol/L NH4HCO370μL,200 mmol/L IAA 30μL,室温避光处20min;去上清液后加入100 mmol/L NH4HCO3100μL,室温15 min;去上清液后加入100%ACN 100μL,5 min后吸去,冻干。冻干后,加入0.01 mg/mL胰蛋白酶5μl,置于4℃冰箱60 min;待胶块充分吸胀后加入25 mmol/L NH4HCO3(pH 7.8)30μL,37℃保温20 h。吸出酶解液移至新EP管中,在原管中加入60%ACN/0.1% TFA 100μL,超声15min,吸出溶液。将两次上清液合并后冻干。复溶,点样,进行质谱分析。
2 结果与讨论
2.1分离纯化
发酵所用黑曲霉菌株具有很好的耐酸性,在培养基初始pH值为5时,仍能正常产酶。通过乙醇沉淀和QHP离子交换层析后,以pNPG作为底物,检测到一个峰具有BGL酶活,该峰的SDS-PAGE结果见图1,该蛋白酶相对分子质量接近120 000。
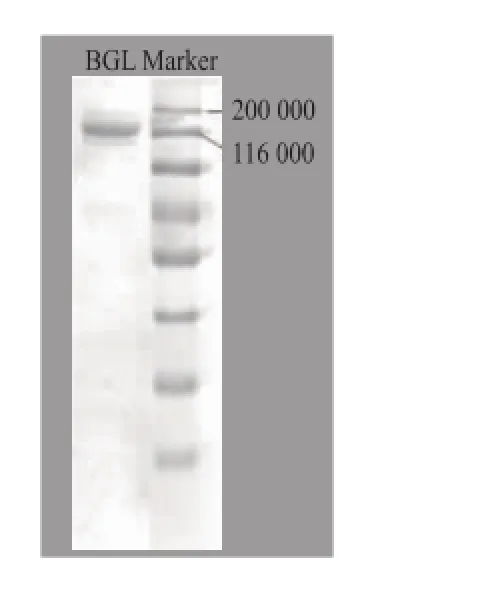
图1 纯化后BGL电泳图Fig.1 SDS-PAGE of purified BGL
2.2β-葡萄糖苷酶的酶学性质
2.2.1温度对酶活的影响如图2所示,在25~55℃范围内,随温度的升高,酶反应速度加快,55℃时酶活力达到最大。随着温度继续升高,酶活力降低,当温度达到75℃时酶活力基本为0。由此可见,BGL的最适反应温度为55℃。
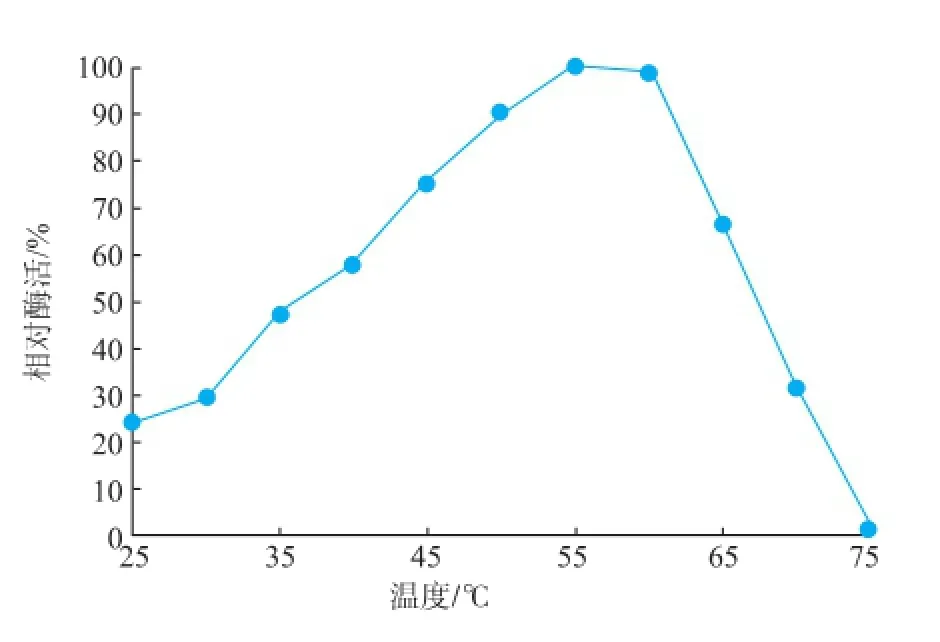
图2 温度对β-葡萄糖苷酶活性的影响Fig.2 Effectof tem perature on the purifiedβ-glucosidase
2.2.2pH对酶活的影响β-葡萄糖苷酶处于pH 2.0~4.0的时候,酶活力可达到80%以上,在pH 1.5以下以及pH 4.5以上的条件下,活性迅速降低。如图3所示,该酶的最适反应pH为2.0~2.5,具有良好的耐酸性。
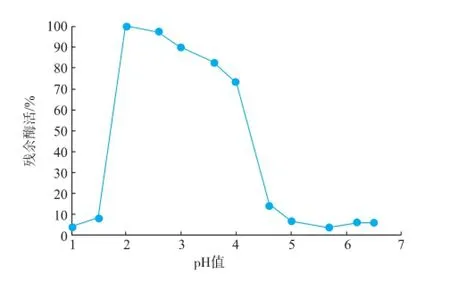
图3 pH值对β-葡萄糖苷酶活性的影响Fig.3 E ffect of pH on the purifiedβ-glucosidase
2.2.3酶的热稳定性图4表明,该酶的热稳定性较差,35℃以下保温1 h后酶活力基本不变,经过45℃处理1 h后仅能保留35%的酶活。
2.2.4酶的酸碱稳定性图5表明,该酶的稳定范围很广,在pH 2.0~7.5酶活力保持在90%以上,pH 7.5以上酶活力迅速降低。
2.2.5β-葡萄糖苷酶动力学参数在pH 2.5,55℃的反应条件下,β-葡萄糖苷酶水解pNPG的动力学参数见表1。
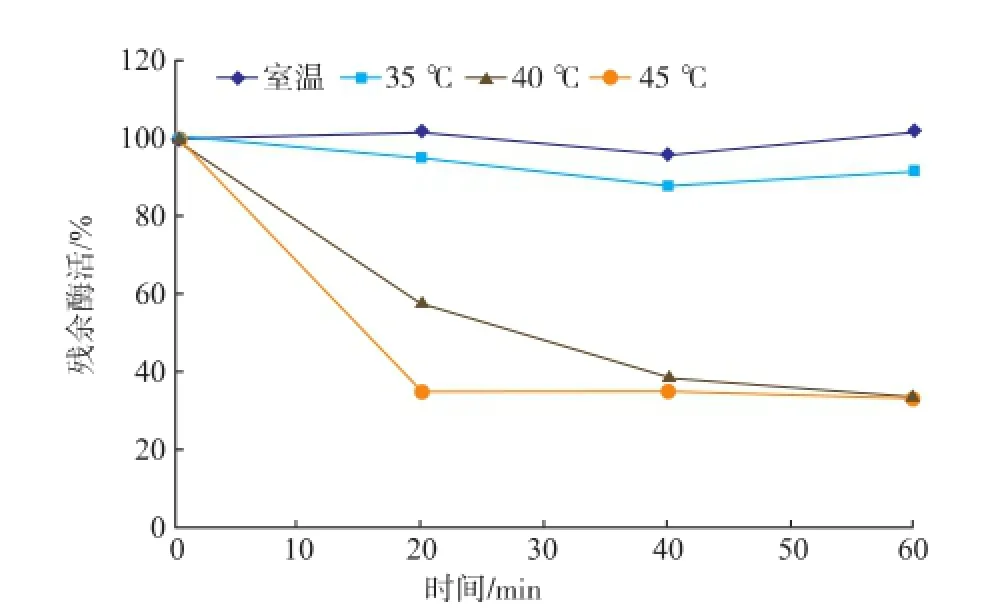
图4 β-葡萄糖苷酶的热稳定性Fig.4 Effect of tem perature on stability ofβ-glucosidase

图5 β-葡萄糖苷酶的酸碱稳定性Fig.5 Effect of pH on stability ofβ-glucosidase
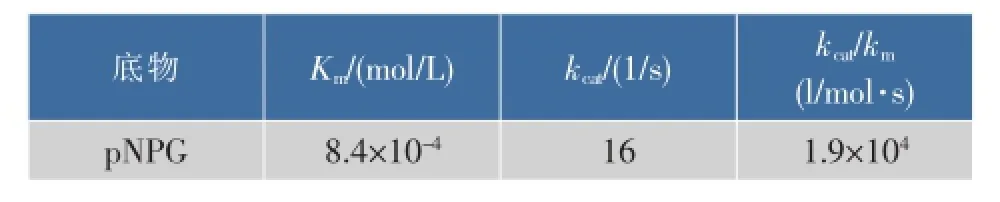
表1 β-葡萄糖苷酶的动力学参数Table 1 K inetic param eters ofβ-glucosidase
2.3质谱鉴定
使用Mascot算法在NCBI蛋白质数据库中收索到两个同源性高的蛋白质:gi78172198和 gi7009581,进一步验证分离出的是来源于黑曲霉的β-葡萄糖苷酶,结果见图6。
gi78172198(unpublished)是Yan等与2005年录入的氨基酸序列,和gi7009581(JBC,275:4973-4980,2000)都是860个氨基酸,相对分子质量约为93 000,序列比对发现两者同源性高达97.33%。文献[9]对gi7009581进行了基因克隆、测序、以及保守催化位点的鉴定,但并未对酶学性质进行详细的研究。
图6 质谱鉴定Fig.6 M ALDI-TOF/TOF analysis
3 结语
对黑曲霉发酵豆渣所产的β-葡萄糖苷酶的最适反应温度、最佳反应pH、热稳定性、酸碱稳定性等基本酶学性质进行了研究,最后确定了其动力学参数。以pNPG为底物,该酶的最适温度为55℃,最适pH为2.0~2.5。该酶在35℃及以下温度可以长时间保存,在pH 2.0~7.5环境中酶活力稳定。相对于目前报道的其他β-葡萄糖苷酶在pH 4~9中保持稳定,该酶所具的耐酸性能非常优越。不仅对理论研究具有重要意义,而且具有工业应用的潜在价值。
[1]Fang X,Shen Y,Zhao J,etal.Statusand prospectof lignocellulosic bioethanolproduction in China[J].Bioresour Technology,2010,101(13):4814-4819.
[2]Syrigos K N,Row linson-Busza G,Epenetos A A.In vitro cytotoxicity following specific activation of amygdalin by beta-glucosidase conjugated to a bladder cancer-associatedmonoclonal antibody[J].International Journal of Cancer,1998,78(6):712-719.
[3]Sternberg D,Vijayakumar P,Reese ET.beta-glucosidase:m icrobialproduction and effecton enzymatic hydrolysisof cellulose[J]. Canadian Journal of M icrobiology,1977,23(2):139-147.
[4]Liebig J,Wohler F.Ueber dieBildung des Bittermandelöls[J].Annalen der Pharmacie,1837,22(1):1-24.
[5]Sue M,Ishihara A,Iwamura H.Purification and characterization of abeta-glucosidase from rye(Secale cereale L.)seedlings[J]. Plant Science,2000,155(1):67-74.
[6]Iwashita K,Todoroki K,Kimura H,et al.Purification and characterization of extracellular and cellwall boundβ-glucosidases from Aspergillus kawachii[J].Bioscience,Biotechnology and Biochem istry,1998,62(10):1938-1946.
[7]朱龙宝,汤斌,陶玉贵等.黑曲霉β-葡萄糖苷酶基因克隆及在毕赤酵母中分泌表达[J].食品与生物技术学报,2012,31(9):973-977. ZHU Longbao,TANG Bin,TAO Yugui,etal.Cloning and secreting expression of theβ-glucosidase gene from Aspergillus niger in Pichia pastoris GS115[J].Journal of Food Science and Biotechnology,2012,31(9):973-977.(in Chinese)
[8]姚卫蓉,丁霄霖.pNPG法测定纤维素酶系中β-葡萄糖苷酶[J].微生物学通报,1998,25(3):182-183. YAOW,DING X.Determination ofβ-glucosidase activity of cellulalase by pNPGmethod[J].M icrobiology China,1998,25(3):182-183.(in Chinese)
[9]Dan S1,Marton I,Dekel M,et al.Cloning,expression,characterization,and nucleophile identification of family 3,Aspergillus nigerβ-glucosidase[J].The Journal of Biological Chem stry,2000,275(7):4973-4980.
会议信息
会议名称(中文):第八届中国工业生物技术发展高峰论坛
开始日期:2015-12-11结束日期:2015-12-12
所在城市:天津市和平区
具体地点:空港经济区滨海圣光皇冠假日酒店
主办单位:中国科学院科技促进发展局、中国生物工程学会
承办单位:中国科学院天津工业生物技术研究所、中国生物工程学会生物技术与生物产业信息工作委员会、中国生物工程学会生物产业促进工作委员会
联系人:吴崇明
联系电话:022-24828778,18618264714
传真:022-84861996
E-MAIL:biotech@tib.cas.cn
会议网站:http://www.cas.cn/xs/201509/t20150918_4426804.shtm l
会议背景介绍:“中国工业生物技术发展高峰论坛”是中国科学院原生命科学与生物技术局联合国家发改委高技术产业司、科技部中国生物技术发展中心、中国生物工程学会等部门共同精心打造的工业生物技术领域的品牌性年度论坛。自2007年起,在天津、湖州、青岛、成都等地已成功举办七届。论坛旨在为我国工业生物技术领域的专家、学者、金融界和企业界人士提供一个高水平的交流平台,增强工业生物技术集成创新能力与成果转化能力,推进我国工业生物技术的发展,为生物产业的发展提供新动力。“第八届中国工业生物技术发展高峰论坛”将于2015年12月11-12日(暂定)在天津举办。论坛拟以新思路、新概念重塑品牌,实现“定位准、有实效、有影响、有期盼”的目标。在“中国制造2025”已经出台和国家“十三五”规划即将发布的大背景下,本次论坛将邀请国际专家、国内管理专家、经济学家及行业领军企业做主旨报告,发布《中国工业生物技术白皮书》,组织“技术与政策”、“技术与金融”、“技术与装备”及“技术与前沿”四大板块讨论,还将举行“创新·创业”——新工业企业自强发展分论坛、“分子·细胞·系统”——新生物学研究热点与难点分论坛和“e+时代·依势带”——工业生物技术产业互联网+分论坛等三个分论坛活动。论坛组委会将树立“从简、务实”会风,采取多种组织形式,加强互动交流,力争办成一届有新意、有成效的论坛。
Purification and Characterization of β-Glucosidase from Aspergillus niger
LIU Zhongmei,XIEMengyuan,ZHOU Zhemin*
(Schoolof Biotechnology,Jiangnan University,Wuxi214122,China)
Cellulose is one of the most popular-used biomass resource and widely applied in the bioethanol production,medicine,and food industry.Theβ-glucosidase(BGL)is of interest as the key enzyme in conversion of cellulose to glucose.In this study,glucosidase from Aspergillus niger in bean dregs broth was purified and characterized.The optimum temperature was 55℃,and the optimum pH was 2.0~2.5.BGL was stable at pH 2.0~7.5,The Kmvalue was 8.4×10-4mmol/L,the kcatvaluewas16 s-1and the catalytic efficiency(kcat/Km)was 1.92×104L/(mmol·s)in the optimum condition.This study could promote the theoretical research and the production and application of BGL.
β-glucosidase,pnitrophenylβ-D-glucopyranoside,purification,enzymatic properties
Q 55
A
1673—1689(2015)11—1198—05
2014-07-12
教育部留学回国人员科研启动基金项目(第47批);江南大学自主科研青年基金项目(JUSRP1001)。
刘中美(1978—),女,山东蓬莱人,理学博士,副教授,主要从事生物酶学与蛋白质工程方面的研究。E-mail:zliu@jiangnan.edu.cn
周哲敏(1969—),男,河北石家庄人,工学博士,教授,博士研究生导师,主要从事生物酶学与酶工程方面的研究。
E-mail:zhmzhou@jiangnan.edu.cn
