棘孢青霉菌发酵产右旋糖酐酶的条件优化
2015-10-29曹研研张洪斌李若菡
曹研研,张洪斌*,李若菡,刘 昆
(合肥工业大学医学工程学院,安徽 合肥 230009)
棘孢青霉菌发酵产右旋糖酐酶的条件优化
曹研研,张洪斌*,李若菡,刘昆
(合肥工业大学医学工程学院,安徽 合肥230009)
为优化棘孢青霉菌F1001产右旋糖酐酶的发酵条件,以培养基装载量、蛋白胨和右旋糖酐T70添加量为主要影响因素,结合其他发酵条件,在单因素试验的基础上,运用Box-Behnken试验设计原理,探讨培养基装载量、蛋白胨和右旋糖酐T70添加量的最佳组合。结果表明,蛋白胨添加量3 g/L、右旋糖酐T70添加量14 g/L、培养基装载量85 mL/250 mL,右旋糖酐酶活力最高可达到453 U/mL,比优化前提高88%。通过测定发酵过程中酶活力、pH值、蛋白质含量的变化,进一步验证发酵84 h酶活力达到最大,此时蛋白质含量达到最高,pH值达到3.9。
棘孢青霉;右旋糖酐酶;响应面分析;发酵条件
功能性低聚糖一般是由2~10 个单糖通过糖苷键连接起来形成直链或者支链的一类糖,它们常被作为益生元调整肠道菌群结构和调节肠道功能[1-2]。右旋糖酐酶能够催化葡聚糖中的α-1,6糖苷键断裂,释放出异麦芽糖,异麦芽三糖等功能性低聚异麦芽糖[3]。而低聚异麦芽糖常作为益生元被应用于食品工业[4],因此高酶活力的右旋糖酐酶制备功能性低聚糖逐渐成为一种新的发展趋势。右旋糖酐酶作为生物催化剂,反应条件温和且无污染,在制糖工业等过程中起到重要作用。右旋糖酐酶能减少甚至避免右旋糖酐带来的经济问题,可改善糖产品的滤过性、设备平滑性、增加糖的回收率、降低产品的黏度[5]。此外,右旋糖酐酶还广泛应用于医药、化工等多个行业[6-9]。
根据酶的作用位点和作用方式的不同,把右旋糖酐酶分为内切右旋糖酐酶(endodextranases,EC3.2.1.11)和外切右旋糖酐酶(exodextranases EC3.2.1.70)。内切右旋糖酐酶是随机攻击右旋糖酐内部α-1,6糖苷键,产生小糖且效率较高。外切右旋糖酐酶是从大分子右旋糖酐的非还原端依次降解。右旋糖酐酶是一种诱导酶,右旋糖酐以及改良后的酮基右旋糖常作为诱导物[10]。
右旋糖酐酶在自然界中分布比较广泛,在微生物、动物、人体组织以及燕窝胚芽鞘中都有发现[11-12]。然而人们对细菌、酵母菌、霉菌等[13-15]微生物产右旋糖酐酶的研究较多。一般霉菌所产的右旋糖酐酶是胞外内切右旋糖酐酶,且比细菌和酵母菌产的右旋糖酐酶活力略高[16-17]。早在20世纪70年代,国外学者就开始研究真菌产右旋糖酐酶,Chaiet等[18]报道绳状青霉能够产生内切右旋糖酐酶,90年代国内最早由孙晋武等[19]筛选出淡紫拟青霉和焦曲霉产生右旋糖酐酶。尽管近年来对霉菌产右旋糖酐酶研究的较多,但是酶活力并不理想。朱慧霞等[20]研究的绳状青霉菌发酵产右旋糖酐酶活力仅为18.963 U/mL,Mohamed等[21]报道的一株青霉-258产生的右旋糖酐酶活力为41.8 U/mL。这样的酶活力在工业应用中会带来产物分布不均匀、杂质较多、产品分离困难等问题。由于酶活力并不理想使大工业产酶受到限制,因此提高右旋糖酐酶活力具有重要研究和应用价值。本实验室从土壤中筛选出F1001菌,并通过形态特征和ITS rDNA序列分析方法鉴定菌株[22],对该菌株产右旋糖酐酶做了一些初步探索。本实验在单因素试验结果基础上运用响应面分析优化的方法详细探索了棘孢青霉菌F1001产右旋糖酐酶最优发酵条件,以期获得最高酶活力。
1 材料与方法
1.1材料与试剂
棘孢青霉菌(Penicillium aculeatum)F1001由合肥工业大学医学工程学院制药工程系筛选得到,4 ℃平板保存。右旋糖酐T70由本实验室制备,烘干后常温保存。
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)和考马斯亮蓝G250由实验室自行配制,常温避光保存。
1.2培养基
PDA培养基:马铃薯20 g/L、葡萄糖2 g/L、琼脂20 g/L,自然pH值,0.1 MPa灭菌20 min。
发酵培养基:右旋糖酐T70 15 g/L、蛋白胨5 g/L、MgSO4·7H2O 0.5 g/L、KCl 0.5 g/L、K2HPO4·3H2O 1 g/L、FeSO4·7H2O 0.01 g/L,pH 5.5,0.1 MPa灭菌20 min。
1.3培养方法
1.3.1斜面活化培养方法
挑菌在斜面上划线,在28 ℃的培养箱中培养84 h。
1.3.2摇瓶发酵培养方法
从斜面上挑菌接入发酵培养基中,揺瓶培养。培养条件为:250 mL锥形瓶装入80 mL培养基,在200 r/min、28 ℃条件下培养72 h。
1.3.3分析测定方法
右旋糖酐酶活力测定采用还原糖测定方法——DNS法[23]:发酵液在4 ℃、8 000 r/min离心5 min,取上清液,稀释一定的倍数,调水浴锅至35 ℃。将4 mL 0.02 mol/L pH 5.0的醋酸盐缓冲液配制的30 g/L右旋糖酐T70溶液置于35 ℃保温10 min,取1 mL稀释的酶液加入。保温1 h后取样500 μL,加入DNS 375 μL,沸水煮沸5 min,冷却至室温定容至终体积5.375 mL。以灭活的酶液作为对照,每分钟产生1 μmol还原糖所需的酶量定义为一个酶活力单位(U)。
蛋白质含量的测定采用Bradford法[24],即采用考马斯亮蓝G250与稀释一定倍数的发酵液在常温下反应5 min后,在595 nm波长处测定吸光度。
发酵过程中pH值采用pH计测量:在最优条件下发酵棘孢青霉,每12 h取样一次,用标准溶液调节好的pH计进行测定。
1.4发酵培养条件的优化
1.4.1单因素试验
单因素试验考察碳源、氮源、初始pH值等单因素对棘孢青霉F1001产右旋糖酐酶的影响。其他发酵条件不变,培养基的装载量为80 mL/250 mL。碳源质量浓度为10 g/L,加入5 g/L右旋糖酐作为诱导物。所选碳源包括:果糖、蔗糖、麦芽糖、乳糖、葡萄糖、右旋糖酐T70、右旋糖酐T40、右旋糖酐T500。氮源包括有机氮源和无机氮源,有机氮源含有丰富的天然氨基酸有利于菌体的生长代谢,而无机氮源更容易被菌体利用,因此考察有机氮源和无机氮源联合使用对棘孢青霉菌产酶的情况很有必要。本试验选用蛋白胨、胰蛋白胨、酵母浸膏、牛肉膏4 种有机氮源,加入培养基的质量浓度为5 g/L,无机氮源包括(NH4)2SO4、NH4NO3、NaNO3、NH4Cl、尿素,加入培养基的质量浓度为10 g/L。所选用的初始pH值为4.5、5.0、5.5、6.0、6.5、7.0。
1.4.2响应面试验设计
1.4.2.1 Plackett-Burman试验设计
在单因素试验结果的基础上以及各种发酵条件中对右旋糖酐T70、蛋白胨和NaNO3的添加量以及培养基装载量、初始pH值、发酵温度、接种量和发酵时间8 个因素进行八因素二水平的Plackett-Burman试验设计,选用N=12的试验设计,找出影响其产酶的重要因素,做两组平行试验取平均值。
1.4.2.2最陡爬坡试验
根据Plackett-Burman试验结果,找出重要因素。把拟合出的方程相关系数作为爬坡方向和步长变化的依据。然后进行最陡爬坡试验,找到接近最大响应区域的中心组合点。
1.4.2.3中心组合试验设计与响应面分析方法
根据最陡爬坡试验的结果,对培养基装载量、右旋糖酐T70和蛋白胨添加量进行中心组合试验。以右旋糖酐酶酶活力为响应值,设计三因素三水平试验,试验次数N=15的响应面分析试验。其中12 个为析因点,3 个为零点,零点试验进行3 次,以估计误差。做两组平行试验,试验结果取3 次试验的平均值。用统计软件Design-Expert 8.0.6对试验进行回归分析,其中回归系数的显著性用t检验评价,回归方程的显著性用F检验评价,方程的拟合程度由相关性系数R2决定。
1.5验证实验
对响应面分析方法得出的模型进行验证,做两组平行试验取平均值。发酵条件为:NaNO3添加量3 g/L、蛋白胨添加量3 g/L、右旋糖酐T70添加量14 g/L,其他培养基成分不变,pH 4.5,棘孢青霉菌按照体积分数2%接入装85 mL/250 mL培养基中,在200 r/min、28 ℃条件下培养84 h。在此发酵过程中,分别对发酵液的pH值、上清液的右旋糖酐酶活力以及蛋白质含量的变化进行探究,找出有利于产酶的一般规律。
2 结果与分析
2.1单因素试验筛选最适碳源、氮源、初始pH值
2.1.1最适碳源的筛选
本实验选取8 种不同碳源,分别是果糖、蔗糖、麦芽糖、乳糖、葡萄糖、右旋糖酐T70、右旋糖酐T40、右旋糖酐T500,质量浓度均为10 g/L。图1是各种碳源对棘孢青霉菌产右旋糖酐酶的结果。其中右旋糖酐T70、右旋糖酐T500为碳源时酶活力较高,酶活力分别为240.8 U/mL和259.1 U/mL,考虑到大分子右旋糖酐不易溶于水,所以选用右旋糖酐T70。

图1 碳源对棘孢青霉菌产右旋糖酐酶活力的影响Fig.1 Effect of carbon sources on the activity of dextranase
2.1.2最适氮源的筛选
关于最佳氮源的筛选,首先筛选出最佳有机氮源,然后筛选出最佳无机氮源。利用有机氮源含有丰富的氨基酸和无机氮源容易被菌体利用的原则,找出两类氮源对棘孢青霉菌产右旋糖酐酶最佳配比。图2所示为最佳有机氮源和无机氮源分别为蛋白胨和NaNO3。二者单独作为氮源时,酶活力均达到230 U/mL以上。二者共同作为氮源时,酶活力明显提高,因此把蛋白胨和NaNO3作为影响因素列入Plackett-Burman试验设计中进行下一步考察。

图2 氮源对棘孢青霉菌产右旋糖酐酶活力的影响Fig.2 Effect of nitrogen sources on the activity of dextranase
2.1.3初始pH值的选择
配制初始pH值分别为4.5、5.0、5.5、6.0、6.5、7.0的培养基,其他成分按照1.2节所述配制。结果如图3所示,pH 4.5时,棘孢青霉菌产右旋糖酐酶活力最高,随着pH值的增加,酶活力降低。当培养基溶液偏于中性时,酶活力几乎为0 U/mL。

图3 初始pH值对产右旋糖酐酶的影响Fig.3 Effect of initial pH on dextranase production
2.2Plackett-Burman试验设计筛选重要影响因素
根据棘孢青霉菌所需营养的基本原则和发酵条件影响因素的一般规律,选取8 个因素进行试验,每个因素有低水平和高水平,原始条件是高低水平的中间位置,试验次数N=12。Plackett-Burman试验设计结果见表1。

表1 Plackett-Burman试验设计及结果Table 1 Plackett-Burman design with experimental results

表2 Plackett-Burman试验设计各因素水平效应评价Table 2 Evaluation of the effects of factors at two different levels in Plackett-Burman design ign
采用响应面法[25]对发酵条件中主效应分析结果见表2,经过分析检验,得到可信度>95%的3 个因素为:培养基装载量、右旋糖酐T70添加量和蛋白胨添加量。
2.3最陡爬坡试验
根据Plackett-Burman试验结果分析,可以看出培养基装载量、右旋糖酐T70添加量和蛋白胨添加量对棘孢青霉产右旋糖酐酶有显著影响。其他因素对产酶情况的影响不显著,因此在下一步对培养基的优化中不予考虑。由回归方程的各项系数可知,培养基装载量(X1)前面的系数为正值,蛋白胨添加量(X3)和右旋糖酐T70添加量(X6)系数为负值,这表明增大培养基装载量,降低蛋白胨添加量和右旋糖酐T70添加量对产右旋糖酐酶有利。因此,对培养基装载量、右旋糖酐T70添加量和蛋白胨添加量这3 个因素进行最陡爬坡试验[26]。试验设计如表3所示,两组平行试验,结果取3 次平均值。由试验结果可知,3号试验的酶活力最高,3号试验中,培养基装载量为85 mL/250 mL,所以3号试验的各种条件接近于中心组合试验的中心点。

表3 最陡爬坡试验设计与结果Table 3 Steepest ascent design with experimental results
2.4Box-Behnken试验设计和结果分析
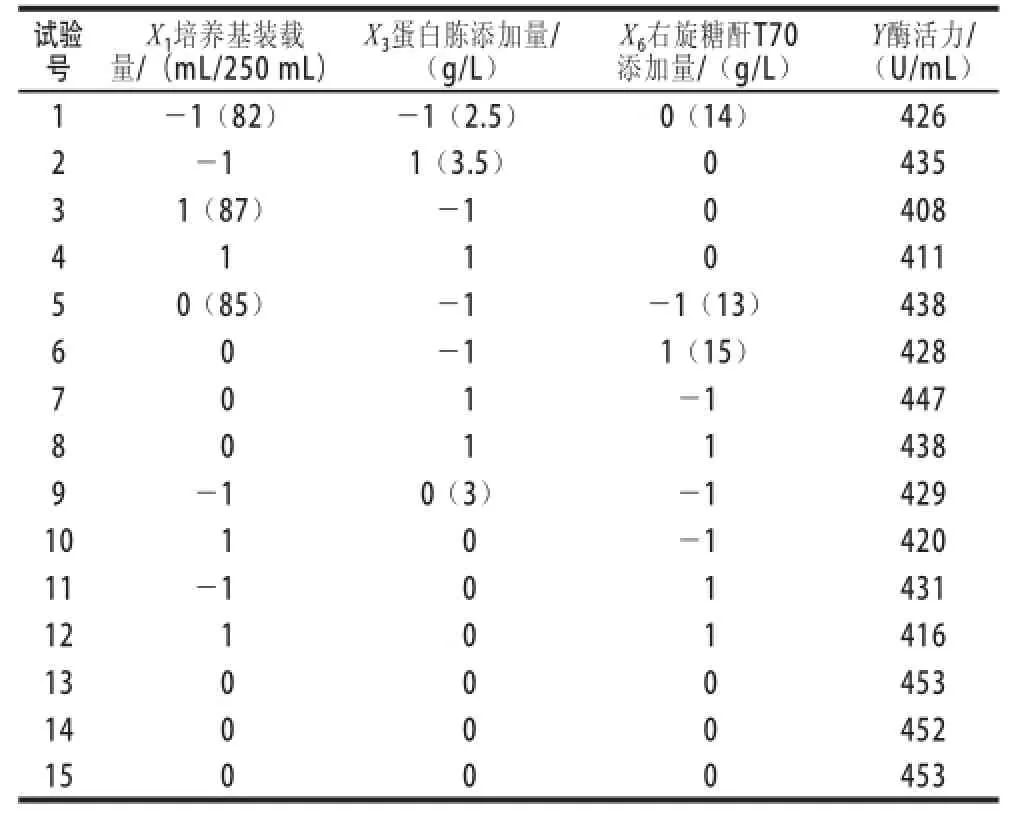
表4 Box-Behnken试验设计与结果Table 4 Box-Behnken design with experimental results
对Box-Behnken试验设计与结果见表4,结果分析见表5,同时拟合出一个二次多项式方程:
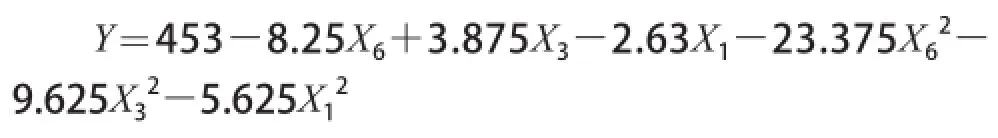
该方程表明了培养基装载量、蛋白胨添加量和右旋糖酐T70添加量与右旋糖酐酶活力的关系。回归方程的决定系数R2为0.983 5,离回归标准差0.286 2,表明该回归方程的拟合度较好。
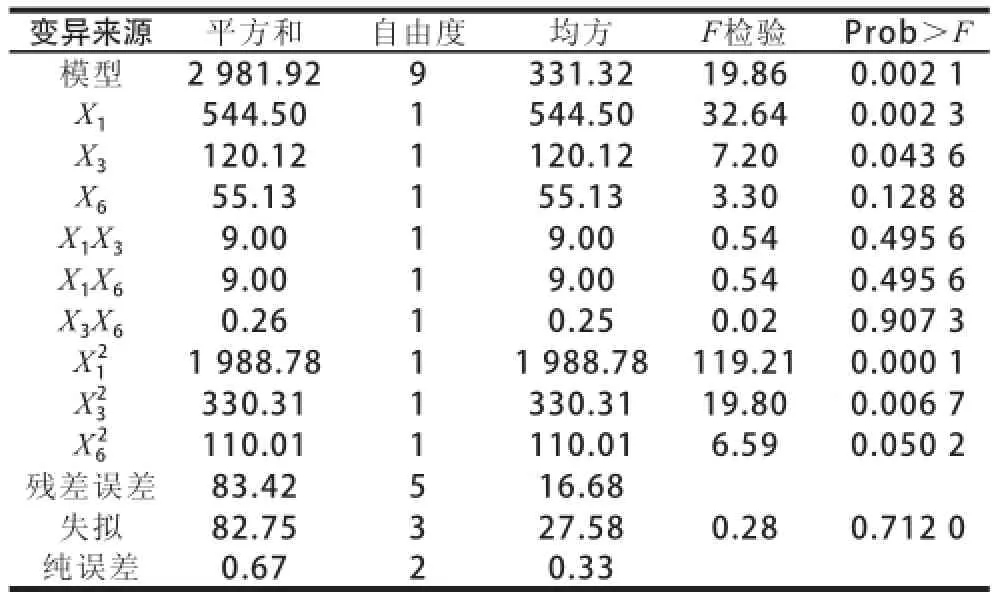
表5 响应面回归方程分析Table 5 Analysis of variance (ANOVA) for the response surface quadratic model
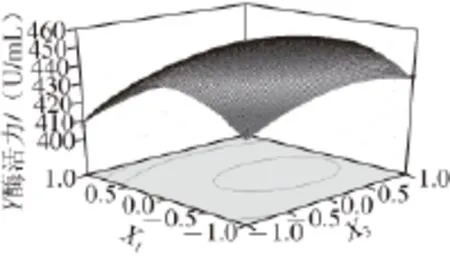
图4 培养基装载量和蛋白胨添加量的交互作用对产右旋糖酐酶的影响Fig.4 Effect of medium volume and peptone content on dextranase production

图5 培养基装载量和右旋糖酐T70添加量的交互作用对产右旋糖酐酶的影响Fig.5 Effect of culture volume and dextran T70 content on dextranase production

图6 右旋糖酐T70添加量和蛋白胨添加量的交互作用对产右旋糖酐酶的影响Fig.6 Effect of dextran T70 content and peptone content on dextranase production
图4~6为响应面立体分析图,从图中可直观地看出各因子对响应者的变化趋势,且回归模型存在最大值,稳定点(X1、X3、X6)的代码值为(0、0、0),对应的实际值为培养基的装载量为85 mL/250 mL、蛋白胨添加量为3 g/L、右旋糖酐T70添加量为14 g/L,其达到的酶活力最大值为453 U/mL。通过对最优产酶发酵条件的模型进行验证,进行3 次验证实验,结果产酶量分别为454、452、450 U/mL,平均值452 U/mL,与模型的预测值基本一致,因此该模型能够较好地预测实际产右旋糖酐酶情况。而发酵条件未优化前测得的右旋糖酐酶活力为240.8 U/mL,因此优化后右旋糖酐酶的活力比未优化的酶活力提高了88%。
2.5产酶培养基相关参数的变化
发酵过程中每12 h取样一次,144 h结束发酵,分别测发酵液的pH值、上清液的右旋糖酐酶活力以及蛋白质含量。每组实验有两组平行对照,取3 组实验的平均值。结果见图7。
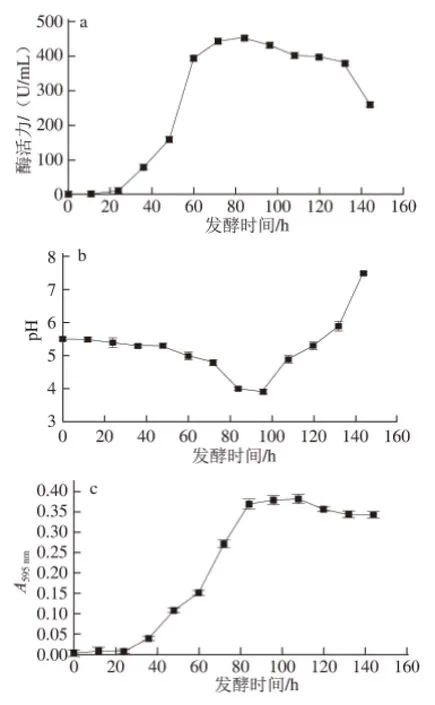
图7 产酶培养基发酵过程中相关参数的变化Fig.7 Changes in parameters related to dextranase production during fermentation
由图7a可知,第24小时开始检测到右旋糖酐酶活力,36~72 h期间,酶活力呈线性增长, 72~84 h时,酶活力增长趋势处于平稳状态,84 h时酶活力达到最高值453 U/mL,此后酶活力开始下降。由图7b可知,发酵开始时pH值由初始的5.5逐渐降低直至96 h时pH值降至最低,随着发酵的继续pH值又呈现上升趋势,144 h后pH值开始呈碱性。由图7c可知,蛋白质含量随着时间的变化逐渐增大至84 h后蛋白质含量波动较小,发酵液上清稀释5 倍后通过吸光度表现出来。发酵产酶过程中,酶活力、pH值、蛋白质含量均是不断变化的,三者之间也有着复杂的关系。验证了在84 h时酶活力达到最高,此时发酵液的pH值为3.9,蛋白质含量最高。
3 结 论
本实验用响应面分析对右旋糖酐酶产生菌棘孢青霉F1001发酵条件进行优化,取得了较好的效果。根据响应面结果分析,最佳产酶条件为:当培养基装载量为250 mL锥形瓶装85 mL培养基、蛋白胨添加量为3 g/L、右旋糖酐T70添加量为14 g/L,右旋糖酐酶酶活力模型值最大可达到453 U/mL。在优化后的条件下摇瓶发酵产右旋糖酐酶平均值为452 U/mL与模型预测值接近,发酵产酶比优化前提高了88%。通过测定发酵过程中酶活力、pH值、蛋白质含量的变化,进一步验证发酵84 h酶活力达到最大,此时蛋白含量达到最高,pH值为3.9。
[1]王东辉. 功能性低聚糖生理特性及开发应用[J]. 山西食品工业,2004(1): 11-14.
[2]陈渝, 王娟, 钟倩霞, 等. 功能性低聚糖益生元的保健功能及开发[J].广州食品工业科技, 2004, 20(增刊1): 99-101.
[3]WU Dingtao, ZHANG Hongbin, HUANG Lijun, et al. Purification and characterization of extracellular dextranase from a novel producer,Hypocrea lixii F1002, and its use in oligodextran production[J]. Process Biochemistry, 2011, 46(10): 1942-1950.
[4]GOULAS A K, COOPER J M, GRANDISON A S, et al. Synthesis of isomaltooligosaccharides and oligodextrans in a recycle membrane bioreactor by the combined use of dextransucrase and dextranase[J]. Biotechnology and Bioengineering, 2004, 88(6): 778-787.
[5]EFRA.N R J. Dextranase in sugar industry: a review[J]. Sugar Technology, 2009, 11(2): 124-134.
[6]李良铸, 李明晔. 最新生化药物制备技术[M]. 北京: 中国医药科技出版社, 2003: 299-301.
[7]YOSHIDA H, FUJITA K, KUDO K. Fabrication of hard dextran DEAE: adsorption equilibria of BSA[J]. Adsorption-Journal of the International Adsorption Society, 1999, 5(1): 63-71.
[8]NIKOLIĆ G S, CAKIĆ M, MITIĆ Ž, et al. Deconvoluted Fouriertransform LNT-IR study of coordination copper (II) compounds with dextran derivatives[J]. Russian Journal of Coordination Chemistry,2008, 34(5): 322-328.
[9]STAAT R H, SCHACHTELE C F. Characterization of a dextranase produced by an oral strain of Actinomyces israelii[J]. Injection and Immunity, 1975, 12(3): 556-563.
[10] 程秀兰, 孙晋武, 杨敬, 等. 淡紫拟青霉右旋糖酐酶的形成条件[J].微生物学报, 1992, l32(5): 334-339.
[11] HEVN A N J. Dextranase activity and auxin-induced cell elongation in coleoptiles of Avena[J]. Biochemical and Biophysical Research Communications, 1970, 38: 831-837.
[12] HEVN A N J. Molecular basis of auxin-regulated extension growth and role of dextranase[J]. Proceeding of the National Academy of Sciences of the United States of America, 1981, 78: 6608-6612.
[13] DECKER S R, ADNEY W S, VINZANT T B, et al. Alkaline tolerant dextranase from Streptomyces anulatus: U.S. Patent 6509184[P]. 2003.
[14] KIM Y M, KIM D. Characterization of novel thermostable dextranase from Thermotoga lettingae TMO[J]. Journal of Applied Microbiology and Biotechnology, 2010, 85: 581-587.
[15] MILLSON S H, EVANS I H. Multiple dextranases from the yeast Lipomyces starkeyi[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 2007, 92(4):399-404.
[16] 吴定涛. 高产右旋糖酐酶菌株的筛选及酶学性质和酶的应用研究[D].合肥: 合肥工业大学, 2011.
[17] ELVIRA K, PETRI S, TIMO K. Microbial dextran-hydrolyzing enzymes: fundamentals and applications[J]. Microbiology and Molecular Biology Reviews, 2005, 69(2): 306-325.
[18] CHAIET L, KEMPF A J, HARMAN R, et al. Isolation of a pure dextranase from Penicillium funiculosum[J]. Applied Microbiology and Biotechnology, 1970, 20(3): 421-426.
[19] 孙晋武, 程秀兰, 严自正, 等. 右旋糖酐酶产生菌的筛选及其酶学性质的比较研究[J]. 微生物学报, 1988, 28(1): 45-55.
[20] 朱慧霞, 王雅洁, 姚日生, 等. 绳状青霉菌发酵产右旋糖酐酶的条件研究[J]. 食品科学, 2010, 31(19): 288-291.
[21] MOHAMED A A N, ISMAIL A M S, AZZA M A F, et al. Preparation and some properties of immobilized Penicillium funiculosum 258 dextranase[J]. Process Biochemistry, 1999, 34(4): 391-398.
[22] 张洪斌, 吴定涛, 黄丽君, 等. 一株产右旋糖酐酶青霉的分离及酶的纯化和性质[J]. 微生物学报, 2011, 51(4): 495-593.
[23] EGGLESTON G, MONGE A. Optimization of sugarcane factory application of commercial dextranases[J]. Process Biochemistry, 2005,40: 1881-1894.
[24] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[25] 郝学财, 余小斌, 刘志钰, 等. 响应面方法在优化微生物培养基中的应用[J]. 食品研究与开发, 2006, 27(1): 38-41.
[26] 刘够生, 石磊, 于建国, 等. 基于响应面的泔水样培养单细胞蛋白培养基的优化[J]. 食品与发酵工业, 2003, 29(10): 15-18.
Optimization of Fermentation Conditions for Dextranase Production by Penicillium aculeatum
CAO Yanyan, ZHANG Hongbin*, LI Ruohan, LIU Kun
(School of Medical Engineering, Hefei University of Technology, Hefei230009, China)
The fermentation conditions for dextranase production by Penicillium aculeatum F1001 were optimized using a Box-Behnken design with response surface methodology. The optimal fermentation conditions were determined as follows: peptone 3 g/L, dextran T70 14 g/L, and medium loading, 85 mL in a 250-mL flask. Under these conditions,dextranase activity was 453 U/mL, indicating an 88% improvement over that before optimization. The changes in dextranase activity, pH and protein content during the fermentation process verified that dextranase activity reached its highest level at 84 h, when the pH was 3.9.
Penicillium aculeatum; dextranase; response surface analysis; fermentation conditions
Q815
A
1002-6630(2015)23-0215-06
10.7506/spkx1002-6630-201523040
2015-01-14
安徽省自主创新专项(合肥工业大学2013秋实计划)(2013AKKG0391);省级大学生创新训练计划项目(2015CXCYS093)
曹研研(1990—),女,硕士研究生,研究方向为生物制药与酶工程。E-mail:caoyan168@126.com
张洪斌(1970—),男,教授,博士,研究方向为生物制药与酶工程。E-mail:zhb5678@163.com
