硫酸酯化修饰的油菜花粉多糖的抗氧化活性
2015-10-29姚秋萍
姚秋萍,李 阳,邓 健
(贵州民族大学化学与环境科学学院,贵州 贵阳 550025)
硫酸酯化修饰的油菜花粉多糖的抗氧化活性
姚秋萍,李阳,邓健
(贵州民族大学化学与环境科学学院,贵州 贵阳 550025)
目的:对油菜花粉多糖进行硫酸酯化,研究体外抗氧化活性。方法:采用浓硫酸法分别在0 ℃和10 ℃条件下对油菜花粉多糖(rape pollen polysaccharides,RPP)进行硫酸酯化修饰,并对其清除羟自由基(·OH)、超氧阴离子自由基(O2-·)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的能力进行了研究。结果:酯化得到取代度分别为0.89和1.36的2 个改性产物(S-RPP1和S-RPP2),RPP、S-RPP1和S-RPP2表现出不同程度的抗氧化活性。总的自由基清除能力大小为S-RPP1>S-RPP2>RPP。结论:硫酸化修饰能提高油菜花粉多糖的体外抗氧化活性。
油菜花粉多糖;硫酸酯化修饰;抗氧化活性
花粉含有丰富的营养物质,是一种较为新型的食品资源,并且蜜蜂采集的花粉所含的营养素更为丰富[1],因此,蜂花粉被誉为“最完全的营养食品”、“浓缩的营养库”[2]。多糖是油菜花粉的主要有效成分之一。药理研究表明,油菜花粉多糖具有抗肿瘤、抗衰老、抗氧化和抑菌等作用[3-6]。硫酸酯化多糖(sulfated polysachcarides,SPS)是指含有硫酸基团的天然及其半合成的酸性多糖,为聚阴离子化合物。多糖经硫酸酯化的结构修饰后,构象发生了变化,而构象变化往往是生物活性变化的决定因素[7]。多糖经硫酸酯化后,很多生物活性得到显著提高,多糖硫酸酯作为一种新型药物具有很多优势,如具有良好的抗病毒、增强免疫、抗肿瘤、抗凝血等重要作用。硫酸化香菇多糖能增强鸡新城疫(newcastle disease,ND)疫苗的免疫作用[8]。硫酸化枸杞多糖均能显著提高鸡胚成纤维细胞的抗新城疫病毒感染能力,且与硫酸基取代度有关[9]。硫酸酯化猪苓多糖可增强对羟自由基(·OH)的清除能力,并呈明显量效关系[10]。硫酸酯化马尾松花粉多糖能抑制体内外肿瘤细胞,促进T、B细胞增殖[11],并可以抑制G2/M期人类肝癌HepG2细胞的生长[12]。取代度范围为0.68~1.91的6 种硫酸酯化当归多糖中,取代度为1.91硫酸酯化当归多糖不仅能抑制病毒增殖,而且可以提高免疫功能[13]。本研究对油菜花粉多糖进行硫酸酯化修饰,并对其抗氧化活性进行深入系统的研究,旨在解决油菜花粉在保键食品方面的关键节点问题,扩大油菜花粉在食品工业中的应用范围。
1 材料与方法
1.1材料与试剂
油菜花粉多糖(rape pollen polysaccharides,RPP),贵州民族大学化学与环境科学学院药物与化学实验室自制,纯度为74.86%。
MD34型透析袋(截留分子质量8 000~14 000 D,进口分装);氯仿、浓硫酸、浓盐酸、正丁醇、NaOH、无水乙醇、95%乙醇、丙酮、乙醚、硫酸铵、硫酸钾、三氯乙酸、BaCl2、明胶、抗坏血酸、焦性没食子酸、三(羟甲基)氨基甲烷、硫酸亚铁、水杨酸、无水乙醇、过氧化氢、浓盐酸等均为分析纯。
1.2仪器与设备
电子分析天平、756PC紫外分光光度计 上海舜宇恒平科学仪器有限公司;HH-6数显恒温水浴锅 常州博远实验分析仪器厂;傅里叶Nicolet6700型红外光谱仪上海莱睿科学仪器有限公司。
1.3方法
1.3.1硫酸酯化油菜花粉多糖的制备[14]
取浓硫酸7.5 mL、正丁醇2.5 mL,置于装有冷凝管和搅拌装置的干燥三颈瓶中,再加入0.130 g硫酸铵,磁力搅拌并冰浴冷却至0 ℃,缓慢加入油菜花粉多糖0.5 g,分别在0 ℃和10 ℃反应30 min,反应液经预冷至0 ℃的4 mol/L NaOH溶液中和至pH 7,移入透析袋,流水透析2 d、蒸馏水透析1 d。透析液离心,上清液冷冻干燥,即得硫酸酯化油菜花粉多糖S-RPP1和S-RPP2。
1.3.2硫酸基含量的测定[15]
1.3.2.1标准曲线的绘制
精确称取105 ℃干燥至恒质量的K2SO4217.5 mg,用1 mol/L的HCl溶液定容至50 mL,得硫酸根标准溶液。准确吸取K2SO4标准溶液0.08、0.16、0.24、0.32、0.40 mL,分别以1 mol/L的HCl溶液补至0.40 mL,以0.40 mL HCl溶液作为空白,加入质量分数为3%的三氯乙酸7.6 mL和质量分数为0.2%的BaCl2-明胶溶液2.0 mL,摇匀,室温静置15 min,于360 nm波长处测定吸光度(A1);再以相同体积的质量分数为0.5%明胶溶液代替BaCl2-明胶溶液,依上法操作,于360 nm波长处测定吸光度(A2)。以硫酸根含量为横坐标,A1-A2为纵坐标,绘制标准曲线,得到回归方程为y=0.004 4x+0.028 7(R2=0.994 4)。
1.3.2.2样品中硫酸根含量的测定
精密称取硫酸酯化油菜花粉多糖样品各20 mg,振摇于2 mL的1 mol/L盐酸中。移至具塞试管中密封好,待完全溶解后置于沸水浴中1 h。取0.2 mL反应液进行分析,按照制作标准曲线的方法,测定其吸光度(A1)。
根据标准曲线得到试样中SO42-的百分含量,硫酸酯化油菜花粉多糖的取代度(degree of substitution,DS)计算公式如下。

式中:C为试样中硫酸根含量/%。
1.3.3紫外光谱分析
在200~400 nm波长范围内进行紫外光谱扫描。
1.3.4红外光谱分析
采用KBr压片法。波数范围为4 000~400 cm-1,仪器分辨率为0.5 cm-1,灵敏度为90,扫描次数为32/64。
1.3.5对·OH的清除作用测定[16]
在具塞试管中依次加入9 mmol/L FeSO4溶液1 mL、9 mmol/L水杨酸-乙醇溶液1 mL、不同浓度的样品溶液1 mL和6 mol/L H2O2溶液1 mL,摇匀,37 ℃恒温水浴0.5 h,以蒸馏水为参比,于510 nm波长处测定其吸光度。·OH清除率计算公式如下。
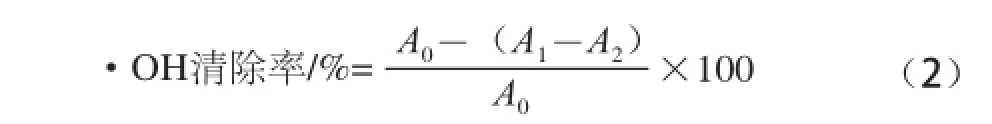
式中:A0为空白对照液的吸光度;A1为加入多糖溶液后的吸光度;A2为不加显色剂H2O2多糖溶液本底的吸光度。
1.3.6对O2-·的清除作用测定[17]
在具塞试管中加入4.5 mL 50 mmol/L Tris-HCl缓冲液(pH 8.27)和4.2 mL蒸馏水,混匀,在25 ℃水浴中保温20 min,取出后立即加入在25 ℃预热的3 mmol/L邻苯三酚溶液1 mL(以10 mmol/L HCl配制,空白管用10 mmol/L HCl代替邻苯三酚的HCl溶液),迅速摇匀,在325 nm波长处每隔10 s测定吸光度(A)。按公式(3)计算邻苯三酚自氧化率(ΔA0)。

加入邻苯三酚前,分别加入1.0、1.2、1.5、1.7、2.0、4.2 mL质量浓度为10 mg/mL的多糖溶液,不足4.2 mL的用蒸馏水补足,其他操作方法同上。计算加样后邻苯三酚自氧化速率(ΔA),得出对O2-·的抑制率。以VC为对照品。

1.3.7对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除作用测定[18]
用无水乙醇配制0.2 mmol/L的DPPH溶液,在具塞试管加入DPPH溶液2 mL和不同浓度样品溶液2 mL,混合均匀,暗室下室温避光反应30 min后,以乙醇溶剂调零点,测定DPPH混合溶液在517 nm波长处的A值。

式中:Ai为2 mL DPPH溶液+2 mL多糖溶液的吸光度;Aj为2 mL多糖溶液+2 mL溶剂的吸光度;Ac为2 mL DPPH溶液+2 mL溶剂的吸光度(溶剂均为无水乙醇)。
2 结果与分析
2.1硫酸根离子含量测定结果
经测定,S-RPP1、S-RPP2的吸光度分别为0.225、0.286,带入标准曲线回归方程计算得其硫酸根含量分别为11.3%、14.5%,取代度分别为0.89、1.36。
2.2紫外光谱分析

图1 S-RPP1(a)和S-RPP2(b)的UV光谱Fig.1 UV spectra of S-RPP1(a) and S-RPP2(b)
由图1可知,S-RPP1、S-RPP2在260、280 nm波长附近均出现新的吸收峰,说明在油菜花粉多糖分子上连接上了硫酸酯基团。
2.3红外光谱分析


图2 油菜花粉多糖RPP(a)及其酯化产物S-RPP1(b)和S--RPP2(c)的红外光谱Fig.2 IR spectra of RPP (a), S-RPP1(b) and S-RPP2(c)
在3 280 cm-1和2 910 cm-1附近分别有—OH和C—H的吸收峰,均是多糖类化合物的特征吸收峰;1 650 cm-1附近出现的吸收峰是C=O键非对称收缩振动;1 541、1 400 cm-1附近出现的吸收峰是C—O的变角振动引起,说明有官能团—COOH存在;1 233、1 142 cm-1出现的吸收峰均是O=S=O的伸缩振动特征峰。由图2可知,硫酸根基团通过反应已经成功地连接到了油菜花粉多糖的葡萄糖残基上。
2.4RPP、S-RPP1和S-RPP2对·OH的清除作用
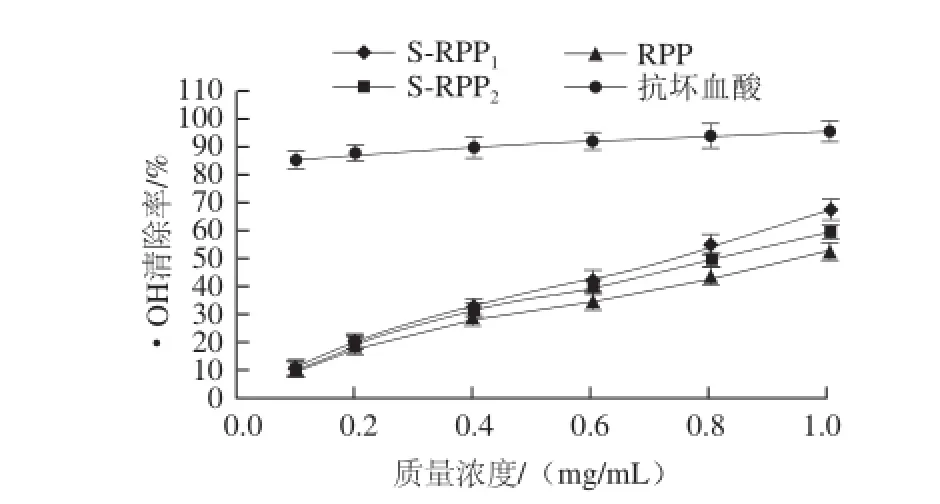
图3 RPP1和S-RPPS-RPP2对·OH的清除作用Fig.3 Hydroxyl radical scavenging effect of RPP, S-RPP1and S-RPP2
由图3可知,随着多糖质量浓度的增加,对Fenton反应产生的·OH均有较强的清除作用。当质量浓度大于0.4mg/mL时,RPP、S-RPP1和S-RPP2对·OH清除能力的差异明显增大,而S-RPP1表现出更强的清除活性,但是清除能力均低于同质量浓度的VC。
2.5RPP、S-RPP1和S-RPP2对O2-·的清除作用

图4 RPP1和S-RPPS-RPP2对OO2-·的清除作用Fig.4 Superoxide anion radical scavenging effect of RPP, S-RPP1and S-RPP2
由图4可知,RPP、S-RPP1和S-RPP2对邻苯三酚自氧化体系产生的O2-·都表现出了一定的清除能力。S-RPP1和S-RPP2的清除活性相当。当多糖质量浓度在2~6 mg/mL范围内,S-RPP1和S-RPP2的清除活性明显高于RPP,当质量浓度高于6 mg/mL时差异又相对减小。说明在一定质量浓度范围内对硫酸化修饰油菜花粉多糖可提高其对O2-·的清除能力。
2.6RPP、S-RPP1和S-RPP2对DPPH自由基的清除作用

图5 RPP、S-RPP1和SS--RPP2对DPPH自由基的清除作用Fig.5 DPPH radical scavenging effect of RPP, S-RPP1and S-RPP2
由图5可知,RPP、S-RPP1和S-RPP2对DPPH自由基均有显著的清除作用,随着样品质量浓度的增加,对 DPPH自由基的清除能力均呈现增长趋势。在2~10 mg/mL质量浓度范围内,S-RPP1对DPPH自由基的清除能力都远高于RPP和S-RPP2;当质量浓度大于4 mg/mL时,S-RPP2对DPPH自由基的清除能力明显大于RPP。
3 结 论
本实验以油菜花粉多糖为原料,经硫酸酯化修饰后得到S-RPP1和S-RPP22 个产物,硫酸根含量分别为11.3%、14.5%,取代度分别为0.89、1.36。体外抗氧化活性结果显示,硫酸酯化修饰后的多糖对DPPH自由基、·OH和O2-·具有较好的清除能力,并且呈现明显的量效关系。同质量浓度条件下,S-RPP1和S-RPP2的清除能力均明显高于RPP,说明油菜花粉多糖经过修饰后,抗氧化作用明显增强。尤其是S-RPP1表现出更好的抗氧化活性。可能是因为衍生化后,多糖的部分支链被水解,空间结构发生变化,进而使油菜花粉多糖的抗氧化活性提高。硫酸酯化油菜花粉多糖的构效关系有待进一步研究。
[1] LINSKENS H F, JORDE W. Pollen as food and medicine: a review[J]. Economic Botany, 1997, 51(1): 78-87.
[2] 曾志将. 养蜂学[M]. 北京: 中国农业出版社, 2003: 11.
[3] 汪磊, 朱波, 王国泽, 等. 油菜花粉保健功能研究进展[J]. 粮食与油脂, 2012(10): 5-7.
[4] 吴素芳, 曹炜, 姚亚萍, 等. 油菜蜂花粉提取物对羟基自由基介导2-脱氧核糖损伤的抑制作用[J]. 食品科学, 2006, 27(10): 544-548.
[5] 杨晓萍, 吴谋成. 油菜蜂花粉多糖抗肿瘤作用的研究[J]. 营养学报,2006, 28(2): 160-162.
[6] 张金明, 杨晓萍. 油菜花粉多糖对小鼠机体免疫功能的影响[J]. 公共卫生与预防医学, 2004, 15(6): 45-46.
[7] 赛福丁·阿不拉, 王君敏, 米克热木·沙衣布扎提. 多糖及其硫酸化衍生物的抗病毒及免疫增强活性研究进展[J]. 天然产物研究与开发,2013, 25(4): 572-575; 529.
[8] GUO Zhenhuan, HU Yuanliang, WANG Deyun, et al. Sulfated modification can enhance the adju-vanticity of lentinan and improve the immune effect of ND vaccine[J]. Vaccine, 2009, 27(5): 660-665.
[9] 王君敏, 胡元亮, 张帆, 等. 8种硫酸化多糖对新城疫病毒感染鸡胚成纤维细胞能力的影响[J]. 南京农业大学学报, 2011, 34(1):118-122.
[10] 刘军, 白云凤, 宫凯敏. 猪苓多糖硫酸酯的制备及活性测定[J]. 中国实验方剂学杂志, 2013, 19(14): 64-66.
[11] 耿越, 刘辉, 石丽花, 等. 马尾松花粉多糖硫酸酯化前后生物活性的比较研究[J]. 中国生化药物杂志, 2010, 31(2): 98-102.
[12] YANG Tiehong, JIA Min, ZHOU Siyuan, et al. Antivirus and immune enhancement activities of sulfated polysaccharide from Angelica sinensis[J]. International Journal of Biological Macromolecules, 2012,50(3): 768-772.
[13] CHU Huili, MAO Hua, FENG Wei, et al. Effects of sulfated polysaccharide from Masson pine (Pinus massoniana) pollen on the proliferation and cell cycle of HepG2 cells[J]. International Journal of Biological Macromolecules, 2013, 55: 104-108.
[14] 王丽霞, 蔡良根, 肖丽霞, 等. 硫酸酯化修饰魔芋葡甘聚糖及其产物结构表征[J]. 扬州大学学报: 农业与生命科学版, 2013, 34(1): 73-78.
[15] 郭晓强, 何钢, 刘嵬, 等. 硫酸酯化银耳多糖的制备及抗氧化性活性研究[J]. 天然产物研究与开发, 2013, 25(6): 747-751.
[16] 谢佳, 张静, 柳红. 南瓜多糖硫酸酯化衍生物的制备及抗氧化研究[J].食品工业科技, 2008, 29(9): 60-62.
[17] 吴向阳, 范群艳, 仰榴青, 等. 匙羹藤粗多糖的提取及其清除轻自由基活性研究[J]. 食品科学, 2008, 29(1): 107-110.
[18] 王文侠, 王龙艳, 宋春丽, 等. 豆渣多糖硫酸酯化工艺条件优化及其抗氧化活性[J]. 食品与发酵工业, 2013, 39(1): 103-107.
Antioxidant Effect of Sulfated Polysaccharides from Rape Pollen
YAO Qiuping, LI Yang, DENG Jian
(School of Chemistry and Environmental Science, Guizhou Minzu University, Guiyang 550025, China)
Objective: To investigate the antioxidant effect in vitro of native and sulfated polysaccharides from rape pollen(RPP). Methods: After sulfation of RPP using a sulfuric acid method at 0 and 10 ℃, respectively, the scavenging capacities against hydroxyl free, superoxide anion, and 1,1-diphenyl-2-picrylhydrazyl (DPPH) radicals were assayed using vitamin C(VC) as the control. Results: Two sulfated polysaccharides of RPP with degree of substitution (SD) of 0.89 and 1.36, named S-RPP1and S-RPP2, respectively, were obtained. RPP, S-RPP1and S-RPP2had certain scavenging ability against the three free radicals. Total antioxidant activity was in the decreasing order of S-RPP1> S-RPP2> RPP. Conclusion: The antioxidant activity of polysaccharides from rape pollen can be improved through sulfation.
polysaccharides from rape pollen; sulfation modification; antioxidant activity
TS255.1
A
1002-6630(2015)13-0065-04
10.7506/spkx1002-6630-201513013
2014-09-22
贵州省科技厅自然科学基金资助项目(黔科合J字[2010]2263号);贵州民族大学引进人才科研项目
姚秋萍(1978—),女,副教授,博士,研究方向为食品化学。E-mail:wonderyqp@aliyun.com
