莲原花青素对含有不同饱和度脂肪酸的乳糖-赖氨酸体系中晚期糖基化终末产物的抑制作用
2015-10-29董丽红李书艺李广越孙智达
吴 茜,董丽红,李书艺,张 皓,李广越,孙智达*
(华中农业大学食品科学技术学院,湖北 武汉 4300 70)
莲原花青素对含有不同饱和度脂肪酸的乳糖-赖氨酸体系中晚期糖基化终末产物的抑制作用
吴茜,董丽红,李书艺,张皓,李广越,孙智达*
(华中农业大学食品科学技术学院,湖北 武汉 4300 70)
研究 莲原花青素低聚体(lotus seedpod procyanidin oligomers,LSOPC)对含有不同饱和度脂肪酸的乳糖-赖氨酸模拟体系中晚期糖基化终末产物(advanced glycation end products,AGEs)生成的抑制作用。选择α-乳糖、L-赖氨酸和油酸/亚油酸/亚麻酸建立3 种热加工模拟体系,采用荧光分光光度法、电子鼻等技术,研究了在不同加热温度和时间、不同质量浓度LSOPC、不同脂肪酸等因素的作用下LSOPC对模拟体系中生成AGEs抑制作用的影响。加热温度和时间是LSOPC抑制AGEs生成的重要因素。在各模拟体系中,LSOPC对AGEs的抑制率均随LSOPC质量浓度增加而增加,且低温加热模式下的抑制率和抑制速率比高温加热模式下大。通过电子鼻技术的指纹图谱分析,发现低温(100 ℃)时,添加LSOPC后3 种模拟体系生成的气味物质之间无明显差异,高温(180 ℃)时,则有显著差异。LSOPC对含有不同饱和度脂肪酸的乳糖-赖氨酸模拟体系中AGEs的生成有一定的抑制作用,具有剂量依赖关系,且与加热温度和时间以及脂肪酸种类相关。
莲原花青素低聚体;抑制作用;荧光强度;电子鼻
晚期糖基化终末产物(advanced glycation end products,AGEs)是在非酶促条件下,由还原糖羰基与氨基酸或蛋白质、脂质或核酸等大分子物质的游离氨基经过缩合、重排、裂解、氧化修饰后产生的一组稳定的终末产物[1-2]。即通过美拉德反应形成的化学危害物。大量研究表明,体内AGEs的积累与糖尿病、肾脏疾病、动脉粥样硬化、衰老、心血管疾病和阿尔茨海默病等疾病的发病机理有着密切的关系[3-6]。饮食中AGEs是体内AGEs积累的重要来源,据估计人类通过膳食摄入的AGEs,大约有10%进入血液循环,仅有1/3通过肾脏排出体外,其余2/3留在体内,通过共价键与组织结合蓄积在体内,从而对人体造成伤害,诱发各种疾病的发生[7-9]。食品在加工过程中会产生大量的AGEs,食品的营养成分、加工方式、加热温度、加热时间都会影响AGEs的形成[10-11]。因此,降低食品中生成的AGEs含量是预防AGEs相关疾病的有效途径[12]。
原花青素(procyanidins,PCs)作为黄酮类化合物的一种,已通过JES-FRSO型电子自旋(顺磁)共振(electron spin resonance,ESR)波谱仪分析技术证实是一种具有极强的抗氧化活性和自由基清除能力的天然膳食补充剂[13-16]。莲原花青素是莲房的主要活性成分之一,并且证明其有抗氧化、免疫调节、降血脂、抗心肌缺血、抗肿瘤、抗辐射等多种生理功能[17]。目前,莲原花青素的相关研究主要侧重于对人体的抗衰老,预防某些疾病等方面,而在食品中的应用还鲜见报道。基于莲原花青素优越的抗氧化活性和自由基清除能力,将莲原花青素应用于抑制食品中AGEs生成的过程,对开发天然食品AGEs抑制剂的研究有重大意义。因此,本研究建立含有不同饱和度脂肪酸的乳糖-赖氨酸模拟加热体系,探讨莲原花青素低聚体(lotus seedpod procyanidin oligomers,LSOPC)对AGEs生成的抑制作用。
1 材料与方法
1.1材料与试剂
莲房产自湖北省荆州市洪湖区,品种为武植“2号”。LSOPC采用文献[18]方法进行制备。
L-赖氨酸 日本Biosharp公司;油酸(不饱和度Ω=1) 武汉祥和化学试剂公司;亚油酸(Ω=2)、亚麻酸(Ω=3) 中国农业科学院油料作物研究所;α-乳糖、乙醇、乙酸乙酯、盐酸、氢氧化钠、二甲基亚砜 国药集团化学试剂有限 公司。
1.2仪器与设备
EL104电子天平 上海梅特勒-托利多仪器有限公司;RF5301荧光分光光度计 日本Shimadzu公司;L-8800全自动氨基酸分析仪 日本日立制作所;电子鼻系统 法国Alpha MOS公司。
1.3方法
1.3.1加热温度和时间对LSOPC抑制AGEs效果的影响
准确配制浓度为0.225 mol/L的α-乳糖溶液和L-赖氨酸溶液,配制质量浓度为30 mg/mL的油酸水溶液(经NaOH皂化溶解,HCl中和而形成,由于油酸与乳糖,赖氨酸无法很好的互溶,因此利用皂化后再中和的方法将其中部分的脂肪酸转化成脂肪酸钠,以脂肪酸钠为乳化剂来使脂肪酸和氨基酸互溶,从而可以有效地避免添加其他乳化剂而造成的干扰)。分别取1 mL的α-乳糖溶液、L-赖氨酸溶液、质量浓度为4 mg/mL的莲原花青素溶液,2 mL的油酸水溶液,置于具塞玻璃试管中,制成5 mL的反应液。100 ℃水浴下分别加热10、20、30、40、60 min。分别在140、160、180 ℃条件下加热时间为2、4、6、8、10 min。同时设置以不加LSOPC但加热的反应体系为对照组,以不加LSOPC且不加热的为空白组。反应后测定荧光值,计算抑制率。每个实验平行3 次,取平均值。
1.3.2不同质量浓度LSOPC对AGEs抑制效果的影响
准确配制0.225 mol/L的α-乳糖溶液和L-赖氨酸溶液、30 mg/mL的油酸溶液、所需浓度的莲原花青素溶液。根据1.3.1节的实验结果,选取两个加热条件分别为100 ℃、30 min和180 ℃、2 min,设置100 ℃时LSOPC质量浓度分别为0.5、0.8、1.0、1.2、1.5、2.0 mg/mL;180 ℃时LSOPC质量浓度分别为0.8、1.6、2.4、3.2、4.0 mg/mL。参照1.3.1节的方法制成5 mL的α-乳糖/L-赖氨酸/油酸模拟体系反应液,同时设置以不加LSOPC但加热的反应体系为对照组,以不加LSOPC且不加热的为空白组。反应后测定荧光值,计算抑制率。每个实验平行3 次,取平均值。
1.3.3不同油脂对LSOPC抑制AGEs效果的影响
按照1.3.2节方法配制各种所需的溶液,以α-乳糖、L-赖氨酸和不同油脂(油酸、亚油酸、亚麻酸)建立3 种模拟油脂体系,分别制成低温(100 ℃、30 min,LSOPC质量浓度分别为0.5、0.8、1.2、1.5、2.0、2.5 mg/mL)和高温(180 ℃、2 min,LSOPC质量浓度分别为0.8、1.6、2.4、3.2、4.0 mg/mL)加热模式下的各种反应液,反应后测定各反应液的荧光吸收强度,计算抑制率,比较不同加热条件下、不同油脂对LSOPC抑制AGEs作用的影响。每个实验平行3 次,取平均值。
1.3.4LSOPC对模拟油脂体系中气味的影响
制备不同反应条件下各种模拟油脂体系的反应液,每个样品做4 个平行,然后在相应条件下反应,制备方法和反应条件同1.3.3节一样。将反应后的各样品趁热进行电子鼻分析(载气:合成干燥空气,流速150 mL/min;顶空产生参数:产生时间120 s,产生温度50 ℃,搅动速率500 r/min;顶空注射参数:注射体积500 μL,注射速率500 μL/s,注射针总体积2.5 mL,注射针温度60 ℃;获取参数:获取时间120 s,延滞时间600 s)[19]。分别比较100 ℃或180 ℃时,各模拟油脂体系在添加LSOPC前后挥发性气味有无差异以及在添加LSOPC后3 种模拟油脂体系生成的气味物质之间的差异大小。
1.3.5抑 制率的测定
由于AGEs具有自发荧光的特性,因而可用测定的荧光值来反映模拟体系中AGEs水平[20]。根据实验条件将反应液稀释适当的倍数,用荧光分光光度计,在激发波长370 nm,发射波长440 nm条件下测定反应液的荧光吸收强度[21]。
将各组反应液的荧光值,取平均值,按下式计算LSOPC对模拟油脂体系中AGEs的抑制率。
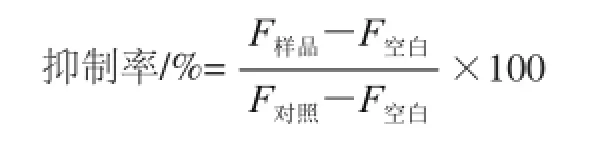
式中:F样品为加入LSOPC且加热的反应液的荧光值;F对照为不加LSOPC且加热的反应液的荧光值;F空白为不加LSOPC不加热的反应液的荧光值。
1.4数据处理
采用SPSS 18.0统计软件进行数据处理和分析。实验数据用表示,采用SPSS 18.0软件进行重复测量数据的方差分析,组间进一步比较用Dunnett's t检验。
2 结果与分析
2.1加热温度和时间对LSOPC抑制AGEs效果的影响
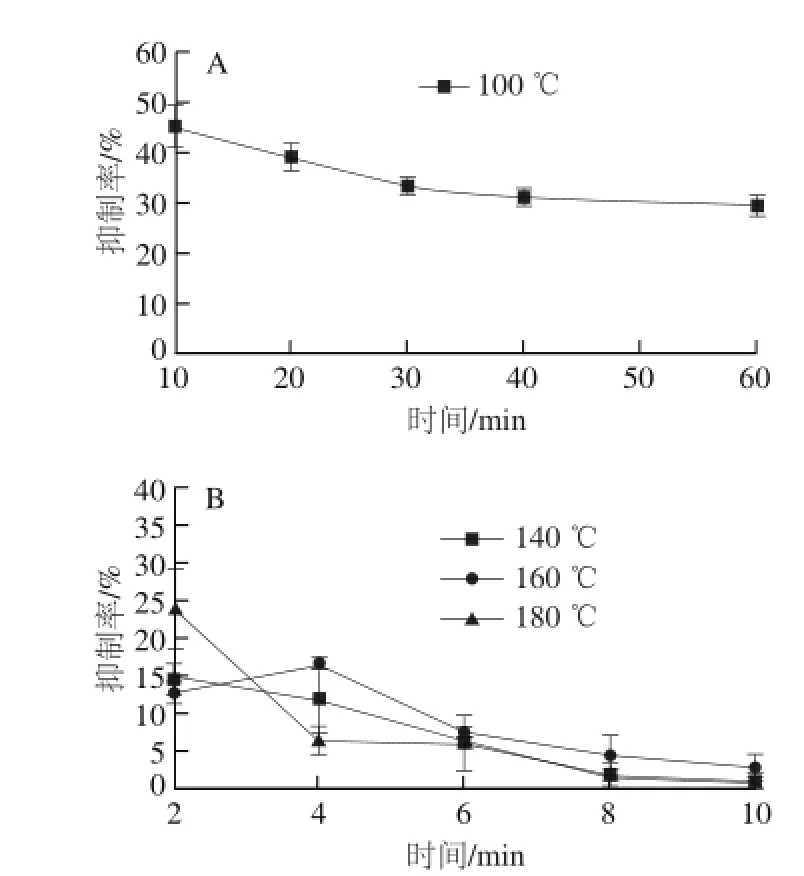
图1 不同反应温度和时间下LSOPC对模拟体系中AGEs的抑制作用Fig.1 Inhibitory effect of LSOPC on the formation of AGEs in simulated systems at different reaction temperatures and times
加热温度和时间会影响美拉德反应的进程,加热温度越高、加热时间越长,食品中的AGEs含量越高。添加LSOPC会抑制AGEs的生成[22]。图1反映了不同加热温度和时间对α-乳糖/L-赖氨酸/油酸模拟体系中LSOPC抑制AGEs效果的影响。低温加热模式(100 ℃)下(图1A)的抑制率明显高于高温加热模式(温度高于100 ℃)(图1B)时,说明高温促进美拉德反应进行,温度越高,反应越快。在各温度条件下,随着反应时间的延长,LSOPC对模拟体系中AGEs的抑制率呈减小趋势。100 ℃时,抑制率在10~30 min范围内下降显著,在30~60 min范围内下降不明显。高温加热时,LSOPC对AGEs的抑制率均很低,在180 ℃、2 min条件下抑制率最高,这是由于高温下LSOPC的抗氧化和消除自由基的能力下降[23],因此对AGEs的抑制率下降,但在最高温(180 ℃)下,有大量AGEs形成,并且在较短时间(2 min)内,LSOPC有较好的抗氧化活性,因此,抑制率达到高温体系里的最高值。
2.2不同质量浓度LSOPC对AGEs抑制作用的影响
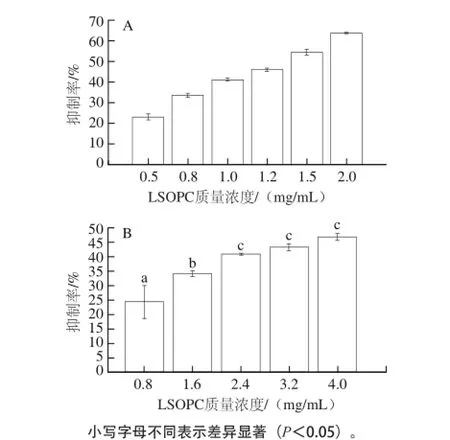
图2 100 ℃(A)和180 ℃(B)时不同质量浓度LSOPC对α--乳糖// L-赖氨酸/油酸模拟体系中AGEs的抑制作用Fig.2 Inhibitory effect of LSOPC concentration on the formation of AGEs in simulated reaction systems consisting of α-lactose, L-lysine and oleic acid at 100 ℃ (A) and 180 ℃ (B)
由图2可知,随着LSOPC质量浓度增加,LSOPC对AGEs的抑制率亦增加。100 ℃时,各LSOPC质量浓度之间抑制率的差异显著(P<0.05),经Probit回归分析,LSOPC对α-乳糖/L-赖氨酸/油酸模拟体系中AGEs生成的半抑制浓度(IC50)为1.317 mg/mL。180 ℃时,虽然抑制率随着LSOPC质量浓度增加而增加,但抑制率及其变化幅度都很小,当LSOPC质量浓度为0.8 mg/mL时,抑制率仅为24%,将LSOPC质量浓度提高到2.4 mg/mL时,抑制率才达到41%;且当LSOPC质量浓度从2.4 mg/mL增加到4.0 mg/mL时,抑制率仅增加6%,说明LSOPC对AGEs的抑制效果趋于饱和。当LSOPC质量浓度为4.0 mg/mL时,对AGEs的抑制率未达到50%,若天然产物抑制剂添加质量浓度过高,则失去其研究价值。
2.3不同饱和度脂肪酸对LSOPC抑制AGEs作用的影响
由图3A可知,100 ℃时,在相应的LSOPC质量浓度下,脂肪酸为亚麻酸的模拟体系中LSOPC对AGEs的抑制率最高,其次是亚油酸。这说明此加热条件下α-乳糖/ L-赖氨酸/亚麻酸模拟体系是最佳的模拟体系,可能是低温加热时不饱和度不是脂肪酸自氧化的主要原因,而LSOPC对极易氧化的不饱和脂肪酸有更好的氧化抑制作用,从而使得亚麻酸模拟体系的抑制率最好。
由图3B可知,180 ℃时,在相应的LSOPC质量浓度下,油酸模拟体系中LSOPC对AGEs的抑制率最大,亚麻酸体系的略高于亚油酸体系,可能是高温加热时不饱和度高的脂肪酸易自氧化产生大量的氧自由基,其大量的氧化产物与赖氨酸发生亲核反应促使生成大量的AGEs前体物或AGEs,使得LSOPC的抑制效果降低。因此α-乳糖/L-赖氨酸/油酸模拟体系的抑制率显著高于其他两种脂肪酸模拟体系。
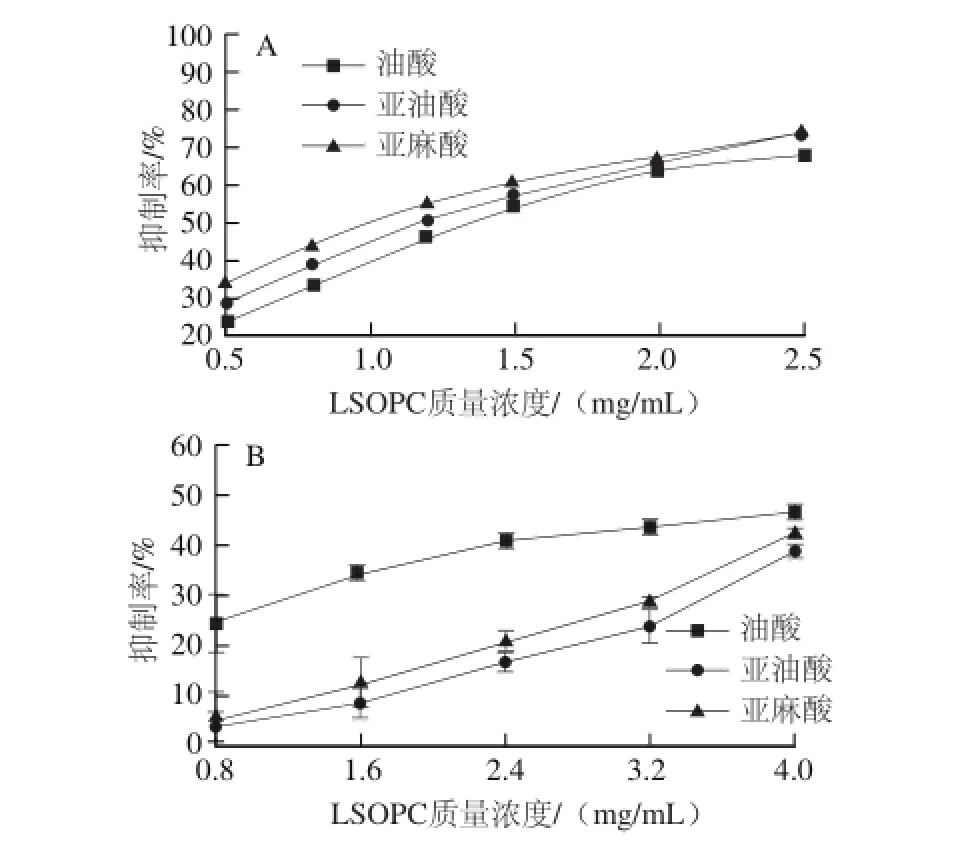
图3 100 ℃(A)和180 ℃(B)时不同质量浓度LSOPC对不同模拟体系中AGEs的抑制作用Fig.3 Inhibitory effect of LSOPC on the formation of AGEs in different simulated systems at 100 ℃ (A) and 180 ℃ (B)
2.4LSOPC对模拟体系中气味的影响
运用电子鼻分析系统对各样品进行电子鼻传感器信号数据的指纹图谱分析。指纹图,又叫雷达图,是把18 个传感器按照间隔20°均匀排列在圆周上,将每个传感器的最大响应值取出并标识,形成雷达图。同时,软件提供了一个简单的量化数值——相似度,用于明确地比较不同样品间气味的相似性[24]。
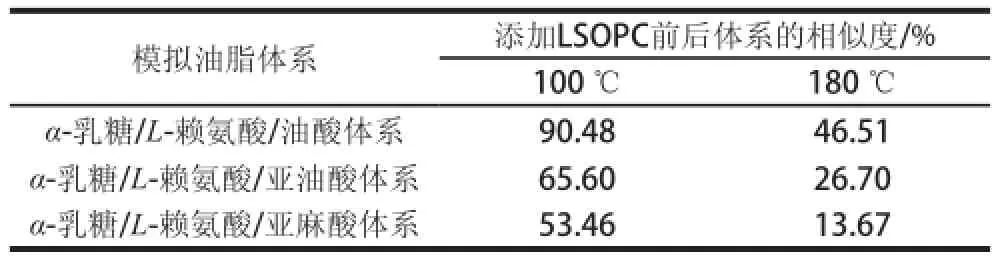
表1 LSOPC对各模拟体系相似度的影响Table1 Effect of LSOPC on the similarity of simulated systems
表1为分别在100 ℃和180 ℃反应时,α-乳糖/L-赖氨酸/油酸体系(体系1)、α-乳糖/L-赖氨酸/亚油酸体系(体系2)、α-乳糖/L-赖氨酸/亚麻酸体系(体系3)3 个模拟体系在添加LSOPC前后气味的相似性,结果表明LSOPC对各模拟体系的气味有影响,其中对α-乳糖/L-赖氨酸/亚麻酸模拟体系的气味改变最明显,而对α-乳糖/ L-赖氨酸/油酸体系的影响最小。同时在180 ℃时LSOPC对3 种体系的气味改变程度分别都比100 ℃时更明显。
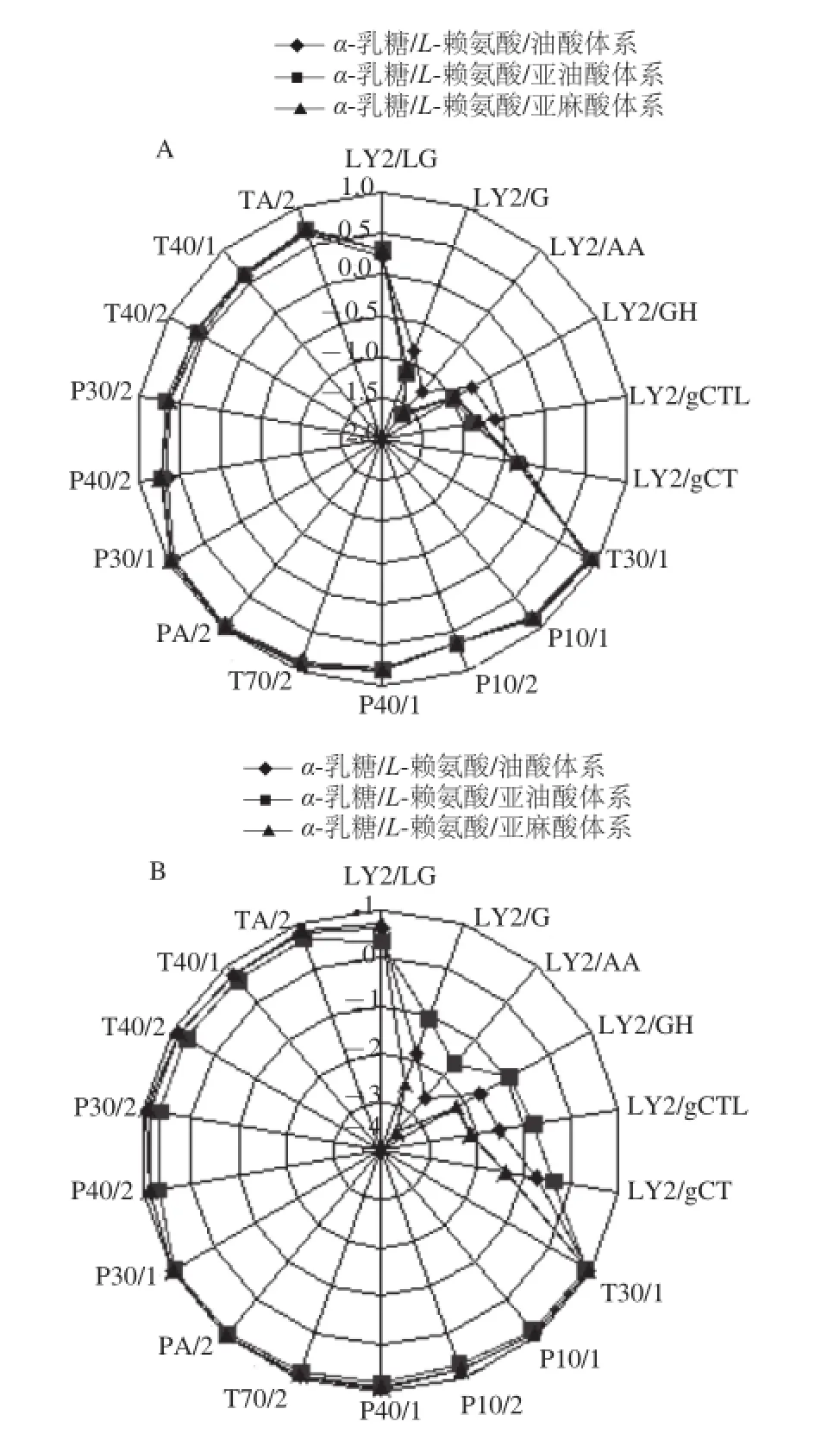
图4 100 ℃(A)和180 ℃(B)时添加LSOPC后3 种模拟体系气味的指纹图Fig.4 Fingerprints of odors formed in three simulated systems with added LSOPC at 100 ℃ (A) and 180 ℃ (B)
由图4A可知,100 ℃时,添加LSOPC后,α-乳糖/L-赖氨酸/亚油酸体系和α-乳糖/L-赖氨酸/亚麻酸体系的雷达图基本上重合,与α-乳糖/L-赖氨酸/油酸体系的雷达图在LY型有所差异但也不太明显。计算3 种体系之间的相似度,表2所示100 ℃时其相似度都已达到90%左右,可以认为这3 种模拟体系之间无明显差异。
从图4B的雷达图中可以直观地看出,180 ℃时,添加LSOPC后,这3 种模拟油脂体系的气味之间存在显著的差异,差异主要表现在LY型传感器上。同时,从表2中也可以看出,180 ℃时这3 种体系之间的气味差异很大,其中α-乳糖/L-赖氨酸/亚油酸体系和α-乳糖/L-赖氨酸/亚麻酸体系气味差异最大。
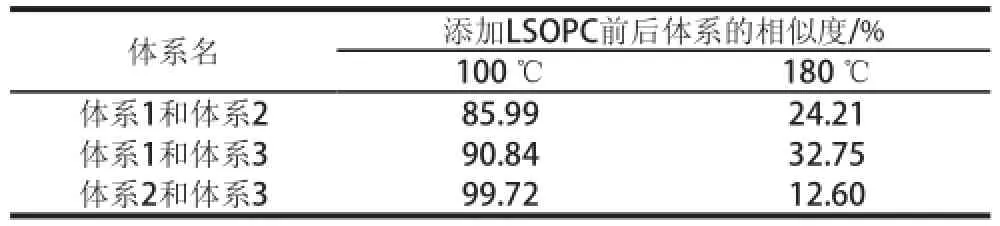
表2 各模拟体系之间的相似度Table2 Similarity of simulated systems
3 讨 论
加热温度和时间对LSOPC抑制AGEs的影响显著。无论是在低温加热模式还是高温加热模式下,随着加热时间的延长,LSOPC对AGEs的抑制率呈减小的趋势。但加热温度对抑制率的影响更显著,低温下的抑制率明显高于高温时。尽管低温的加热时间比高温的长,但由于美拉德反应是典型的温度敏感性反应,与反应时间相比,反应温度对美拉德反应的进程有更大的影响,高温加大反应速率,有助于化学反应的进程。
黄酮类物质能有效抑制AGEs的 生成,具有剂量依赖关系,其抑制机理与其抗氧化性和消除自由基的能力呈正相关[25]。莲原花青素作为一种天然的黄酮类物质,已被证实具有极强的抗氧化活性和自由基消除能力,因此能够有效抑制还原糖、油脂的自氧化反应,从而抑制AGEs的形成。实验结果表明,其抑制的效果与反应体系中的添加量有关,增加食品模拟体系中的LSOPC质量浓度可以提高AGEs的抑制率。在高温或高质量浓度下LSOPC对AGEs的抑制率不显著,可能是LSOPC发生部分热降解或引起自身的氧化聚集而导致抗氧化活性降低。有研究证明原花青素通过捕获活性羰基化合物而抑制AGEs的生成。推测LSOPC是一种很好的天然AGEs抑制剂,其抑制途径可能为消除自由基、抗氧化、封闭活性羰基。
不同脂肪酸对模拟体系中LSOPC抑制AGEs的效果有差异。脂类自动氧化的产物会参与美拉德反应,生成大量AGEs,而LSOPC是良好的氢供体,它能与氧化中间产物 ROO·发生抑制反应,推迟自动氧化[18]。但是不同的脂肪酸双键的位置和数量都不相同,碳原子的活化程度不同,氧化速率和形成的中间产物数量也不一样,因此LSOPC抗脂质过氧化的效果有所不同,从而导致含不同饱和度脂肪酸模拟体系对LSOPC抑制AGEs的效果有差异。此外,脂质自动氧化还会受加热温度的影响,因此不同温度下,不同脂肪酸对模拟体系中LSOPC抑制AGEs的效果也不同。
通过电子鼻分析,LSOPC在抑制AGEs生成的过程中会造成模拟体系中生成的气味物质有差异。此外,不同加热温度时LSOPC对不同模拟体系之间气味物质的影响不同。100 ℃时,添加LSOPC后3 种模拟体系生成的气味物质之间无明显差异;180 ℃时,则有显著差异。研究LSOPC对模拟体系中气味的影响,有助于莲房原花青素在食品中的实际应用,但有待进一步研究。
[1] SINGH R, BARDEN A, MORI T, et al. Advanced glycation endproducts: a review[J]. Diabetologia, 2001, 44(2): 129-146.
[2] SOMAN S, RAUF A, INDIRA M, et al. Antioxidant and antiglycative potential of ethyl acetate fraction of Psidium guajava leaf extract in streptozotocin-induced diabetic rats[J]. Plant Foods for Human Nutrition, 2010, 65(4): 386-391.
[3] RYOJI N, TAKEFUMI M, YASUHIKO Y, et al. Significance of advanced glycation end products in aging-related disease[J]. Journal of Anti-Aging Medicine, 2010, 10(7): 112-119.
[4] MEDUHA S, HAMADI F, MOHAMED M, et al. Mitigating effects of antioxidant properties of Artemisia campestris leaf extract on hyperlipidemia, advanced glycation end products and oxidative stress in alloxan-induced diabetic rats[J]. Food and Chemical Toxicology,2010, 48(7): 1986-1993.
[5] KARLY C S, JASMINE G L, SONIA L D, et al. Plasma advanced glycation end products (AGEs) and NF-κB activity are independent determinants of diastolic and pulse pressure[J]. Clinical Chemistry and Laboratory Medicine, 2014, 52(1): 129-138.
[6] HYUN Y K, TAKUYA O, TAKAKO Y. Beneficial effects of Chinese prescription Kangen-karyu on diabetes associated with hyperlipidemia,advanced glycation endproducts, and oxidative stress in streptozotocin-induced diabetic rats[J]. Journal of Ethnopharmacology, 2009, 124(2): 263-269.
[7] KOSCHINSKY T, HE C J, MITSUHASHI T, et al. Orally absorbed reactive glycation products (glycotoxins): an environmental risk factor in diabetic nephropathy[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(12): 6474-6479.
[8] HENLE T. AGEs in foods: do they play a role in uremia?[J]. Kidney International, 2003, 63: 145-147.
[9] FAIST V, ERBERSDOBLER H. Metabolic transit and in vivo effects of melanoidins and precursor compounds deriving from the Maillard reaction[J]. Annals of Nutrition and Metabolism, 2001, 45(1): 1-12.
[10] AMES J M. Applications of the Maillard reaction in the food industry[J]. Food Chemistry, 1988, 62(4): 431-439.
[11] URIBARRI J, WOODRUFF S, VLASSARA H, et al. Advanced glycation end products in foods and a practical guide to their reduction in the diet[J]. Journal of the American Dietetic Association, 2010,110(6): 911-966.
[12] VLASSARA H. Advanced glycation in health and disease: role of the modern environment[J]. Annals of the New York Academy of Sciences, 2005, 1043: 452-460.
[13] NADA Y, ANZAI K, MORI A, et al. Hydroxyl and superoxide anion radical scavenging activities of natural source antioxidants using the computerized JES-FR30 ESR spectrometer system[J]. Biochemistry and Molecular Biology International, 1997, 42(1): 35-44.
[14] LIN L C, KUO Y C, CHOU C J. Immunomodulatory proanthocyanidins from Ecdysanthera utilis[J]. Journal of Natural Products, 2002, 65(4): 505-508.
[15] GULER A, SAHIN M A, YUCEL O, et al. Proanthocyanidin prevents myocardial ischemic injury in adult rats[J]. Medical Science Monitor:International Medical Journal of Experimental and Clinical Research,2011, 17(11): BR326-BR331.
[16] XU Jiqu, RONG Shuang, XIE Bijun, et al. Procyanidins extracted from the lotus seedpod ameliorate age-related antioxidant deficit in aged rats[J]. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2010, 65(3): 236-243.
[17] 凌智群, 谢笔钧. 莲房原花青素及其生物、药理活性研究[D]. 武汉:华中农业大学, 2001.
[18] WU Qian, CHEN Hengye, L☒ Zhejuan, et al. Oligomeric procyanidins of lotus seedpod inhibits the formation of advanced glycation endproducts by scavenging reactive carbonyls[J]. Food Chemistry, 2013,138(2/3): 1493-1502.
[19] 张晓敏, 朱丽敏, 张婕, 等. 采用电子鼻评价肉制品中的香精质量[J].农业工程学报, 2008, 24(9): 175-177.
[20] MATTACEVICH S B, BUERA M P. A critical evalution of fluorescence as a potential markers for the Maillard reaction[J]. Food Chemistry, 2006, 95(3): 423-430.
[21] ANNETT S, JOHANNES M, JOVANA G M. Characterization of advanced glycation end products for biochemical studies: side chain modifications and fluorescence characteristics[J]. Analytical Biochemistry, 2005, 338(2): 201-215.
[22] JUNG H A, YOON N Y, KANG S S, et a1. Inhibitory activities of prenylated flavonoids from Sophora fl avescens against aldose reductase and generation of advanced glycation end products[J]. Journal of Pharmacy and Pharmacology, 2008, 60(9): 1227-1236.
[23] 汪志慧, 孙智达, 谢笔钧. 莲房原花青素的稳定性及热降解动力学研究[J]. 食品科学, 2011, 32(7): 77-82.
[24] 李书艺, 吴茜, 汪荣, 等. 膳食补充剂荔枝壳原花青素对大鼠排泄物的影响[J]. 食品科学, 2013, 34(15): 267-271. doi: 10.7506/spkx1002-6630-201315055.
[25] URIOS P, STERNBERG M. Flavonoids inhibit the formation of the crosslinking AGE pentosidine in collagen incubated with glucose, according to their structure[J]. European Journal of Nutrition, 2007, 46(3): 139-146.
Inhibitory Effect of Lotus Seedpod Procyanidin Oligomers on Non-enzymatic Glucosylation in α-Lactose-L-Lysine System with Fatty Acids of Different Degree of Saturation
WU Qian, DONG Lihong, LI Shuyi, ZHANG Hao, LI Guangyue, SUN Zhida*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
In the present study, the inhibitory effect of lotus seedpod procyanidin oligomers (LSOPC) on the formation of advanced glycation end products (AGEs) was explored in simulated systems consisting of α-lactose, L-lysine, and either oleic acid, linoleic acid or linolenic acid at various conditions of reaction temperature and time, and LSOPC concentration using fluorescence spectrophotometry and electronic nose technology. The results showed that the inhibitory effect of LSOPC on the formation of AGEs was greatly affected by reaction temperature and time. Higher LSOPC concentration could result in increased inhibitory rate of LSOPC on AGEs formation, and the increase of inhibitory rate was faster at low temperature when compared with high temperature. LSOPC had different impacts on odors generated in three simulated systems under different reaction conditions through fingerprint analysis combined with electronic nose technology. At low temperature (100 ℃), the odors formed in each system had no significant difference, while the results showed a big difference at 180 ℃. Thus, LSOPC have a certain inhibitory effect on the formation of AGEs in a dose-dependent manner which is highly correlated with heating temperature and time, and fatty acids.
lotus seedpod procyanidin oligomers (LSOPC); inhibitory effect; fluorescence intensity; electronic nose
TS202.3
A
1002-6630(2015)13-0018-05
10.7506/spkx1002-6630-201513004
2014-09-15
国家自然科学基金面上项目(31071633);华中农业大学优博基金项目(2013YB07)
吴茜(1988—),女,博士,研究方向为天然产物化学。E-mail:qianwill2007@163.com
孙智达(1963—),男,教授,博士,研究方向为食品化学。E-mail:sunzhida@sina.com
