深海嗜热菌超氧化物歧化酶基因耐盐性研究
2015-10-28陈全战张边江王立科等
陈全战 张边江 王立科等


摘要:为探究深海嗜热菌(Thermophile thermus)中铁离子超氧化物歧化酶Fe-SOD基因(TtSOD)与植物耐盐性的关系,对该基因的全长序列进行了分析,构建了TtSOD基因过量表达载体,并将该过量表达载体成功转化烟草中,获得转基因植株。结果表明,该基因全长615 bp,是典型的Fe-SOD。转TtSOD基因烟草中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性显著提高,而丙二醛(MDA)含量显著降低;转基因烟草的种子萌发率、叶绿素和类胡萝卜素含量显著提高。本研究的结果表明植物过表达TtSOD基因,提高了转基因烟草耐盐能力,为选育作物耐盐性新品种提供技术参考。
关键词:深海嗜热菌(Thermophile thermus);超氧化物歧化酶(SOD);耐盐性;转基因烟草
中图分类号:Q78;Q939 文献标识码:A 文章编号:0439-8114(2015)19-4766-05
DOI:10.14088/j.cnki.issn0439-8114.2015.19.027
Abstract: In order to explore the relations between salt resistance and TtSOD in plant, the sequence of the whole TtSOD gene was analyzed. The excessive expression vector involving to TtSOD gene was constructed, and then the vector was transformed into a tobacco. The results showed that the gene (Fe-SOD) is 615 bp in length. The activity of Super oxide dismutase(SOD), Peroxidase (POD)and Catalase (CAT) in transgenic tobacco increased significantly, while the Malonyldialdehyde(MDA) contents decreased remarkably. Chlorophyll and carotenoid contents and germination rate of seeds in transgenic tobacco increased observably. These results suggested that the salt-tolerance ability in transgenic tobacco improved strongly by excessive expression of TtSOD gene. Transgenic crop with TtSOD gene would be one of feasible means for crop breeding of salt resistance.
Key words: Deep-sea thermophilic bacterium; Super oxide dismutase(SOD); salt tolerance; transgenic tobacco
土壤的盐渍化严重制约着农作物的生长以及土地资源的利用。高盐逆境胁迫下,植物细胞内会产生大量的超氧自由基,使生物体的细胞膜通透性增加,膜脂过氧化,从而造成植株生理功能的减弱或衰退[1]。超氧化物歧化酶(SOD)通过改善活性氧的清除能力,在植株受到逆境胁迫时能够减少活性氧的积累,减轻对植物在逆境情况下的伤害作用[2]。
SOD是由多基因家族编码的,是一种金属酶类,可分为Cu/Zn-SOD、Mn-SOD、Fe-SOD和Ni-SOD 4类。Fe-SOD起源较其他SOD早,主要存在于原核生物中,是相对保守的蛋白质。Fe-SOD能催化歧化超氧离子,将生物体的活性氧控制在一个稳定的有利范围[3]。李素霞等[4]发现Fe-SOD的热稳定性要比其他种类SOD的热稳定性高。转基因烟草中过表达Fe-SOD可以显著提高转基因烟草的抗氧化性[5,6]。Kardinahl等[7]从一种高嗜温性菌株(archaeon Acidianus ambivalens)中纯化并鉴定了一种耐高温的Fe-SOD;姜晓杰等[8]在毕氏酵母中成功表达了钝顶螺旋藻Fe-SOD;曾秀存等[9]分析了白菜型油菜Fe-SOD的基因功能,发现Fe-SOD在初期低温胁迫下基因上调表达。这些研究已证明,在逆境条件、环境胁迫等条件下SOD基因表达量比较高,可以不同程度提高植物对环境胁迫的抵抗力。
TtSOD是从深海嗜热菌JM1(inshore hot spring Thermophile thermus JM1)中分离克隆到的一个SOD基因,序列分析发现该基因属于Fe-SOD类。为了研究TtSOD基因对烟草等农作物抗盐性的影响,本研究构建了过量表达载体,以烟草为转基因受体材料,分析盐胁迫下转TtSOD基因烟草的各项生理指标,包括SOD、过氧化物酶(POD)和过氧化氢酶(CAT)活性,丙二醛(MDA)含量,叶绿素和类胡萝卜素含量和种子萌发率,为研究转SOD基因提高植物耐盐性方面提供理论依据。
1 材料与方法
1.1 植物材料与菌株
本赛姆氏烟草品种(Nicotiana tabacum L.)、根癌农杆菌EHA105、大肠杆菌DH5α、植物双元表达载体pBI121(报告基因为GFP),均由本实验室保存。TtSOD基因(HM990157.1)由浙江大学章晓波老师惠赠。
1.2 TtSOD基因过量表达载体的构建
根据TtSOD基因全长序列设计过量表达载体构建引物:SOD-XbaⅠ:5′-CGCTCTAGAATGCCGTACCCGTTCAAGC-3′SOD-BamHⅠ:5′-CGCGGATCCAACAGGCCTTCTTGAAGAA-3′(下划线为酶切位点)。
为了目的基因能够与报告基因GFP通读,对TtSOD基因终止子进行了核苷酸替换。PCR反应程序为:95 ℃ 5 min;94 ℃ 30 s,60 ℃ 45 s,72 ℃ 70 s,32个循环;72 ℃ 5 min。PCR扩增得到的目的条带连入经相同内切酶双酶切的pBI121载体,而后用双酶切和测序法对重组表达载体进行阳性验证。
1.3 TtSOD基因过量表达载体(35S:SOD)进行烟草遗传转化
用叶盘法转化烟草培育转基因植株,采集种子用于进一步试验研究。
1.4 转基因烟草的阳性鉴定
经卡那霉素筛选的阳性植株,进行基因组PCR鉴定。上游引物为:SOD-1(5′-ATGCCGTACCCGTT
CAAGC-3′);下游引物为:SOD-2(5′-TCAGGCCTTCTTGAAGAACTCTTCG-3′),反应的退火温度为60 ℃。
RT-PCR鉴定:提取阳性转基因烟草叶片的总RNA,反转录后利用SOD-1和SOD-2引物对TtSOD基因在烟草中mRNA表达水平进行了鉴定。
1.5 转基因烟草种子萌发的耐盐性分析
分别选择T1代转基因烟草和野生型烟草各100粒种子置于含150 mmol/L NaCl的MS固体培养上培养,重复3次,种子萌发后统计萌发率。
1.6 转基因烟草盐胁迫下苗期生理指标测定
选取培养6周的转基因烟草和野生型烟草幼苗,用150 mmol/L的NaCl溶液每隔2 d浇灌一次,持续8 d后,取野生型和转基因烟草相同叶位叶片 (倒3叶),进行耐盐相关生理指标测定。
采用氮蓝四唑(Nitrobiue tetrazolium,NBT)光化学还原法测定SOD活性[10];采用愈创木酚法测定POD活性[11];采用硫代巴比妥酸比色法[12]测定MDA含量;CAT活性和叶绿素含量参照文献[13]的方法测定;采用紫外分光光度法测定类胡萝卜素含量[14]。
2 结果与分析
2.1 重组克隆载体TtSOD:PMD18鉴定与序列分析
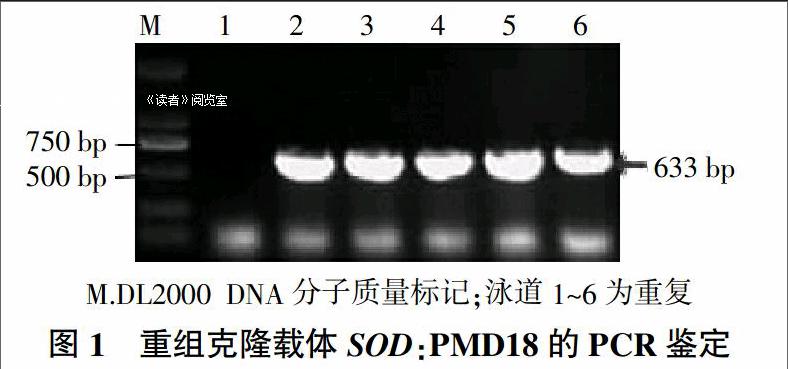
以构建好的重组克隆载体TtSOD:PMD18质粒为模板,以SOD-XbaⅠ和SOD-BamHⅠ为引物进行 PCR扩增,预计可扩增出633 bp的特异条带,并且此条带含有XbaⅠ和BamHⅠ酶切位点,PCR扩增结果如图1所示。随机挑选6个单菌落,除了1号外其他5个都在633 bp处有目的大小的清晰条带。为了在目的基因TtSOD两侧引入XbaⅠ和BamHⅠ酶切位点,检测引入酶切位点的正确性,随机选取了经上述PCR鉴定为阳性克隆的单克隆进行了测序,如图2所示,目的基因序列以及酶切位点和保护碱基的序列没有发生任何突变,并且TtSOD的终止密码子突变成了非终止密码子,以便于后续试验的的同源阅读。以上两种方法均证实了TtSOD基因两侧成功引入了XbaⅠ和BamHⅠ酶切位点,为构建过量表达载体奠定了基础。
2.2 TtSOD转基因烟草T1代的筛选与鉴定
通过PCR扩增引入酶切位点XbaⅠ和BamHⅠ,成功构建了TtSOD基因的过量表达载体(图3)。通过农杆菌介导的方法,将TtSOD基因整合到烟草基因组中。经卡那霉素筛选和PCR(SOD-1和SOD-2引物)鉴定为阳性的T0代转基因烟草,单株收获T1代种子。将T1代种子平铺于含有50 mg/L卡那霉素的MS固体培养基中进行筛选,携带有目的基因的植株能正常生长;未携带目的基因的植株,即使萌发也会慢慢黄化而死亡。
以T1代转基因烟草提取的DNA为模板,以野生型烟草为对照,以SOD-1和SOD-2为引物,对转基因烟草进行基因组PCR鉴定,结果显示630 bp左右目的条带(图4),7~9号泳道为烟草转基因株系,而6号泳道对照未出现目的条带,说明目的基因已经整合到基因组中。
以T1代转基因烟草提取叶片RNA反转录成的cDNA为模板,以野生型烟草为对照,以SOD-1和SOD-2为引物对转基因烟草进行mRNA表达水平鉴定,结果显示扩增出630 bp左右的目的条带(图4),2~5号泳道为烟草转基因株系,而1号泳道对照未出现目的条带,说明目的基因已经转录表达。
2.3 盐胁迫下TtSOD转基因烟草种子萌发情况分析
经RT-PCR鉴定为阳性的T1代转基因烟草中,选取S62和S88株系作为后续研究对象。从图5可以看出,经过150 mmol/L NaCl处理后,转基因烟草和野生型烟草的萌发都受到不同程度的抑制,转基因烟草的萌发率普遍高于对照野生型烟草。转基因烟草萌发率达到98%,野生型烟草的萌发率在72%左右。未经任何处理的对照试验中,转基因烟草和非转基因烟草的萌发率没有明显差异。说明经NaCl处理后转基因烟草的耐盐性明显提高。
2.4 TtSOD转基因烟草苗期耐盐生理指标的测定
超氧化物酶是需氧生物普遍存在的一种金属酶,它与过氧化物酶和过氧化氢酶等酶协同作用,在清除超氧自由基对膜系统的伤害方面起着重要作用。在150 mmol/L的 NaCl胁迫下,两个转基因烟草的SOD、POD和CAT活性明显提高(图6 A、图6 B和图6 C),MDA含量降低(图6D),这说明在烟草中过量表达细菌TtSOD基因能够提高烟草对盐分胁迫的耐受性。
植物在受到逆境胁迫后影响植物的光合作用、呼吸作用,从而影响叶绿素含量。因此,在盐胁迫处理下,研究叶绿素含量可以反映植物耐受盐胁迫的程度。本研究结果显示,与对照相比,转基因烟草的叶绿素a、叶绿素b和类胡萝卜素的含量均明显增加(图7),表明转基因烟草在逆境胁迫下其生理功能得到了改善。
3 小结与讨论
近年来,许多植物的SOD基因相继被广泛研究。朱虹琳等[15]克隆了莲Cu/Zn超氧化物歧化酶基因的cDNA序列;高健等[16]分析了特异种质烟草HZNH的Fe-SOD 基因功能和表达;叶煜辉等[17]获得抗逆性的赖草Fe-SOD的EST序列长207 bp,其编码的60个氨基酸与多种植物Fe-SOD氨基酸序列的同源性达到60%以上。本研究的SOD基因是从耐热细菌(Thermophile thermus)基因组分离到的,该基因核苷酸序列长度为615 bp,TtSOD基因具有Fe-SOD类基因典型的功能。
众所周知,植物在逆境胁迫条件下产生大量的活性氧自由基,引发膜脂过氧化,从而对植物造成伤害。研究表明,在盐碱、干旱、高温、冷冻等逆境条件下SOD基因表达量比较高,可以不同程度提高植物对环境胁迫的抵抗力[18]。SOD通过清除细胞内的活性氧、减少细胞内部的活性氧累积,对于增强植株的耐盐等抗逆能力具有重要作用。本研究利用农杆菌介导的叶盘法转化烟草,使TtSOD基因在烟草中过量表达,与对照相比,转基因烟草中SOD、POD和CAT活性显著增加,而MDA含量明显降低,表明过量表达TtSOD基因提高了烟草的耐盐能力。
叶绿素在植物光合作用中起吸收和转化光能的作用,叶绿素a和b分别是光合作用的主要色素和辅助色素,其含量在一定程度上体现了植物光合作用能力的大小。植物受到逆境胁迫时会影响到叶绿素的含量。因此,叶绿素含量下降可以看成是植物受害后的生理指标反应之一。在本研究中,转基因烟草叶肉细胞内叶绿素a、b和类胡萝卜素含量明显高于未转基因烟草的含量,表明TtSOD基因可以有效降低叶绿素的生物降解,使转基因烟草在高盐胁迫下受到的伤害较小,从而提高烟草对盐胁迫的抗性。
本研究结果显示,细菌SOD基因在烟草中过量表达后,不仅抗氧化能力显著增强,其光合色素含量也显著提高,表明转基因烟草的耐盐胁迫能力明显提高,这为烟草耐盐品种的选育提供了一种新的育种资源。至于其转Fe-SOD基因烟草提高耐盐的作用机理,还有待进一步研究。
参考文献:
[1] SONG F N, YANG C P, LIU X M, et al. Effect of salt stress on activity of superoxide dismutase(SOD) in Ulmus pumila L.[J]. J For Res,2006,17:13-16.
[2] HU G H, YU S X, FAN S L, et al. Cloning and expressing of a gene encoding cytosolic copper/zinc superoxide dismutase in the upland cotton[J]. Sci Agric Sin,2007,40:1602-1609.
[3] 邹媛媛,樊小英,刘国宪,等.原核微生物铁超氧化物歧化酶的分子进化[J].微生物学杂志,2009,29(3):57-63.
[4] 李素霞,夏文超,袁勤生.铁超氧化物歧化酶的研究进展[J].中国生化药物杂志,2002,23(6):316-318.
[5] SIMONTACCHI M, CARO A, FRAGA C G, et al. Oxidative stress affects α-tocopherol content in soybean embryonic axes upon inhibition and following germination[J]. Plant Physiol, 1993, 103:949-953.
[6] WIM V C, KATELIJNE C, MARC V M, et al. Enhancement of oxidative stress tolerance in transgenic tobacco plants overproducing Fe-superoxide dismutase in chloroplasts[J]. Plant Physiol, 1996, 112:1703-1714.
[7] KARDINAHL S, ANEMULLER S, SCHAFER G. The hyper-thermo stable Fe-superoxide dismutase from the archaeon Acidianus ambivalens characterization, recombinant expression, crystallization and effects of metal exchange[J]. Biol Chem, 2000,381:1089-1101.
[8] 姜晓杰,王文杰,高金亮,等.钝顶螺旋藻sod基因真核表达载体的构建与表达[J].生物技术,2014,24(5):17-21.
[9] 曾秀存,孙万仓,孙 佳,等.白菜型冬油菜铁超氧化物歧化酶(Fe-SOD)基因的克隆及表达分析[J].中国农业科学,2013,46(21):4603-4611.
[10] GIANNOPOLITIS C N, RIES S K. Superoxide dismutase I: occurrence in higher plant[J]. Plant Physiology, 1977, 59: 309-314.
[11] MEAD J F. Free radical mechanism of lipid damage, a consequence for cellular membranes[A]. PROYOR W A. Free Radicals in Biology[M]. New York: Academic Press, 1976. 185-210.
[12] 郝建军,刘延吉.植物生理学实验技术[M].沈阳:辽宁农业科学技术出版社,2001.
[13] 李得孝,郭跃霞,员海燕,等.玉米叶绿素含量测定方法研究[J].中国农学通报,2005,21(6):153-155.
[14] 孙延芳,王成社,杨进荣,等.硬粒小麦类胡萝卜素含量的定量分析[J].西北农林科技大学学报(自然科学版),2007,35(5):102-106.
[15] 朱虹琳,董 臣,刁 英,等.莲铜锌超氧化物歧化酶cDNA的克隆和序列分析[J].武汉大学学报(理学版),2006,52(4):475-480.
[16] 高 健,许晓风,陈 学.特异种质烟草HZNH的Fe-SOD基因的克隆与表达[J].中国生物化学与分子生物学报,2005,21(6):840-845.
[17] 叶煜辉,陈 艳,杨满业,等.赖草Fe-SODEST序列的克隆及分析[J]. 四川畜牧兽医,2009(6):29-31.
[18] 张秀娟,孙润生,吴 楚,等.Hg、Cd复合污染对千屈菜生理生化指标的影响[J].北方园艺,2013,37(18):74-77.
