PET/CT及DWI-MRI早期评估兔VX2肉瘤射频消融效果
2015-10-28石华铮刘士远朱海云杨春山高欣平照福寿毅华威吴翔
石华铮,刘士远,朱海云,杨春山,高欣,平照福,寿毅,华威,吴翔
·实验研究Experimental research·
PET/CT及DWI-MRI早期评估兔VX2肉瘤射频消融效果
石华铮,刘士远,朱海云,杨春山,高欣,平照福,寿毅,华威,吴翔
目的探讨弥散加权(DWI)-MRI和18F-FDG-PET/CT评估兔VX2肉瘤射频消融(RFA)治疗早期效果的价值。方法14只新西兰白兔双侧后肢接种VX2肉瘤建模,一侧后肢VX2肉瘤接受超声引导下RFA治疗(RFA组),对侧后肢不进行射频治疗(对照组)。RFA治疗后2 d行DWI-MRI检查,治疗后3 d行PET/CT检查。分别计算肿瘤病灶和消融灶表观弥散系数(ADC)值和标准摄取值(SUV)值。根据外科切除病灶组织病理学检查结果金标准,分别对DWI-MRI、PET/CT及两者联合等3种方法评估RFA瘤灶行临床诊断一致性Kappa检验。结果VX2肉瘤RFA前,DWI-MRI显示T1低信号,T2高信号,T1加权像环状强化,PET/CT显示18F-FDG呈结节状或环状聚集;消融后DWI-MRI显示T1高信号,T2轻度高密度,T1加权像轻度强化,PET/CT显示18F-FDG浓聚程度减低。消融瘤灶ADC值为(1.52± 0.24)×10-3mm2/s,明显高于未消融瘤灶(1.09±0.12)×10-3mm2/s(P<0.05);SUV值为(0.60±0.30),明显低于未消融瘤灶(9.60±3.20)(P<0.05)。单独DWI-MRI与单独PET/CT评估结果的敏感性、特异性及准确性与组织病理学诊断结果的一致性Kappa值分别为0.357和0.428,无显著性差别(P>0.05),DWIMRI联合PET/CT评估结果与组织病理学诊断结果的一致性Kappa值为0.786,与前两者均有显著性差别(P<0.05)。结论DWI-MRI显像ADC值和FDG-PET/CT显像SUV值是评估RFA治疗早期效果的有临床应用价值的指标。DWI-MRI与FDG-PET/CT诊断肿瘤病灶治疗效果各具优势,两者联合应用可有效提高疗效评估的准确性。
射频消融;弥散加权像;兔VX2肿瘤;PET/CT;早期疗效
射频消融(RFA)是利用微波、激光和高频超声产生热凝固性坏死并损毁肿瘤的一种治疗方式,对无法手术切除的肝脏、肺脏、肾脏、骨、肾上腺和乳腺肿瘤具有十分重要的实用价值[1-2],并可在不增加并发症前提下改善患者疗效和生存率[3]。针对这类患者,临床上希望早期准确评估肿瘤RFA效果,然而早期RFA病灶局部炎性反应明显,单纯依赖解剖图像变化很难评估治疗反应究竟如何。PET/CT虽可早期评估消融疗效,但价格昂贵,很难广泛应用。有研究发现弥散加权(DWI)-MRI可以检测脑梗死早期变化[4],因此本研究试图利用DWI-MRI表观弥散系数(ADC)值评估射频治疗兔VX2肉瘤的早期效果并对比分析18F-FDG-PET/CT标准摄取值(SUV)评估结果,同时评估DWI-MRI、PET/CT及两者联合诊断射频治疗病灶的一致性。
1 材料与方法
1.1实验动物和VX2肿瘤模型建立
本研究获得上海交通大学医学院动物实验伦理委员会批准。普通级新西兰白兔14只(上海市第六人民医院动物实验中心提供),体重2.0~2.5 kg,3~4月龄,雌雄不限。VX2荷瘤种兔购自上海交通大学医学院。所有外科操作均在兔处于基础麻醉(耳缘静脉注射3.0%戊巴比妥钠1 ml/kg)下进行。切取荷瘤种兔VX2瘤体边缘组织,将鱼肉状肿瘤组织剪成1×1×1 mm3大小并置于4℃Hank液备用。采用切口瘤块包埋种植法构建模型:卧位固定、备皮、消毒后切开后肢血供丰富的肌肉组织2 cm,将VX2瘤块分别接种于14只兔双后肢肌肉中,逐层缝合关闭切口,独笼饲养。共28个肿瘤样本用于本实验。
1.2RFA
为确保单针RFA范围可以完全消融肿瘤病灶,于肿瘤种植后7 d行射频治疗。一侧后肢肿瘤行射频治疗(RFA组),另一侧后肢肿瘤作为未治疗对照组。麻醉满意后,超声引导下将可伸缩钩样电极针经皮穿刺进入VX2肿瘤,针尖置于肿瘤中心位置,完全打开针尖。将RF2000型射频治疗仪(美国Boston科技公司)自粘性接地片帖于兔模型腹部,功率设置为20 W,每2分钟增加10 W,直到射频能量导致组织脱水产生的电阻力使治疗仪自动停止为止(如果未自动停止,最长工作时间为6 min)。具有5年工作经验的医师完成RFA治疗过程。
1.3DWI-MRI检查
VX2兔经射频治疗后2 d,采用1.5-T MR成像系统扫描检测14只模型兔:麻醉后俯卧固定,选用快速自旋回波T1加权图像(TR/TE 532/15 ms,矩阵512×256)、快速自旋回波T2加权图像(TR/TE 4 000/96 ms,矩阵512×256)及抑脂频率(5 100/ 137 ms,矩阵512×256),扩散敏感系数(b值)为50、500、1 000 s/mm2,层厚3.0 mm,间隔1.0 mm,视野21 cm。采用单盲法阅片,测定治疗组与对照组肿瘤区域ADC值,b值取300、600、800 s/mm2。采用视觉分析法建立肿瘤病灶治疗后DWI-MRI评价标准:DWI显像治疗区域若显示较周围本底有明显增高的信号影,评价为有肿瘤活性残存;若治疗区域信号与本底基本一致,则评价为肿瘤活性减灭。
1.4PET/CT检查
VX2兔经射频治疗第3天,禁食4 h后被麻醉俯卧固定,耳缘静脉21 G留置针注入18F-FDG(37 MBq/kg),45~50 min后采集图像。CT扫描参数为140 kV,80 mA,旋转1周时间为0.8 s,螺距5.0 mm,床速22.5 mm/s;PET图像采集时间为每床位5 min。以SUV值作为定量指标,通过XelerisTM功能成像处理查看系统(美国通用医疗生物科学公司)图像融合工作站调用PET/CT断层图像,获得横断面数据;根据CT图像准确选取肿瘤最大切面,在PET图像上勾画对照组与治疗组肿瘤区域边缘,取放射性浓聚较均匀部位作SUV值检测,获得肿瘤组织最大SUV(SUVmax)值。建立肿瘤病灶治疗后FDGPET/CT评价标准:①肿瘤活性残存:治疗区域仍有灶状、片状、块状FDG摄取增高影,且治疗勾画区域SUVmax值≥2.5;②肿瘤活性减灭:治疗区域FDG摄取值与周围组织本底基本相同,且治疗勾画区域SUV值<2.5。
1.5组织病理学检查
PET-CT扫描后以过量麻醉(戊巴比妥钠90 mg/ kg)处死所有实验兔,外科手术切除一侧后肢肿瘤组织及对侧后肢消融区域组织,石蜡包埋固定,HE染色后作光镜下组织病理学观察。建立肿瘤治疗后组织病理学评价标准:①肿瘤活性消亡:多个镜下视野见治疗区域细胞弥漫凝固性坏死,伴或不伴充血、液性坏死及炎性细胞浸润;②肿瘤活性残存:镜下视野见治疗区域肿瘤细胞片状分布。
1.6统计学方法
采用t检验分析未处理肿瘤病灶和RFA后病灶的ADC值和SUVmax值。以病理学检查结果为金标准,通过临床诊断一致性检验评估DWI-MRI、PET/CT及DWI-MRI联合PET/CT显像的敏感性、特异性和准确性,并计算各评价方法的Kappa值。采用SPSS13.0统计软件对以上数据进行分析,计量资料以均数±标准差表示,P<0.05视为差异有统计学意义。
2 结果
2.1一般资料
本研究中动物模型构建成功率为100%。成瘤肿块样本共28个,种植后1周肿瘤平均直径为(1.6± 0.16)cm。所有14只兔模型均成功接受超声引导下射频治疗,平均消融时间为(5.07±0.77)min,平均初始阻抗为(60.9±10.0)Ω。DWI-MRI和PET/CT显像成功率均为100%。所有动物在射频消融术后1 d进食量均见减少,术后3 d恢复正常。
2.2DWI-MRI和PET/CT评估未治疗VX2肿瘤
MRI图像见VX2荷瘤与周围肌肉组织境界清晰,呈现T2较均匀高信号。增强扫描T1加权像可见瘤灶环状强化,DWI呈较高信号。PET/CT图像显示18F-FDG浓聚于肿瘤组织内,呈结节状或环状高度聚集区域(图1)。定量分析表明VX2荷瘤平均ADC值和平均SUVmax值分别为(1.09±0.12)×10-3mm2/s和(9.60±3.20)。病理组织大体标本切面见灰红、鲜嫩鱼肉样组织,肿瘤中心可见卵圆形液化坏死,与正常组织间界限明显。镜下观察HE染色示大量肿瘤细胞排列紊乱、核大浓染,胞质少胞界不清,呈异型性改变。VX2肿瘤含有高度恶性肿瘤细胞,周边区域呈现有活力的肿瘤细胞,中央区域为液化性坏死病变(图2)。
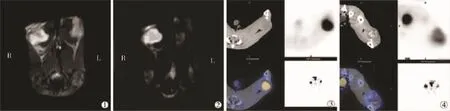
图1 射频治疗和未治疗VX2肉瘤DWI-MRI与FDG-PET/CT显像图

图2 射频治疗和未治疗VX2肉瘤病理组织HE染色
2.3DWI-MRI和PET/CT评估RFA后VX2肿瘤
RFA区域为T1、T2稍高信号,T1加权增强图像轻度强化,与未处理肿瘤的DWI高信号相比,消融灶DWI信号减低。PET图像示18FDG聚集效应明显减低(图1)。定量分析表明消融灶ADC值和SUVmax值分别为(1.52±0.24)×10-3mm2/s和(0.60± 0.30),与未治疗肿瘤ADC值和SUVmax值比较分别为明显增加(t=6.36,P=0.001)和明显减低(t= 8.18,P=0.000)(表1)。病理分析发现消融灶瘤细胞肿胀,细胞密度减少,瘤细胞破裂溶解及片状凝固坏死,出现核固缩、染色质模糊溶解、胞质嗜酸性坏死、胞质边界模糊等特征性改变(图2)。坏死区域周围可见单核细胞、中性粒细胞浸润。
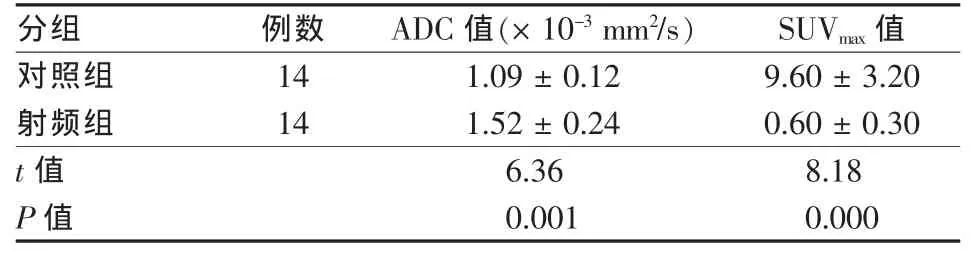
表1 RFA组和未治疗对照组ADC值、SUVmax值变化情况
2.4不同方法评价VX2肿瘤射频治疗的统计学比较
DWI-MRI评价方法与PET/CT评价方法的敏感性、特异性、准确性无显著性差别,两者Kappa值分别为0.357和0.428(P>0.05);DWI-MRI联合PET/CT评价方法较单独DWI-MRI及单独PET/CT评价方法的敏感性、特异性及准确性均有显著性差别,其Kappa值为0.786(P<0.05)(表2)。
3 讨论
MRI常规成像技术是目前临床上最常用的肿瘤射频治疗效果的评价方法,具有较高应用价值,但也存在一定缺陷。这表现在RFA后病灶及周围组织热损伤导致信号改变,干扰恶性肿瘤残存灶的检出[5]。本研究发现RFA后常规MR图像信号在T1及T2加权像有所改变,但尚无法判断病灶内是否有肿瘤残存。可见,通过观察肿瘤信号变化评价肿瘤是否残余或局部进展并不适用于RFA治疗后早期。Zheng等[6]研究提出动态增强CT造影和MRI较单纯平扫用于评估肿瘤残余更具有价值,但本研究中肿瘤治疗区域增强扫描同样呈轻度强化,判断肿瘤有无残存同样较困难。
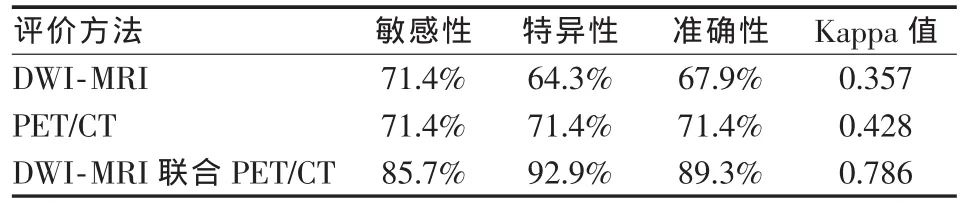
表2 不同方法评价VX2肿瘤射频治疗的敏感性、特异性和准确性
局部组织代谢变化往往发生于形态学改变之前。因此,功能性成像技术如FDG-PET/CT及DWIMRI显像有望成为评估射频治疗后肿瘤代谢改变的非侵袭性方法。DWI表现的是组织内部功能性变化,常规MRI检查则是反映组织形态学变化,因此在早期常规MRI T1及T2加权像尚无异常发现时,DWI即可显示病变区域组织功能性变化。肿瘤组织细胞外液减少、细胞密集程度较高、细胞外液自由水扩散受限使得ADC值下降,在DWI加权像表现为较周围正常组织的高信号[7];射频治疗后,肿瘤病灶凝固性坏死一方面使组织含水量减少,另一方面细胞死亡后包膜通透性增高,细胞内液体进入细胞外增多,使得ADC值增高,因此在DWI加权像治疗区域表现为信号减低区[8]。上述水分子弥散机制和DWI成像,有助于了解射频治疗后肿瘤情况,并判断治疗区域有无残留肿瘤组织。本实验中肿瘤种植后均表现为DWI高信号,射频治疗后肿瘤病灶DWI信号减低,提示DWI成像对肿瘤射频治疗后肿瘤组织代谢变化有较高灵敏度。但DWI也存在一定缺陷,表现在判断肿瘤的特异性较低,因为肿瘤治疗区域诸多因素均可影响水分子弥散状态,并影响DWI信号改变,主要表现为治疗后损伤区域水肿,可使该区域含水量增高,导致DWI增高;治疗后原肿瘤区域即使没有活性肿瘤细胞,但纤维增生性反应较明显,导致间质水分子弥散障碍,引起ADC值下降而DWI表现为高信号;高T2信号透过效应及不同b值选择可显示不同组织。上述这些因素均干扰DWI信号,从而影响射频治疗后瘤灶情况判断。
许多研究报道18F-FDG-PET在区分残余肿瘤和检测肿瘤复发方面具有高度敏感性和特异性[9-10]。有研究证实,18F-FDG-PET/CT显像动态观察发现兔VX2肺移植瘤三维适形放疗中肿瘤组织与正常肺组织的SUV比值在短期内显著降低,故可用于CT形态学改变前评估放疗早期疗效[11]。本研究证实VX2肿瘤模型经RFA治疗3 d后18F-FDG摄取值明显下降,提示18F-FDG-PET/CT可用于评估早期阶段射频治疗效果。
射频治疗后有肿瘤残留灶时,治疗区域可出现局灶性FDG摄取异常增高,这对治疗后肿瘤残存的判断有较高特异性。但18F-FDG判断肿瘤残存也有一定的假阴性,表现为射频治疗后肿瘤残存区域FDG轻中度摄取,这主要是治疗后残存肿瘤细胞代谢活性降低(细胞功能下降而非细胞坏死)、残存肿瘤区域较小或肿瘤细胞沿间质浸润生长的缘故,与炎性反应性细胞改变难以区别。
功能成像DWI-MRI及18F-FDG有不同的显像优势,对肿瘤残存检测的灵敏性较高,但也存在影响因素较多、检测特异性较低的缺点。本实验研究显示,单独DWI-MRI或单独FDG-PET/CT检查的评估结果与组织病理学诊断结果的一致性Kappa值均较低,而DWI-MRI联合PET/CT检查明显提高评估结果的特异性与准确性,与组织病理学诊断结果的一致性Kappa值明显提高。DWI出现高信号假阳性时,PET/CT显像18F-FDG摄取程度、T1和T2信号改变能校正假阳性结果,而PET/CT显像假阳性结果也可由DWI信号、T1和T2信号改变予以纠正。因此,功能成像整合可明显降低评价方法的假阳性率,进一步提高肿瘤治疗后评估的准确率。Zheng等[12]研究也认为,联合应用18F-FDG-PET/CT和DWI功能成像-常规及增强MRI,可更好地准确评估射频治疗术后早期肿瘤消融情况,以便对肿瘤复发高风险患者进行再次射频治疗干预;这对提高患者预后有重要临床价值。
总之,射频治疗后早期阶段DWI成像及18FFDG显像均已存在明显变化,ADC值和SUV值可作为评估射频早期疗效的重要参数。DWI-MRI联合FDG-PET/CT检查可弥补单一方式评估治疗区域肿瘤残存与否的不足与缺陷,明显提高诊断的准确性。
[1]Gillams AR.Image guided tumour ablation[J].Cancer Imaging,2005,5:103-109.
[2]王卫国,吴春根,程永德,等.射频消融术联合经皮椎体成形术治疗脊柱转移性肿瘤[J].介入放射学杂志,2009,18:362-366.
[3]胡继红,王会,赵卫,等.射频消融联合椎体成形术治疗脊柱转移性肿瘤12例[J].介入放射学杂志,2013,22:563-566.
[4]Ho Y,Huang Y,Lin C,et al.Application of radiofrequency ablation of renal VX2tumors by Cooled-Tip electrode in a rabbit model[J].IEEE Trans Nanobioscience,2009[Epub ahead of print].
[5]Liu Y,Lu L,Jin H.Radiofrequency ablation of liver VX2 tumor: experimental results with MR diffusion-weighted imaging at 3.0T[J].PLoS One,2014,9:e104239.
[6]Zheng SG,Xu HX,Guo LH,et al.The safety and treatment response of combination therapy of radioimmunotherapy and radiofrequency ablation for solid tumor:a study in vivo[J].PLoS One,2014,9:e96539.
[7]Yuan YH,Xiao EH,Xiang J,et al.MR diffusion-weighted imaging of rabbit liver VX-2 tumor[J].World J Gastroenterol,2005,11:3070-3074.
[8]Li Y,Shi G,Wang S,et al.Iodine quantification with dualenergy CT:phantom study and preliminary experience with VX2 residual tumour in rabbits after radiofrequency ablation[J].Br J Radiol,2013,86:20130143.
[9]Okuma T,Matsuoka T,Okamura T,et al.18F-FDG small-animal PET for monitoring the therapeutic effect of CT-guided radiofrequency ablation on implanted VX2 lung tumors in rabbits[J].J Nucl Med,2006,47:1351-1358.
[10]Suzuki H,Sekine Y,Saito K,et al.Innovative technique of transbronchial radiofrequency ablation for intrapulmonary tumors: a preliminary study in a rabbit model[J].J Bronchology Interv Pulmonol,2011,18:211-217.
[11]汪会,徐慧琴,赵学峰,等.18F-FDG PET/CT评价兔VX2肺移植瘤三维适形放疗的早期疗效[J].安徽医药,2012,16:1273-1275.
[12]Zheng SG,Xu HX,Lu MD,et al.Radiofrequency ablation before intratumoral injection of(131)I-chTNT improves the tumor-tonormal tissue ratio in solid VX2 tumor[J].Cancer Biother Radiopharm,2013,28:725-730.
FDG-PET/CT and diffusion-weighted MRI evaluation of the early therapeutic effect of radiofrequencyablation for VX2 sarcomas in rabbits
SHI Hua-zheng,LIU Shi-yuan,ZHU Hai-yun,YANG Chunshan,GAO Xin,PING Zhao-fu,SHOU Yi,HUA Wei,WU Xiang.Department of Radiology,Shanghai Changzheng Hospital,the Second Military Medical University,Shanghai 200003,China
LIU Shi-yuan,E-mail:1090830052@qq.com
ObjectiveTo discuss the value of diffusion-weighted MRI(DWI)and18F-FDG-PET/CT in assessing the early therapeutic effect of radiofrequency ablation(RFA)for VX2 sarcomas in experimental rabbits.MethodsVX2 sarcoma was inoculated at bilateral hind limbs in 14 New Zealand white rabbits to establish the animal models.The implanted VX2 tumor on one hind leg was treated with ultrasound-guided percutaneous RFA(study group),while no RFA was given to the VX2 tumor on the contralateral hind leg(control group).DWI-MRI was performed at 2 days after RFA,and18F-FDG-PET/CT examination was employed at 3 days after RFA.The mean apparent diffusion coefficient(ADC)values and standard uptake value(SUV)of the untreated tumor and the ablated tumor were separately calculated.Taking the pathologic result as the gold standard,the consistency of DWI-MRI,PET/CT as well as the combination of DWI-MRI and PET/CT with the clinical diagnosis was separately evaluated by Kappa test.ResultsBefore RFA,DWI-MRI demonstrated that the VX2 tumor was characterized by hypo-intensity signal on T1 and hyper-intensity signal on T2 with ring-shaped enhancement on T1-weighted image;PET/CT showed that the tumor had nodular or ring-shaped18F-FDG accumulation.After RFA,DWI-MRI revealed that the VX2 tumor was manifested as hyper-intensity signal on T1 and slight higher density on T1 with slight enhancement on contrast-enhanced T1-weighted image;PET/CT showed lowered accumulation of18F-FDG.The mean ADC value of the ablated tumor was(1.52±0.24)×10-3mm2/s,which was obviously higher than that of the unablated tumor,that was(1.09±0.12)×10-3mm2/s,the difference was statistically significant(P<0.05).The mean SUV value of the ablated tumor was(0.6±0.3),which was significantly lower than that of the ablated tumor(9.6±3.2,P<0.05).No significant difference in sensitivity,specificity and accuracy existed between DWI-MRI and pathology as well as between PET/CT and pathology,the Kappa value being 0.357 and 0.428 respectively(P>0.05).The Kappa value of the consistency between combination of DWI-MRI with PET/CT and pathology was 0.786,which was significantly different from the result by simple DWI-MRI or simple PET/CT evaluation(P<0.05).ConclusionBoth ADC value of DWI-MRI and SUV value of PET/CT are useful indexes for evaluating the early therapeutic effect of RFA.Both DWI-MRI and PET/CT have their respective advantages,nevertheless,combination use of both can effectively improve the evaluation of curative effect for VX2 tumor after RFA in experimental rabbits.(J Intervent Radiol,2015,24:243-247)
radiofrequency ablation;diffusion-weighted imaging;rabbit VX2 tumor;PET/CT;early effect
R735
A
1008-794X(2015)-03-0243-05
2014-12-08)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.03.015
200003上海第二军医大学长征医院影像科(石华铮、刘士远);解放军第85医院PET/CT中心(石华铮、朱海云、杨春山、高欣、平照福、寿毅、华威、吴翔)
刘士远E-mail:1090830052@qq.com
