纳米膜单铆型室间隔缺损封堵器动物实验研究
2015-10-28高力明许旭东汤佳旎谭红伟耿亮刘学波
高力明,许旭东,汤佳旎,谭红伟,耿亮,刘学波
·实验研究Experimental research·
纳米膜单铆型室间隔缺损封堵器动物实验研究
高力明,许旭东,汤佳旎,谭红伟,耿亮,刘学波
目的在室间隔缺损(VSD)犬模型中评价新型纳米膜单铆型VSD封堵器经导管植入的可行性、安全性和有效性,为临床应用提供实验依据。方法取健康成年犬26只,在开胸X线导引下通过右心室游离壁穿刺室间隔方法制备VSD模型;分为实验组(n=13,植入纳米膜单铆型VSD封堵器)和对照组(n=13,植入镍钛合金双铆型VSD封堵器)。术后1、2、3、6个月分别通过心脏大体标本、光镜、电镜检测及血镍离子浓度测定等评价新型封堵器植入后内皮化过程,观察有无残余分流、血栓形成等并发症。结果对26只犬成功建立开胸小切口VSD模型。实验组纳米膜单铆型VSD封堵器植入成功率为100%,对照组镍钛合金双铆型VSD封堵器植入成功率为91.7%。术后1、2、3、6个月分别取出25只犬心脏大体标本,观察显示两组封堵器位置均无移位,无合金丝断裂,盘面未见血栓形成和赘生物附着。术后1个月实验组封堵器双侧盘面可见薄层透亮组织覆盖,病理和电镜检查证实为纤维组织和内皮细胞;至术后6个月,盘面组织逐渐增厚,封堵器边缘与周围心脏组织融合。结论纳米膜单铆型VSD封堵器设计科学,与镍钛合金双铆型VSD封堵器相比并发症少,完全内皮化时间缩短,可有效封堵VSD,具有良好的临床应用前景。
纳米材料;室间隔穿刺;室间隔缺损;内皮化;封堵器
室间隔缺损(VSD)是最常见的先天性心脏缺损之一。2002年,秦永文等[1]报道研制出对称双盘形镍钛合金膜部VSD封堵器,并成功用于治疗膜周部VSD患者。由于临床介入治疗中发现VSD形态各异,一种封堵器往往难以适应大小、形态不一的VSD,随后又设计出细腰型及零边型等不同结构的VSD封堵器[2-4]。然而,含镍医用金属材料植入人体后会不可避免地产生腐蚀、磨损,镍离子释放到邻近组织及血液中可能产生致敏或毒性反应[5]。目前临床上广泛应用的各种类型封堵器材料基本上均为镍钛合金材料,存在潜在的不利因素和远期安全隐患,且现有封堵器左右2个盘面中央由不同于镍钛合金的不锈钢铆固定并突出于2个盘面表面,不利于盘面表面完全、快速内皮化,可能会导致盘面表面血栓形成[6],甚至出现晚期封堵器脱落[7]。为了减少镍离子释放,进一步优化VSD封堵器结构,我们与上海形状记忆合金材料有限公司合作,对镍钛合金丝材料表面作特殊处理,形成纳米膜,并采用全新编织技术设计出新型纳米膜单铆型VSD封堵器,该封堵器仅在右盘面留有固定、输送时使用的不锈钢铆钉。本研究旨在观察评价该新型VSD封堵器的近期封堵效果及其可行性、安全有效性。
1 材料与方法
1.1建立VSD动物模型
取健康成年杂交犬27只(上海市奉贤区实验动物饲养中心提供),雌雄不限,体重19.60~26.80 kg,平均(22.92±1.48)kg;以丙泊酚1.5 mg/kg静脉推注,氯胺酮10 mg/kg、地西泮0.3 mg/kg肌内注射,5~10 min即可诱导麻醉;犬呈仰卧位固定于手术床上,经口-气管插管接呼吸机,依据体重调整潮气量,充分暴露双侧腹股沟区,胸廓、四肢、骶尾部、双侧腹股沟区备皮,接心电监护电极,骶尾部接导电板;犬胸廓及双侧腹股沟区常规消毒、铺单,右侧腹股沟处穿刺股动脉,置入6 F动脉鞘管;经右侧胸骨旁第3、4肋间隙切开皮肤、皮下组织、肋间肌,于前纵隔小心暴露心包及心脏前壁,切开心包,剪取少许条状心包组织备用,暴露右室游离壁,于右室游离壁近心底部用4-0聚丙烯(prolene)缝线带自体心包组织行荷包缝合,以备穿刺;经股动脉鞘管送入6 F猪尾巴导管至左心室主动脉瓣下,经6 F动脉鞘管内芯缓慢送入钝头穿刺针,以荷包缝合中心点为进针点,首先刺破右室游离壁,继续进针,透视下使针尖指向室间隔及左室猪尾巴导管末端“圆环”,穿过室间隔后有“落空感”,保持穿刺针不再移动,鞘管内芯继续前送少许,其末端见鲜红色血液流出提示内芯头端位于左心室内,退出穿刺针,经鞘管内芯送入左房钢丝,透视下可见左房钢丝于左室内弯曲呈环,犬VSD模型建立成功(图1)。仅1只实验犬结束手术后处死,取出心脏标本后证实穿刺点是否符合VSD模型;余26只犬暂保留左房钢丝。

图1 室间隔穿刺建立犬VSD模型
1.2封堵器及输送系统设计
实验组(n=13)植入的纳米膜单铆型VSD封堵器及相应负载系统、对照组植入的镍钛合金双铆型VSD封堵器,均由我院心内科与上海形状记忆合金材料有限公司合作设计研制。以专利技术方法制成的纳米膜单铆型封堵器采用具有超弹性镍钛合金丝,通过热处理及化学表面处理将多层不均匀氧化膜均匀化,得到均匀致密且较薄的氧化膜,形成纳米级钛氧化膜,双侧盘面呈圆形且对称;封堵器左侧盘面平整,右侧盘面中央略凹陷,由316 L不锈钢钢套收紧合金丝,钢套另一端有可与负载系统连接的螺母;封堵器盘面共有4层聚氨酯膜;7 F输送鞘管与外科用国产小切口VSD输送鞘管相同。对照组(n=13)镍钛合金双铆型封堵器的合金丝直径、规格与临床上现有封堵器相同;封堵器左侧盘面平整,中央有一不锈钢铆,右侧盘面与实验组单铆型封堵器右侧盘面相同。
1.3VSD封堵器植入过程
沿模型制备中保留的左房钢丝送入7 F小切口专用输送鞘管至左室内,退出左房钢丝及扩张鞘。实验组和对照组封堵器均于螺母连接的推送杆负载送入至输送鞘内,透视下先后释放左室及右室盘面。两组封堵器释放方法相同,即逆时针旋转推送杆手柄,使螺母与封堵器分离并完成释放;分别于LAO 45°、头位25°投照位及后前位造影观察记录封堵器位置、形态(图2)。术后肌内注射青霉素160万U/d,连续5 d,预防感染;皮下注射低分子量肝素钙0.1 ml,每日2次共3 d;喂服阿司匹林肠溶片每日5 mg/kg,直至处死。术后1、2、3个月处死每组实验犬各2只,大体观察封堵器位置、形态及盘面组织覆盖情况,术后6个月将两组剩余实验犬全部处死。术后3、6个月予以经胸壁超声心动图(TTE)检查。
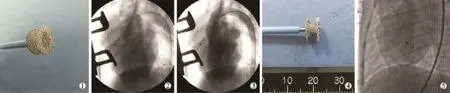
图2 两组VSD封堵器装载及植入后
1.4观察指标
1.4.1封堵器植入成功率术后即刻评价封堵器植入成功率,分别记录两组封堵器装载、释放所需操作时间、完成封堵器植入时间。
1.4.2术后TTE检查术后3、6个月实验犬经氯胺酮麻醉后行TTE检查,观察两组封堵器位置、有无残余分流及对主动脉瓣、二尖瓣、三尖瓣等组织结构有无影响。
1.4.3心脏大体标本观察术后1、2、3、6个月按预定实验节点将犬处死,观察封堵器位置是否正确,封堵器表面组织和内皮覆盖情况,表面有无血栓、赘生物,合金丝有无断裂等。
1.4.4组织学检查术后6个月取封堵器及组织标本作组织学检查,取样肺、肝、脾、双肾等脏器行HE染色并观察有无血栓栓塞、炎性变化等表现。
1.4.5样品制备及检查术后3、6个月分别取封堵器双侧盘面组织各1块行扫描电镜检查,观察封堵器表面组织覆盖情况及内皮细胞形态,了解盘面内皮化是否完全。
1.4.6血镍含量测定术前及术后7、15、30 d分别留取实验犬全血标本于抗凝试管内并保存在-80℃冰箱,以备检测术前术后不同时间点全血镍浓度差异及变化趋势,了解纳米膜镍钛合金丝对术后镍释放及血镍含量的影响。全血镍含量测定由上海交通大学分析测试中心协助完成。测试前取全血标本约5 ml称重,硝解后采用电感耦合等离子体质谱法(ICP-MS)经美国Agilent 7500a型电感耦合等离子体质谱仪测定。
1.5统计学处理
采用SPSS 16.0统计软件进行统计学分析。计量资料以±s表示,两组间操作时间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1封堵器植入成功率
实验组13只犬均顺利植入纳米膜单铆型封堵器,对照组1只犬在封堵器植入中因操作不当造成封堵器与二尖瓣腱索缠绕,无法完成植入,其余12只犬均顺利植入双铆型封堵器,即刻成功率为91.7%。封堵器装载至完成释放的平均时间,实验组为(2.4±0.2)min,对照组为(2.6±0.2)min,两组间差异无统计学意义(P=0.526)。
2.2TTE检查
术后3、6个月TTE检查心尖四腔心切面显示,两组封堵器均位于室间隔、无移位,双侧盘面显示清楚。实验组封堵器盘面平整,未见血栓及赘生物附着;对照组封堵器双侧不锈钢铆可清晰显现,盘面及周围未见血栓和赘生物。两组封堵器盘面周围均未见残余分流。所有封堵器对主动脉瓣、二尖瓣、三尖瓣开闭无影响,瓣口流速正常。犬房室结构无明显变化,心功能左室射血分数(LVEF)值正常。(见图3)
2.3大体解剖
2.3.1实验组封堵器植入位置理想,三尖瓣、二尖瓣不受影响。术后1个月标本可见双侧盘面均有一薄层透亮组织覆盖,盘面边缘部分与周围组织融合,无血栓和赘生物;术后2个月标本显示双侧盘面上覆盖的组织逐渐增厚,盘面边缘与周围房间隔组织融合处盘面组织略厚;术后3个月,双侧盘面上的组织明显增厚(见图4)。

图3 两组封堵器术后3个月TTE检查

图4 术后不同时间纳米膜单铆型封堵器大体标本图示
2.3.2对照组封堵器术后1个月标本显示封堵器盘面覆有薄层透明组织,盘面边缘组织部分与周围组织融合,左盘面中央铆钉无组织附着,周围盘面亦可见薄层透亮组织覆盖。术后2、3个月标本显示盘面组织覆盖逐渐增厚(见图5)。
2.4组织学检查
2.4.1光镜检查术后6个月光镜检查两组封堵器左、右盘面组织显示,封堵器表面被纤维组织和内皮细胞覆盖,可见少量慢性炎性细胞存在。经染色,封堵器双侧盘面组织覆盖情况无明显差异。
2.4.2电镜检查两组封堵器盘面内皮细胞均完整覆盖,两组间无明显差异。术后6个月盘面内皮细胞数量与术后3个月相比较多,排列紧密;内皮细胞下为纤维组织,不同部位的内皮细胞形态略有不同,典型形态呈鹅卵石样,主要分布于血流冲击较小的盘面部位,受血流冲击较大部位的形态呈梭形(见图6)。
2.5血镍含量测定
两组VSD封堵器植入术前及术后不同时间全血镍含量见表1。两组术前全血镍含量无明显差异,术后7 d均明显上升,此后呈下降趋势,术后3个月时已逐渐降至术前水平。两组术后7、15、30 d全血镍含量均较术前显著升高,P<0.05。术后7 d纳米膜单铆型封堵器组全血镍含量显著低于镍钛合金双铆型封堵器组(P<0.05),术后15、30 d两组间全血镍含量无显著差异。
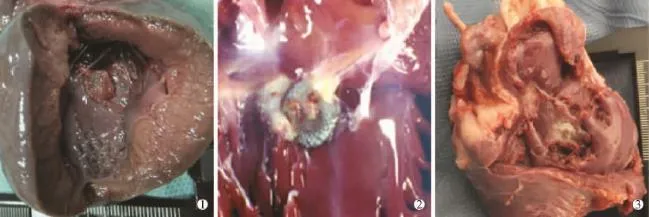
图5 术后不同时间双铆型封堵器大体标本图示

图6 术后3个月封堵器扫描电镜检查

表1 封堵器植入后不同时间实验犬血镍含量(μg)
3 讨论
本研究采用专利技术制成的纳米膜单铆型VSD封堵器,与临床上广泛应用的Amplatzer VSD封堵器相比,具有以下特点:①采用的镍钛合金丝具有良好的弹性恢复能力,通过热处理及化学表面处理将多层不均匀氧化膜均匀化,得到均匀致密且较薄的氧化膜,形成纳米级钛氧化膜均匀包裹,可达到抑制镍离子析出的目的;封堵器双侧盘面呈圆形、规格相同、左侧盘面平整无突起的设计,有利于封堵器快速内皮化,尤其是左侧盘面内皮化,减少左侧盘面表面血栓形成可能,从而减少封堵术后并发症。②合金丝规格及内置无纺布均与临床上广泛应用的封堵器相同,植入后不会改变其组织相容性和细胞相容性[8]。③输送系统与临床上现有封堵器输送系统完全相同,螺母式装载方法确保了封堵器推送过程中连接的可靠性,对封堵器结构影响小,操作方便,释放、回收自如。
受操作技术等因素影响,本组研究的封堵术后即刻技术成功率在实验组为100%,对照组为90%;封堵器装载至完成释放的平均时间在实验组为(2.4±0.2)min,对照组为(2.6±0.2)min,两组间差异无统计学意义(P=0.526)。其原因可能在于两组封堵器装载方法相同、输送鞘管相同、释放封堵器操作手法相同。
本研究显示,术后1个月两组封堵器左盘面组织覆盖情况已有不同,对照组封堵器左盘面中央有突起的不锈钢铆钉,铆钉本身距离盘面边缘相对较远,且与盘面呈约90°角,不利于封堵器周围组织细胞爬行或血液中细胞因子黏附[9]。术后2、3个月两组封堵器盘面上覆盖的组织厚度随时间逐渐增加,盘面边缘与周围心室组织的融合逐渐增多。两组封堵器右侧盘面结构相同,术后1个月观察到右侧盘面完全覆盖有一层白色透亮组织,右侧螺母型钢铆上覆盖的组织厚度略薄,不锈钢铆钉与盘面过渡处覆盖的组织略厚[10]。实验组封堵器左侧盘面平整,术后1个月即可观察到内皮化[11],对照组左侧盘面术后1个月仍未观察到铆钉上有组织附着,术后6个月铆钉上有组织完全附着。电镜检查证实,封堵器表面组织主要由成纤维细胞和内皮细胞组成[12]。大体标本检查结果提示,纳米膜单铆型封堵器设计有利于纤维组织和内皮细胞附着,内皮化快速、完全(单铆结构本身利于快速内皮化[13]),而纳米膜结构是否有利于快速内皮化,本研究中无对照;对照组右侧盘面内皮化进程早于左侧,其原因可能是右侧螺母型铆钉形态较左侧铆钉复杂,内有螺纹(细胞因子和内皮细胞可能更容易附着在内有螺纹的右侧铆钉上[13]),而左侧铆钉头圆、光滑。封堵器表面是否内皮化与封堵术后一些并发症发生密切相关。这是因为封堵器内皮化可避免封堵器与血流直接接触[14-15],使血流平稳,减少不良刺激,从而有效防止血栓形成[14]、与室间隔相互摩擦引起纤维组织大量增生及晚期或极晚期封堵器脱位[7]。血镍离子测定结果显示,实验组血镍浓度上升慢,植入后镍离子释放慢,血镍浓度能维持较低水平,并随组织内皮化后趋于相同。本研究证实,镍钛合金丝通过热处理及化学表面处理后,其多层不均匀氧化膜得到均匀化,形成纳米级氧化膜,从而达到抑制镍离子析出的目的。
本实验研究存在以下不足之处:①VSD犬模型构建后即刻进行封堵术,犬心脏尚未经受长期血流动力学变化的影响,这与临床VSD情况存在差异。由于人工建立的VSD有自发闭合倾向,尚不能明确术后无残余分流与自发闭合有关。②封堵器植入术后未能取得更早期的标本,未能观察到短时间内封堵器表面情况。
总之,本研究结果提示,纳米膜合金丝全新编织研制并经特殊处理的新型单铆型VSD封堵器设计科学,封堵成功率高,具有良好的生物相容性;与双铆型VSD封堵器相比,能够抑制镍离子析出,完全内皮化时间缩短,可有效封堵VSD,具有良好的临床应用前景。
[1]秦永文,赵仙先,李卫萍.应用自制封堵器经导管闭合膜部室间隔缺损[J].介入放射学杂志,2002,11:130-131.
[2]秦永文,赵仙先,吴弘,等.自制非对称型室间隔缺损封堵器的初步临床应用[J].介入放射学杂志,2004,13:101-103.
[3]秦永文,赵仙先,徐荣良,等.应用自制封堵器经导管闭合膜部室间隔缺损[J].中华心血管病杂志,2003,31:28.
[4]Gu MB,Bai Y,Zhao XX,et al.Transcatheter closure of postoperative residual perimembranous ventricular septal defects[J].Ann Thorac Surg,2009,88:1551-1555.
[5]Anselmino M,Ribezzo M,Orzan F.Nickel allergy,how deep?[J]. Acta Cardiol,2009,64:104-106.
[6]Retzer EM,Dill KE,Shah AP,et al.Novel transcatheter closure of an iatrogenic perimembranous ventricular septal defect[J]. Catheter Cardiovasc Interv,2015,85:161-165.
[7]Chen F,Zhao X,Zheng X,et al.Incomplete endothelialization and late dislocation after implantation of an Amplatzer septal occluder device[J].Circulation,2011,124:e188-e189.
[8]Armitage DA,Parker TL,Grant DM.Biocompatibility and hemocompatibility of surface-modified NiTi alloys[J].J Biomed Mater Res A,2003,66A:129-137.
[9]Foth R,Quentin T,Michel-Behnke I,et al.Immunohistochemical characterization of neotissues and tissue reactions to septal Defect-Occlusion devices[J].Circ Cardiovasc Interv,2009,2:90-96.
[10]Ding ZR,Qin YW,Hu JQ,et al.A new pan-nitinol occluder for transcatheter closure of ventricular septal defects in a canine model[J].J Interv Cardiol,2009,22:191-198.
[11]Sigler M,Jux C.Biocompatibility of septal defect closure devices[J].Heart,2007,93:444-449.
[12]Ahn E,Luk A,Mezody M.Early morphological changes of an Amplatzer Septal Occluder explanted at heart transplant[J]. Cardiovasc Pathol,2009,18:57-60.
[13]高力明,宗书峰,游晓华,等.左盘无铆型卵圆孔未闭封堵器的实验研究[J].介入放射学杂志,2012,21:833-838.
[14]Ries MW,Kampmann C,Rupprecht HJ.Nickel release after implantation of the Amplatzer occluder[J].Am Heart J,2003,145: 737-741.
[15]Burian M,Neumann T,Weber M,et al.Nickel release,a possible indicator for the duration of antiplatelet treatment,from a nickel cardiac device in vivo:a study in patients with atrial septal defects implanted with an Amplatzer occluder[J].Int J Clin Pharmacol Ther,2006,44:107-112.
Nano material occluder of single rivet type used for percutaneous closure of ventricular septal defect:an experimental study in dogs
GAO Li-ming,Xu Xu-dong TANG Jia-ni,TAN Hong-wei,GENG Liang,LIU Xue-bo.Department of Cardiology,Affiliated Oriental Hospital,School of Medicine,Tongji University,Shanghai 200120,China
LIU Xue-bo,E-mail:lxb70@hotmail.com
ObjectiveTo evaluate the feasibility,efficacy and safety of new nano material occluder of single rivet type(left-disk with no-hub)in treating ventricular septal defect(VSD)in order to provide experimental basis for clinical application.MethodsA total of 26 healthy adult dogs were selected for this study.Under thoracotomy,VSD model was established through fluoroscopically-guided percutaneous puncturing of the right ventricular free wall.The models were randomly and equally divided into the study group(n=13,using nano material VSD occluder)and the control group(n=13,using double-hub nitinol occluder).Every two dogs from each group were sacrificed each time at one,2,and 3 months after percutaneous closure of VSD with corresponding occluder,the tissue samples were collected and sent for gross examination as well as for the optical and electronic microscopy study;the blood concentration of nickel ion was also determined.The state of endothelialization after implantation of the new type occluder was evaluated,and the complications such as residual shunt and superficial thrombus formation were recorded. The results were analyzed.ResultsBy open chest operation with small incision and percutaneous puncturing of the right ventricular free wall,VSD model was successfully established in all 26 dogs.The success rate of the implantation of the VSD occluder in the study group was 100%,while it was 91.7%in the control group.One,2,3 and 6 months after the implantation,the heart specimens of 25 dogs were removed and gross examination showed that neither occluder displacement nor alloy wire fracture occurred in both groups.No thrombus formation or vegetation attached on the disk surface was observed.One month after the procedure,in the study group the bilateral disk surfaces of the occluder were covered with thin layer transparent tissue,which were proved to be composed of the fibrous tissue and endothelial cells through pathologic and electronic microscopy study.Six months after implantation,the superficial tissue of the occluder became further thickened and the occluder edge became fused with the surrounding heart tissue.ConclusionThe design of the new VSD nano materials occluder,which has a left-disk with no hub,is very scientific.Compared with double-hub nitinol occluder,the new device can shorten the time of complete endothelialization and effectively occlude the VSD.Therefore,this new nano material occluder has promising prospect in clinical application.(J Intervent Radiol,2015,24:509-514)
nano material;ventricular septal puncture;ventricular septal defect;endothelialization;occluder
R541.1
A
1008-794X(2015)-06-0509-06
2014-11-24)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.06.011
200120上海同济大学附属东方医院心内科
刘学波E-mail:lxb70@hotmail.com
