海带中有害元素As的研究现状及展望
2015-10-28杨庆樊亚鸣曾源关灼斌何芝洲杨宜婷吴晓童陈怡莎
杨庆,樊亚鸣,*,曾源,关灼斌,何芝洲,杨宜婷,吴晓童,陈怡莎
(1.广州大学化学化工学院,广东广州510006;2.无限极(中国)有限公司,广东广州510623)
海带中有害元素As的研究现状及展望
杨庆1,樊亚鸣1,*,曾源1,关灼斌1,何芝洲1,杨宜婷2,吴晓童1,陈怡莎1
(1.广州大学化学化工学院,广东广州510006;2.无限极(中国)有限公司,广东广州510623)
就我国近海海带中砷含量、砷的存在形态及其毒性、国内外相关标准中砷的限量、砷检测方法及脱砷技术等5方面的问题,综合阐述并分析前人对海带中有害元素砷的研究状况。据此,并结合我们的工作,提出关于海带脱砷研究的现状、面临的问题及可能的前景:根据砷的价态、形态及毒性机理,海带中具有毒性的砷的形态为无机砷;我国国标(2005版)对干海藻无机砷的限量(≤1.5 mg/kg),而国产海带无机砷含量已超国标;提取分离技术是海带深加工产业的基石,此过程实际上富集了提取物中的砷,在国内外少有海藻提取物砷限量的背景下,建议参照国际食品添加剂标准中特定海带提取物中无机砷限量(≤3 mg/kg)。
海带;砷;测砷技术;限量标准;脱砷技术
海带(Laminaria japonica Aresch),别名昆布、江白菜,属褐藻门、海带目、海带科、海带属植物,在我国,其产地主要分布在福建、山东、辽宁、浙江、广东等沿海地区。海带产量占我国的全部养殖海藻总量的约60%,其价格低廉,来源广泛,是具有我国特色的大宗海藻产品。据德国科学家研究,海带中含有60多种营养成分,如多糖、多不饱和脂肪酸、多酚、甘露醇、海盐、海藻酸钠、膳食纤维,碘、钙及铁等,是天然保健食品资源[1-2]。然而,海带具的富集海洋中有害元素砷的特性,加之我国大陆架附近水体环境中砷含量问题日益严重,海带中砷超标已成为安全隐患,这极大限制了海带及其深加工产品的使用,并直接影响到我国海藻酸钠、甘露醇等主要产品的出口。
1981年,国际癌症研究委员会(International Agency for Research on Cancer,IARC)将砷列为人类致癌物质后,有关藻类中砷的研究一直是热点[3],资料表明砷除了对皮肤有损害作用和基因毒性外,还能增加肺癌、皮肤癌和膀胱癌的患病几率[4-5]。1988年FAO/WHO推荐JECFA提出无机砷的暂定每人每周允许摄入量(PTWI)为0.015 mg/kg mb[6],以人体重60 kg计,即每人每日允许摄入量(ADI)无机砷为0.129 mg。2009年,欧盟食品安全局(European food safety authority,EFSA)设定的砷可信下限(BMDL)为0.000 3 mg/(kg·d)~0.008 mg/(kg·d),高于此限量被证明有致癌作用[7],由此可见欧盟标准严于FAO/WHO的。需要注意的是:国际上对砷的卫生学评价均以无机砷为依据。以上标准的出台,为控制海带砷含量奠定了理论依据。在此基础上,前人进行了大量了研究,我们将其归纳为:1、研究我国近海海带中砷含量水平,确认其中砷污染严重;2、研究海带中砷的存在形态及其毒性;3、研究国内外标准对海带及其加工产品中砷的限量;4、研究适于海带中砷含量测定的方法;5、研究海带的脱砷技术。以下将分5点综述前人研究结果,探讨我国海藻中砷的食品卫生标准与国际标准的异同,提出我们对海带中有害元素As的研究现状的评价,结合我们的研究结果,提出对此研究领域的展望。
1我国近海海产品中砷含量的水平
国内对海产品中所含重金属的研究主要集中在汞、镉、铅等上,随着水环境质量的下降,对海产品中砷的研究越来越重要。表1列出了我国部分海产品中不同形态砷的含量分布[8]。
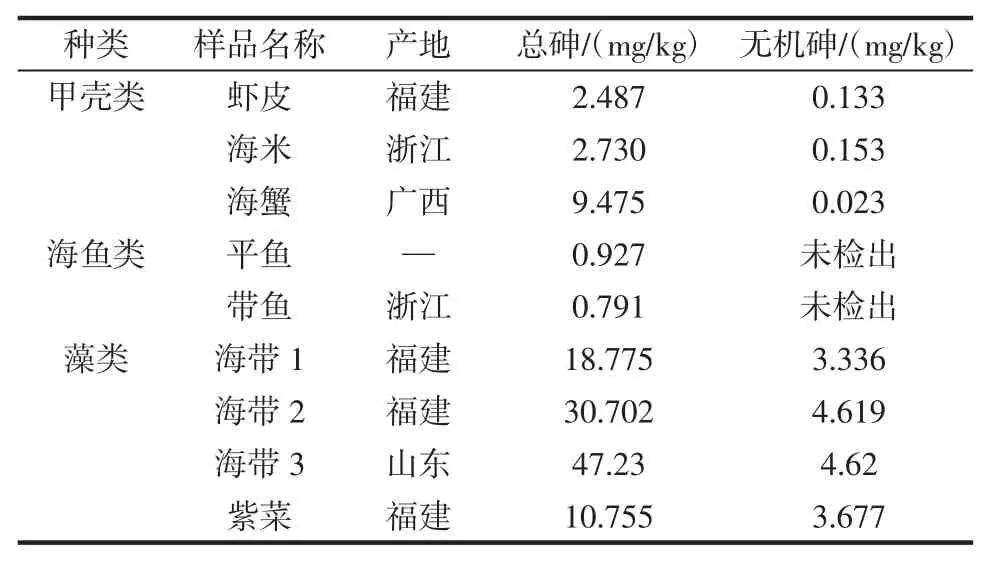
表1 我国部分水产品中总砷和无机砷含量分布Table 1The distribution of total arsenic and inorganic arsenic content in part of aquatic products in China
表1数据显示,在3类海产品甲壳类、海鱼类及海藻类中,藻类中总砷及无机砷含量均较高,因而研究海藻砷及其脱砷技术具有实际意义。值得注意的是:海带中无机砷含量已超过国标限量[9]。
杨钊等[10]采用HG-AFS方法对7种产于山东的藻类总砷和无机砷进行了测定,其结果如表2。
从表2可知,7种藻类除石花菜外,总砷含量都很高;无机砷含量以海藻、海带根和海带为高,海带根与海藻中无机砷含量超过国家标准。这反映了我国大陆架附近水环境的污染状况及海带中砷严重超标的现状。
表27 种藻类中总砷和无机砷的测定结果(产地:山东)(n=6,±s)Table 2The determination results of total arsenic and inorganic arsenic in seven kinds of algae(origin:shandong)
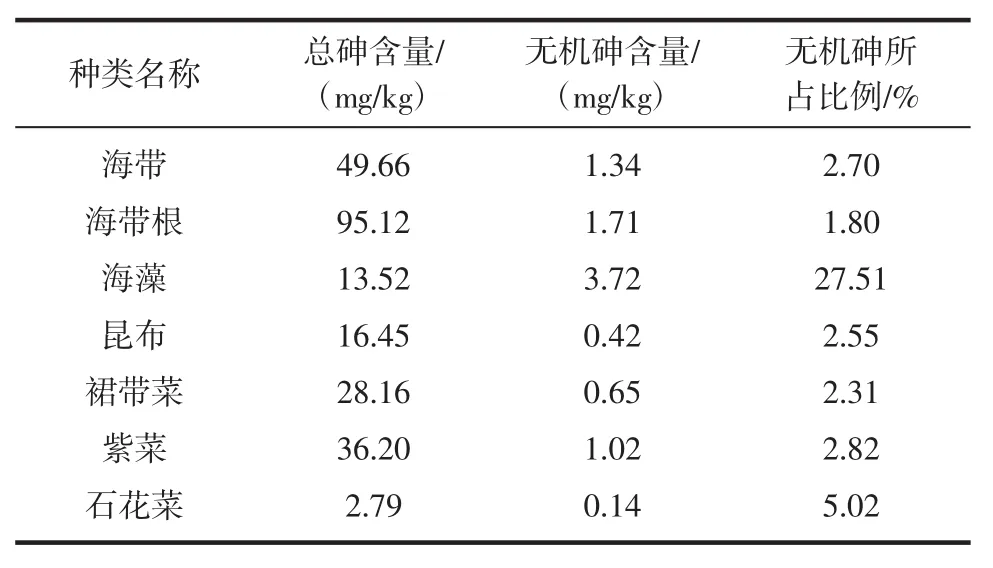
表27 种藻类中总砷和无机砷的测定结果(产地:山东)(n=6,±s)Table 2The determination results of total arsenic and inorganic arsenic in seven kinds of algae(origin:shandong)
种类名称总砷含量/(mg/kg)无机砷含量/(mg/kg)无机砷所占比例/%海带海带根海藻昆布裙带菜紫菜石花菜49.66 95.12 13.52 16.45 28.16 36.20 2.79 1.34 1.71 3.72 0.42 0.65 1.02 0.14 2.70 1.80 27.51 2.55 2.31 2.82 5.02
2海带As存在的形态以及毒性
2.1砷的存在形式
砷在自然界分布广泛,1926年Chapman[11]从牡蛎和虾中分别检出砷含量为310 mg/kg和174 mg/kg,后陆续从鱼、甲壳类、贝类、软体动物、海藻类等海洋生物中检出2 mg/kg~1 000 mg/kg以上的砷[12-15]。砷可表现出多种价态,最常见的是-3、+3和+5价。在生物中较为重要的砷化合物形式为有机砷和无机砷,整个生物循环中又以含甲基的有机砷化合物最为重要[16],如甲基胂酸、二甲基次胂酸、三甲基胂酸、一甲基胂、二甲基胂和三甲基胂等。在海藻类生物中,也以有机态砷为主[17],一般而言,有机砷约占总砷含量的80%以上。有机砷可进一步分为水溶性砷和脂溶性砷,水溶性砷的量高于脂溶性砷。水溶性砷不同于汞、镉、铜等重金属,这些重金属在生物体内容易与蛋白质结合,而砷几乎不与蛋白结合。虽然有机态砷在海藻类生物中毒性较小且所占比例大,有人认为危害极小,但也不能完全忽视,因为无机砷与有机砷之间转化机制至今尚未弄清。
2.2砷的化学形态
无机砷的化学形态有砷酸、亚砷酸及其盐的形式;而有机砷的化学形态经过了长期的研究。1977年由Edmonds等[18]从龙虾中分离出水溶性砷化合物,经确定为砷甜菜碱(Arsenobetaine,简写AsB)。从海产品中还确定出砷胆碱(Arsenochline,简写AsC)、三甲基氧化砷(Trimethylarsine oxide)、四甲基砷离子(Tetramethylarsonium ion)、砷糖(Arsenosugars)、砷脂(Arsenolipid)、二甲基砷酸(Demethylarsinic acid)等7种化合物。砷甜菜碱在海洋无脊椎动物和脊椎动物中普遍存在[19-20],是海洋动物体内目前所发现的最主要砷的化学形态,但在海藻中尚未发现AsB。藻类中的有机砷主要以砷糖形式存在,砷糖是目前发现的藻类生物合成中结构最为复杂的水溶性砷化合物,砷糖有(As-Ⅰ~As-Ⅵ)6种结构不同的衍生物。Edmonds等[21]最早从褐藻中发现了3种水溶性砷化合物,经色谱分离、元素分析、NMR等测定,确定砷糖As-Ⅰ、As-Ⅱ、As-Ⅲ等3种衍生物,昆布、裙带菜及海带中含As-Ⅰ、As-Ⅱ、As-Ⅲ;洋栖菜中含为As-Ⅰ、As-Ⅲ、As-Ⅵ、As-Ⅴ[22]。6种砷糖的结构如下:
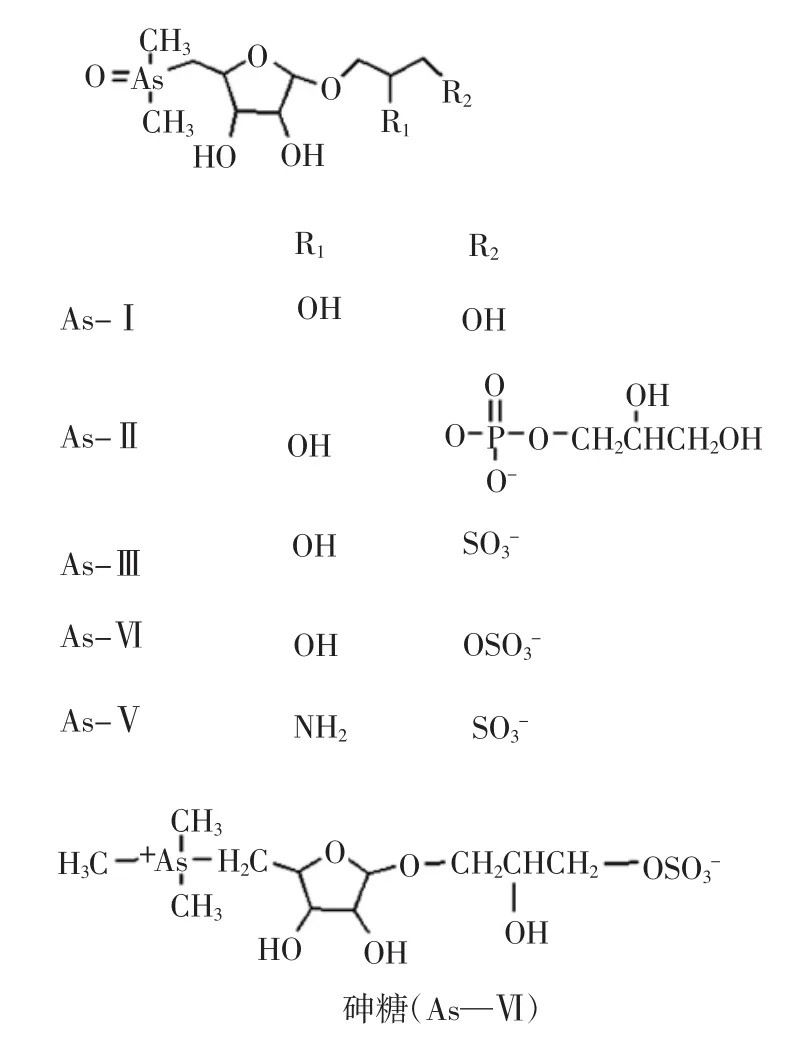
砷糖基本属于无毒物质,但它在一定条件下可水解为无机砷和糖,转为有毒物质,故不能轻视。
2.3砷的毒性
砷的毒性与生物化学循环及化学形态密切相关。元素砷毒性很低,而砷化合物均有毒性,其毒性排序如AsH3>As3+>As5+>RAsX>As。砷是一种胞浆毒物,体内三价砷易与巯基结合形成稳定的络合物,从而阻碍细胞呼吸,使细胞代谢发生障碍,并对多种酶有抑制作用,如丙酮酸氧化酶、羧化酶、α-酮戊二酸氧化酶、苹果酸氧化酶、ATP酶及胆碱酯酶等,从而引起神经系统、肝脏、肾脏等重要器官发生病变;另外,砷酸可取代正常生化反应中的磷酸,参与氧化磷酸化过程,影响细胞的能量代谢;砷进入血液循环后,可直接损害毛细血管或作用于血管舒缩中枢,引起血管壁通透性的改变[16];以不同方式接触不同形式的砷,可诱发多种肿瘤如乳腺癌、膀胱癌、消化系统癌肿、腹膜及生殖器官肿瘤、淋巴肉瘤、血管肉瘤、口腔癌、骨癌、脑癌及肝癌等。虽然WHO分别于1978年、1980年和1982年确认无机砷为致癌物,但砷的致癌机制至今尚未完全阐明[23-24]。由砷的毒性机理可知,有区别地测定总砷与无机砷,是评价海带中砷危害的客观度量,也是我国制定食品中砷限量依据的基础。
3海带砷的检测方法
根据GB/T 5009.11-2003《食品中总砷及无机砷的测定》,总砷的测定方法有氢化物原子荧光光度法、银盐法、砷斑法、硼氢化物还原比色法。总砷的检出限:氢化物原子荧光光度法:0.01mg/kg,线性范围为0 ng/mL~200 ng/mL;银盐法:0.2 mg/kg;砷斑法:0.25 mg/kg;硼氢化物还原比色法:0.05 mg/kg。无机砷的测定方法有原子荧光光谱法、银盐法,无机砷的检出限:原子荧光光谱分析法:固体试样0.04 mg/kg,液体试样0.004 mg/L;银盐法:0.1 mg/kg。线性范围:0.001 mg~0.01 mg。近年发展起来的检测方法有光谱法、电分析法(EA)、质谱法(MS)、中子活化分析(NAA)、色谱法等[25],随着样品处理手段的丰富和发展,检测仪器和测定方法的改进和优化,水产品无机砷的测定准确度、精密度和检出限都在不断改善[26-32]。对于无机砷的检测,我们认为采用氢化物原子荧光光度法具有谱线简单、灵敏度及精确度高、检出限低、操作简单等特点[32],但检测设备较昂贵;而银盐法耗时耗力,灵敏度低,操作复杂,但设备要求不高。
我们研究表明,在相同的的仪器设备条件下,测总砷的关键在于样品消解程度,因其直接关系到结合态砷是否完全转化为游离态砷,判断消解完全的方法:将消解后样品进行灼烧实验,如残留固体接近白色,说明消解完全,如为黄色或黑色则消解不完全;测无机砷的关键则是在萃取无机砷时,防止有机砷的酸水解:国标法萃取样品中的无机砷需在60℃恒温水浴下,用6 mol HCl浸提,然后在2 mol HCl条件下进行测定。Wei等[27]发现,在中性条件下,紫菜中的砷糖加热至100℃时无显著变化,但在0.1 mol/L HCl及0.5 mol/L HCl条件下加热时,砷糖分别在温度大于15℃和50℃时分解;相同条件,海带中砷糖未分解。由此可见,较高温度、酸性条件下海藻砷糖不稳定,可能分解成无机砷而影响无机砷的测定结果。我们建议在检测海带中无机砷含量时,在一定温度下,先设计一个HCl的浓度梯度实验,确定不水解有机砷的最佳盐酸浓度及温度,以保证测定结果的可靠性。
4砷含量的限量标准
国际上食用海藻的国家主要集中在亚洲,主要是日本韩国等[33]。可能由于海洋环境的原因,国际上食品法典标准、欧盟法规指令(EC466/2001)以及美国、日本、韩国、CAC标准等均未对藻类产品中的总砷、无机砷以及其它重金属指标进行限量规定。
在我国,由卫生部修订并于2005年1月25日发布的GB2762-2005《食品中污染物限量》[34]、GB19643-2005《藻类制品卫生标准》中规定藻类制品中“无机砷”限量,最新版国标GB2762-2012《食品安全国家标准食品中污染物限量》对藻类砷的含量限量规定仍然沿用2005年版标准。表3为2005年版国标对食品中砷的限量:
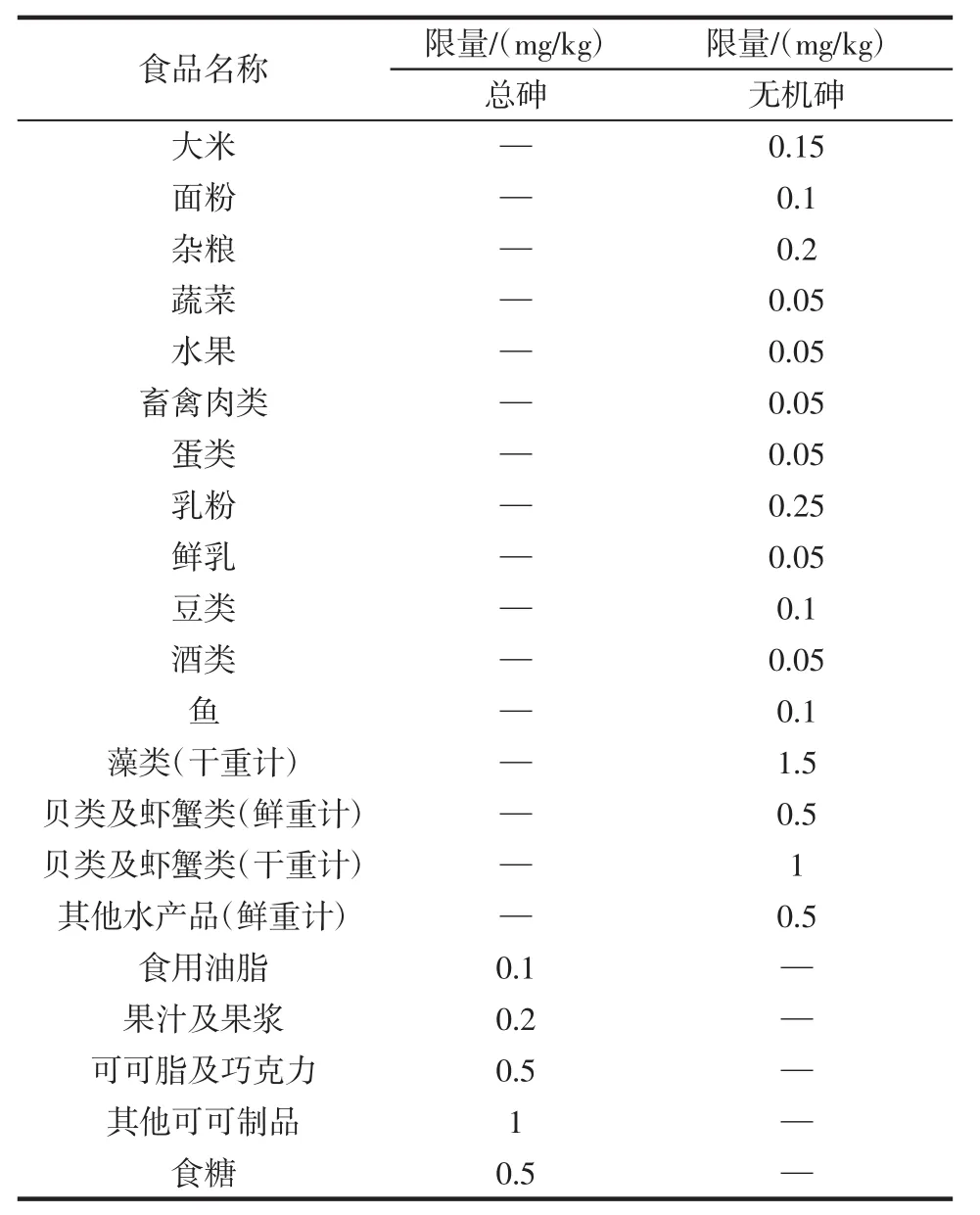
表3 2005年版中国国家标准对食品中砷限量的指标Table 3The national standard limited index of arsenic in food of Chinese edition 2005
由表3可见,国标对食品含砷限量依品种不同而具有无机砷及总砷两种,以毒性明确的无机砷限量最为常见。在所列食品中,以干燥藻类的无机砷限量最高,达1.5 mg/kg。分析表1、表2中海带或海藻中无机砷含量及表3中国标限量可知,直接食用海带(以每人每天食用200 g计),无机砷不会超标。
据报道[6]:我国大部分人群每日食物中无机砷摄入量在0.075 45 mg以下,而FAO/WHO规定的人均每日食物中无机砷的最大摄入量为0.129 mg,并不超过FAO/WHO建议的允许摄入量,还留有饮水等余地(我国尚未制定饮用水中无机砷的限量卫生标准),最新国标GB 2762-2012《食品安全国家标准食品中污染物限量》表明包装饮用水总砷为0.01 mg/L。
而以海带为原料的提取物产品如甘露醇、海藻酸钠、海带多糖、多酚及多不饱和脂肪酸等,则可能因提取分离过程的富集作用使无机砷超标,故海带加工前后产品的砷限量应该不同。在此思路下,我们发现国际标准、国标与《中国药典》均未对海藻(包括海带)提取物作出砷限量规定,而凌关庭[35]关于特定海藻提取物砷限量有以下国际标准,如表4。
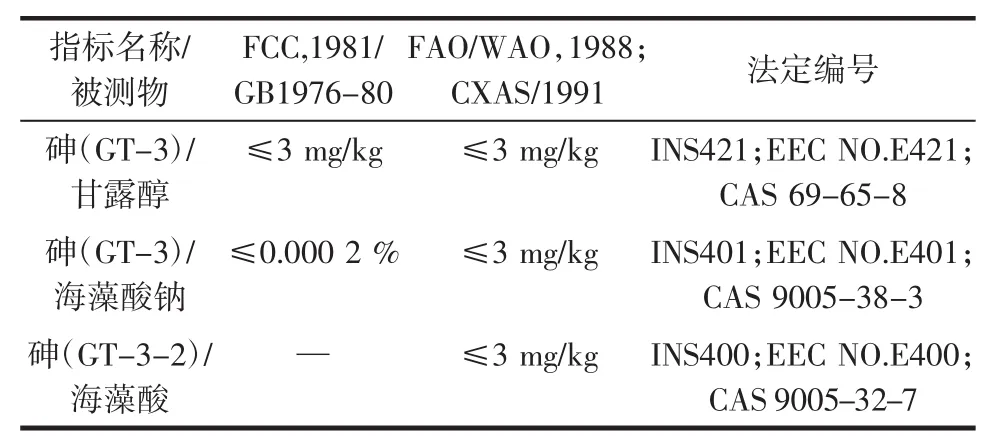
表4 食品添加剂标准中特定海带提取物中砷的限量表Table 4The limited index in food additives standard of arsenic in seaweed extract
由表4可见,特定海带提取物中砷的限量确实高于干海带,通常为3 mg/kg。我们认为:在目前可参照的标准中,以国际食品添加剂标准来控制海带提取物中无机砷含量,是较为可行的。
5脱砷技术
目前,海产品脱砷技术的研究分以下四方面:(1)改变养殖环境:消除贝类重金属污染的主要方法是把已污染的贝类运往清洁无污染的海区进行暂养[36];在贝类暂养或净化水中加入与脱重金属残留的多糖配合物或微藻活体[37-38]等。(2)酸碱脱砷:姜桥等[39]研究了海藻脱砷方法:分别用盐酸、醋酸、碱、水和沸水对海藻原植物进行处理,结果显示处理效果与盐酸的浓度有关,在相同的时间内,盐酸浓度越高,处理后海带中无机砷的含量越低;与醋酸浓度有关:醋酸溶液的浓度越高,海带中无机砷含量降低越明显;醋酸的处理效果低于盐酸;碱溶液的浸泡处理也能显著降低砷含量,但会破坏海藻中的多数营养成分;沸水与冷水浸泡处理的效果不够理想。(3)络合剂脱砷:舒本胜等[40]以总砷和无机砷脱除率为考察指标,以3%柠檬酸为脱除剂,条件为料液比1∶15(g/mL)、温度40℃、时间40 min,总砷脱除率达到65.71%,无机砷脱除率达到74.39%,灰分和矿物质元素含量有所减少,且未对营养成分造成影响;陈后山等[41-42]将羊栖菜用50℃温水清洗、破碎、在酶解锅中加水、添加0.1%~1%的EDTA,50℃保温30 min~60 min,结果表明羊栖菜中无机砷含量小于0.3 mg/kg,低于国标限量值。(4)氧化脱砷:郑婵颖[43]使用双氧水处理,有效减低羊栖菜中砷含量。
以上海藻脱砷技术的优点:针对海产品或海藻原植物,去除总砷与无机砷的方法是有效的,其中络合剂型的脱砷剂效果较好,不破坏海产品中有效成分;存在的问题:首先,脱砷基本上是针对海藻原植物而言,而基于水溶液的脱砷实际上也脱除了海藻表面的水溶性的成分,如甘露醇、海盐等,或影响到产品的营养性及风味;第二,对于海藻提取物产品,由于提取过程可能富集原料中的砷含量,目前尚无有针对性的适于提取物的脱砷方法,如海带提取物多不饱和脂肪酸、多酚、海藻酸钠、多糖的砷超标问题尚未解决,砷污染的风险直接影响到这类深加工产品的食品安全性,是制约我国海带种植业及深加工产业发展的瓶颈问题。
6小结与展望
1)由于海洋环境的污染,我国海带主产区海带中总砷含量偏高,无机砷含量已超过国标限量,由此带来的食品安全问题应引起的严重关注;
2)海带砷的存在形态为无机砷及有机砷,根据毒性作用机理,其毒性大小顺序为:
AsH3>As3+>As5+>RAsX>As,故国际以无机砷限量来控制海藻的安全性;
3)国内外食品及药品标准对海藻(含海带)中砷限量的情况为:国外无明文规定对海藻砷的限量;中国国标规定藻类无机砷(干重)≤1.5 mg/kg,对总砷无限定。对于海藻(含海带)提取物而言,目前尚无中国国家标准,我们建议暂时采用国际食品添加剂对特定海带提取物的标准,即无机砷≤3 mg/kg为限量,以此补充海带提取物中砷限量的空缺。由于有机砷与无机砷之间相互转化的机制尚不明了,在检测无机砷的同时应关注总砷含量;
4)海带中无机砷及总砷含量的检测方法及操作特点:根据国标,适合海带中无机砷的检测方法包括氢化物原子荧光光度法及银盐法。我们建议在测无机砷的预处理环节,即浸提海带中无机砷的操作中,关注浸提温度及盐酸浓度,防止有机砷转化为无机砷;适合海带总砷的检测方法包括氢化物原子荧光光度法、银盐法、砷斑法、硼氢化物还原比色法,我们建议在样品预处理中,关注消化过程是否进行完全,以保证总砷溶出,从而保证结果的可靠性。
5)现行海带脱砷技术主要针对其原植物进行脱砷,其效果良好,但损失了海带的风味及其中不稳定或水溶性的有效成分;我们提出对海带提取物进行脱砷,这将有针对性地保护海带中的营养、风味及有效成分,有利于大规模加工海带,获取高付加值的深加工产品。
总之,我们认为:直接食用海带时无机砷的含量尚在安全可控范围,未来海带的脱砷技术的重点是基于提取过程中有选择性的脱砷技术的研究,目的是既保证无机砷的含量低于限量标准,又能获得海带中有价值的多种有效成分的提取物。对于海带提取物中无机砷的限量标准,目前可借鉴现有的国际食品添加剂对海带特定提取物中无机砷的标准,以科学检测法控制其中无机砷含量,打造安全的海带提取物产品系列,提升我国对海带综合利用的研究水平。
[1]王利群,董英.海带的营养保健功能及其开发前景[J].包装与食品机械,1999,17(1):28-31
[2]曹玉杰.营养保健话海带[J].中国检验检疫,2006(8):64
[3]International Agency for Research on Cancer(IARC),Monographs,Evaluation of the Carcinogenic[J].Scietific Publication,1980,39
[4]朱博,徐磊,郑全美,等.食用海产品后人体尿砷代谢产物特点的研究[J].环境与健康杂志,2010,27(6):474-476
[5]MIZOI M,TAKABAYASHI F,NAKANO M,et al.The role of trivalentdimethylated arsenic in dimethylarsinic acid-promoted skin and lungtumorigenesis in mice:tumor-promoting action through the inductionofoxidativestress[J].ToxicologyLetters,2005,158(2):87-94
[6]FAO/WHO,1988,Codex Alimentarius,General Standard for Contaminants and Toxins in Food[S]
[7]DAHL L,MOLIN M,AMLUND H,et al.Stability of arsenic compounds in seafood samples during processing and storage by freezing[J].Food Chem,2010,123(3):720-727
[8]戴文津,杨小满,陈华,等.水产品中砷的质量控制研究进展[J].广东农业科学,2010(11):263-275
[9]杨惠芬,梁春穗,董仕林,等.食品中无机砷限量卫生标准的研究[J].中国食品卫生杂志,2003,15(1):27-31
[10]杨钊,范莹,迟少云,等.7种藻类中总砷和无机砷含量的测定[J].中国海洋药物杂志,2007,26(2):43-46
[11]CHAPMANA C.On the presence of compounds of arsenic in marine crustaceans and shellfish[J].Analyst,1926,51:548-563
[12]LUNDE G.Occurrence and transformation of arsenic in the marine environment[J].Envir Hlth Perspect,1977,19:47-52
[13]BOHNA.Arsenic in marine organisms from west Greenland[J].Mar-Pollut Bull,1975,6:87-89
[14]BENSONA A,Summons R E.Arsenic accumulation in great barrierreef invertebrates[J].Science,1981,211:482-483
[15]SHIOMI K,ORII M,YAMANAKA H,et al.Nippon suisan gakkaishi[J].1987,53:103-108
[16]李慧.砷的毒性与生物学功能[J].现代预防医学,2000,27(1):39-40
[17]张文德.海产品中砷的形态分析现状[J].中国食品卫生杂志,2007,19(4):345-350
[18]EDMONDS J S,FRANCESCONI K A,CANNON J R,et al.Isolation,crystal structre and synthesis of arseno betaine,the arsenical constituent of thewestern rock lobster panulirus longipes Cygnusgeorge[J].Tetrahedron Lett,1977,18:1543-1546
[19]FRANCESCONI K A,EDMONDS J S.Arsenic and marine organisms.In:Sykes A G.Advances in Inorganic Chemistry[M].Academic Press,1997:147-189
[20]FRANCESCONI K A,EDMONDS J S.Arsenic compounds in the en-[21]EDMONDS J S,FRANCESCONI KA.Arseno-sugar from brown kelp ecklonia radiate as intermediates in cycling or arsenic in a narine ecosystem[J].Nature,1981,289:602-604
vironment[C].PPFrankenbergerWTJr.Environmental Chemistry of Arsenic.NewYork:Marcel Dekker,2002:51-94
[22]EDMONDS J S,FRANCESCONI K A.Organoarsenic compounds in the marine environment.In:Craig P Ed.Organometallic compounds in theenvironment[M].2ndedition.JohnWileyandSons,2003,195-222
[23]蒋玲.陆爽.吴君.砷对肝脏的毒性及氧化损伤[J].世界华人消化杂志2007,15(21):2334-2336
[24]刘劼,乐晓春.砷与蛋白相互作用研究进展[J].分析科学学报2009,25(4):465-472
[25]常迪,王竹天.食品中砷及砷化合物分析方法研究进展[J].国外医学卫生分册,2006,33(2):121-124
[26]Mohammed B,Amran,Florence Lagarde,et al.Determination of Arsenic Species in Marine Organisms by HPLC-ICP-OES and HPLCHG-QFAAS[J].Mikrochim Acta,1997,127:195-202
[27]WEI Chao,LI Wei-hua,ZHANG Chao,et al.Arsenic speciation in chinese seafood by using hyphenated techniques[J].Environmental Chemistry,2003,2(3):215-222
[28]Irene B Rodriguez,Georg Raber,Walter Goessler.Arsenic speciation in fish sauce samples determined by HPLC coupled to inductively coupled plasma mass spectrometry[J].Food Chemistry,2009,112:1084-1087
[29]甑云鹏,范必威.砷形态分析方法进展[J].广东微量元素科学,2005,12(7):5-11
[30]郭莹莹,翟毓秀,林洪,等.海产品中砷化合物检测方法的研究进展[J].水产科学,2008,27(12):674-679
[31]郭莹莹.海藻中砷化合物检测技术研究及实用安全性评价[D].青岛:中国海洋大学,2008
[32]王凯,高群玉.微波消解-原子荧光光谱法测海产品中的微量砷[J].广州:华南理工大学,2009,25(7):848-851
[33]孙建华.我国水产品采用国际标准及海藻中无机砷限量标准的研究[D].山东:中国海洋大学,2007
[34]中国国家标准化管理委员会.GB2762-2005中国标准书号[S].北京:中国标准出版社,2005
[35]中国食品添加剂生产应用工业协会.《食品添加剂手册》[S].北京:化学工业出版社,2003
[36]蒋瑾华,温巧玲,胡思.动物源性食品中痕量无机砷的测定[J].光谱实验室,2006,23(4):751-754
[37]暨南大学.双壳贝类体内重金属的净化方法[P].中国专利:200510 036014.x,2006-02-22
[38]中国海洋大学.一种脱重金属残留的多糖配合物[P].中国专利:200710084282.8,2007-02-26
[39]姜桥,刘永中,今春文,等.去除海藻中砷的方法研究[J].食品工业科技,2007,28(8):80-81,85
[40]舒本胜.正交试验优化海带中砷的脱除方法[J].食品科学,2012,33(24):11-15
[41]浙江工商大学.羊栖菜脱砷方法[P].中国专利:200710069859. 8,2008-01-30
[42]北京市科威华食品工程技术有限公司.一种羊栖菜脱砷新工艺[P].中国专利:200810055780.4,2008-06-11
[43]郑婵颖.羊栖菜脱砷工艺[P].中国专利:001375962,2005-10-26
Research Status and Prospects for Arsenic in Saccharina japonica Aresch
YANG Qing1,FAN Ya-ming1,*,ZENG Yuan1,GUAN Zhuo-bin1,HE Zhi-zhou1,YANG Yi-ting2,WU Xiao-tong1,CHEN Yi-sha1
(1.Chemistry and Chemical Engineering College,Guangzhou University,Guangzhou 510006,Guangdong,China;2.Infinitus(China)Co.,LTD.,Guangzhou 510623,Guangdong,China)
This review focuses on five aspects issues,namely,the arsenic content in Chinese kelp,the presence form and toxicity of arsenic,as well as the arsenic limit content,the method of detection arsenic,and the technology of removing arsenic in standards at home and abroad.The limit of inorganic arsenic in S.japonica is over the national standards for dried algae(≤1.5 mg/kg).In fact,inorganic arsenic is also accumulated while extracting target substance.Therefore,the limits of inorganic arsenic in the kelp extract should be referred to the international standards for food additives(≤3 mg/kg)due to lack of the standards on inorganic arsenic limit for extract of algae.
Saccharina japonica Aresch;Arsenic;Analysis Arsenic technology;Standard limit;Technology of removing arsenic
10.3969/j.issn.1005-6521.2015.12.033
2014-03-05
广东省部产学研结合项目(2013B090600159);广州市科技计划项目(12A62011558)
杨庆(1987—),男(汉),硕士研究生,研究方向:天然产物化学。
樊亚鸣(1957—),女,教授,本科,研究方向:天然产物化学。
