山竹壳果胶提取及流变学特性
2015-10-28黄文烨郭秀君黄雪松
黄文烨,郭秀君,黄雪松
(暨南大学食品科学与工程系,广东广州510632)
山竹壳果胶提取及流变学特性
黄文烨,郭秀君,黄雪松
(暨南大学食品科学与工程系,广东广州510632)
为从山竹壳中提取果胶,研究了不同提取条件(pH、温度和时间)对果胶提取率的影响,并对比了山竹壳果胶(MRP)与商品苹果果胶(AP)的静态、动态流变学特性。低pH、高温能有效的提高提取率;提取时间在1.5~2h左右,果胶提取率较高;提取率范围为4.48%~8.49%。山竹壳果胶酯化度(DM)为75.97%±3.49%,糖醛酸含量为(626.52± 24.15)mg/g。山竹壳果胶溶液属典型的假塑性流体,其凝胶弹性形变范围及凝胶强度弱于与其酯化度、糖醛酸含量相近的苹果果胶。
果胶,山竹,果皮,提取,流变学
山竹(Garcinia mangostana L.)属藤黄科藤黄属,味道鲜美、营养丰富,有“热带果后”的美称。其中,白色、可食的果肉部分仅占整果的30%~40%,即约有60%以上的红褐色山竹壳被废弃。山竹壳中含丰富的氧杂蒽酮类化合物、原花青素和山竹红色素等功能活性物质,泰国民间常用山竹壳治疗腹泻、痢疾、伤口和皮肤感染等[1]。
果胶由17种不同单糖通过20种不同的键连接[2]而成,是富含D-半乳糖醛酸残基(约70%)的结构性多糖。根据果胶与甲基结合的多少,即酯化度(DM)的高低,果胶又可分为高酯果胶(DM≥50%)和低酯果胶(DM<50%);高酯果胶在pH2.0~3.8、可溶性固形物(如蔗糖)含量达55%~75%时,能形成非可逆性果胶,且胶凝能力随DM值增加而增大;低酯果胶与Ca2+、Mg2+等二价金属离子交联才能形成凝胶。食品和化妆工业中,果胶常用作胶凝剂、稳定剂或增稠剂。此外,果胶还有减少低密度脂蛋白-胆固醇的吸收、降低血糖、抗癌和增强免疫等多种保健功能[3-5]。因此,越来越多的果胶新资源被开发应用于食品、保健食品、药品或化工等行业中[6]。
Gan C等[7]采用响应面法研究了山竹壳中抗氧化性果胶多糖的最佳提取条件。在pH=2.45,3.93h,80.0℃或pH=2.00,3.67h,67.7℃的条件下,果胶的最高提取率可达12.0%~12.4%,但其糖醛酸含量仅为20.2~21.1mg/g,说明该山竹壳果胶纯度较低;Mai D S等[8]采用热酸法(H2SO4)研究了不同料液比、温度、时间、pH对越南山竹壳果胶提取的影响,果胶最高提取率是7.0291%,1%果胶粘度(30℃)为2.4324Ns/m2。另外,Fujihara M等[9]用热水提取得到具有抗肿瘤活性的山竹壳果胶。国内外对山竹壳果胶的研究相对来说还是比较少[7-10],本文采用热酸法(HCl)研究不同提取条件对山竹壳果胶提取率的影响及其溶液、凝胶的流变学特性,意在完善山竹壳果胶的基本特性,并为该新果胶资源的深入研究、开发应用等做初步探索。
1 材料与方法
1.1材料与仪器
山竹购自暨南大学小西门水果商店,山竹平均重145.29g,山竹壳重量占68.04%;苹果快凝高酯果胶烟台安德利果胶有些公司馈赠;食用酒精广州东巨公司,96%;半乳糖醛酸广州市齐云生物科技有限公司,>99%;酸性异丙醇溶液浓盐酸:60%异丙醇=1∶20;四硼酸钠-浓硫酸溶液0.0125mol/L;间羟基联苯-氢氧化钠溶液0.15%间羟基联苯溶于0.5%氢氧化钠溶液。
RE-52 AAB旋转蒸发仪上海嘉鹏科技有限公司;PHS-3C精密pH计上海安亭雷磁仪器厂;KDC-1044低速离心机科大创新股份有限公司中佳分公司;UV-9600紫外/可见分光光度计北京瑞利分析仪器公司;Kinexus Pro旋转流变仪英国马尔文公司。
1.2实验方法
1.2.1山竹壳果胶的提取新鲜山竹取果皮,加水打浆、冻干磨粉后,过20目筛,得到山竹壳干粉,放于4℃冰箱储存备用。取5g山竹壳粉,以1∶25(w/v)的比例加入一定pH的水溶液(以HCl/NaOH调酸碱),在一定温度下提取一定时间。提取结束后过滤,取滤液并调pH至4.0;滤液经50℃旋蒸浓缩后,加入4倍体积的酒精,3500r/min离心20min,以沉淀果胶,同时去除单糖、色素等小分子杂质;沉淀以50℃旋蒸去酒精后冻干,即可得山竹壳果胶。果胶提取率的计算方法如下:

1.2.2提取条件对果胶提取率的影响选取pH=1、2、3、4、5、6(80℃,1.5h),温度为50、60、70、80、90、100℃(pH=2,1.5h),时间为0.5、1.0、1.5、2.0、2.5、3h(pH=2,80℃)的提取条件,按1.2.1的方法从山竹壳中提取果胶,并计算提取率。
1.2.3果胶酯化度的测定采用滴定法测定酯化度,参照美国食品化学药典(FCC)[11]并稍作改动[6]。称取0.5g果胶与15mL酸性异丙醇混合搅拌10min,砂芯漏斗过滤后,用60%异丙醇冲洗至无氯离子,滤饼在110℃烘箱干燥。称100mg处理后的果胶到锥形瓶中,2mL乙醇湿润后,加入20mL蒸馏水,40℃下溶解。加3滴酚酞,用标定好的0.1mol/L NaOH溶液滴定,记录消耗NaOH溶液的体积为V1。之后加入10mL 0.1mol/L NaOH溶液振摇2h,以10mL 0.1mol/L HCl溶液中和。再滴入3滴酚酞,用0.1mol/L NaOH溶液滴定至粉红色,此时消耗NaOH溶液体积记为V2。依照此方法测定山竹壳果胶的酯化度,并以苹果果胶作为对比。酯化度(DM)计算方法如下:

1.2.4糖醛酸的测定采用间羟基联苯法[12]测定果胶中糖醛酸含量。取0.6mL 50~180μg/mL的半乳糖醛酸标准溶液,冰浴下加入4.5mL四硼酸钠-浓硫酸溶液。沸水浴反应5min后,立即冰浴冷却。加入60μL间羟基联苯-氢氧化钠溶液,摇匀,5min内520nm测吸光度,作标准曲线。按同样的方法测定山竹壳果胶糖醛酸含量,以苹果果胶作为对比;糖醛酸含量以半乳糖醛酸计。
1.2.5流变性质分析
1.2.5.1果胶溶液的静态流变性质测定将山竹壳果胶干粉和苹果果胶粉末分别配成质量分数为1.5%的水溶液,25℃下旋转流变仪剪切速度由0.01s-1增加到500s-1(夹缝距离0.07mm,平板直径20mm),记录两种果胶溶液的流动曲线。
1.2.5.2果胶凝胶的动态粘弹性测定果胶凝胶的制备:取0.2g果胶粉末与14g蔗糖,加蒸馏水溶解,然后以12.5%柠檬酸溶液将pH调至3,加水定容至20mL,并移至4℃冰箱放置24h,即得到果胶凝胶[13]。
动态粘弹性测定:应用旋转流变仪(夹缝距离2mm,平板直径20mm)进行测定,仪器参数如下:振幅扫描:频率1Hz,温度25℃,应变:0.1%~100%;频率扫描:0.01~10Hz,温度25℃,应变1%。
2 结果与分析
2.1山竹壳果胶的提取
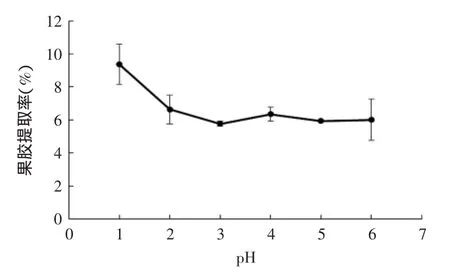
图1 pH对山竹壳果胶提取率的影响Fig.1 Effect of pH values on MRP extraction yield
图1~图3所示分别为提取pH=1~6(80℃,1.5h),温度在50~100℃(pH=2,1.5h),时间为0.5~3h(pH=2,80℃)时,山竹壳果胶提取率的变化曲线。
图1可以看出,果胶提取率在pH=1~3呈下降趋势,在pH=3~6时变化不大。降低pH能有效的增加提取率,这是因为高H+浓度可以加快原果胶水解成果胶。但pH太低,果胶易发生降解;中、碱性条件下,果胶也容易发生去酯化及因β-消除造成的Gal A链断裂[14]。所以,在pH=2附近提取果胶比较合适。
图2中果胶提取率在50~100℃范围内随温度升高而上升,由此可知,高温能加速果胶提取,但同时高温也能促进高酯果胶的去酯化。
图3可以看出,提取时间在1.5~2h左右提取率较高;在其之前或之后,果胶提取不完全或者开始降解。
总体上,山竹壳果胶提取率范围为4.48%~8.49%,不同条件下果胶提取率变化趋势与Mai D S等[8]的实验结果相符。为减少果胶降解、去酯化,采用pH=2、80℃、1.5h条件下提取,并再次醇沉(尽量减少单糖、色素等小分子杂质)得山竹壳果胶,进行1.2.3,1.2.4,1.2.5的实验测定。
2.2果胶酯化度及糖醛酸含量
2.2.1半乳糖醛酸标准曲线间羟基联苯法测得的半乳糖醛酸标准曲线回归方程为y=0.0045x+0.0049(R2=0.9930)。
2.2.2果胶酯化度及糖醛酸含量山竹壳果胶、苹果果胶的酯化度及糖醛酸含量如表1所示。山竹壳果胶糖醛酸含量略高于苹果果胶,且山竹壳果胶和苹果果胶皆属高酯果胶(DM>50%)。山竹壳果胶的酯化度与Madhav A等[10](64.66%)和Mai D S等[8](70.429%)的结果相近。

图2 提取温度对山竹壳果胶提取率的影响Fig.2 Effect of temperature on MRP extraction yield
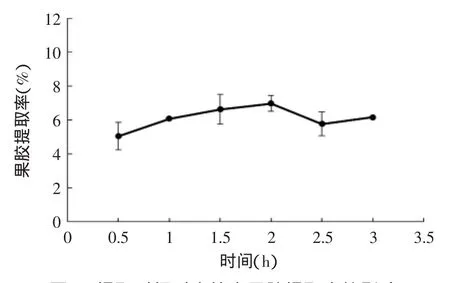
图3 提取时间对山竹壳果胶提取率的影响Fig.3 Effect of time on MRP extraction yield

表1 山竹壳果胶和苹果果胶的酯化度及糖醛酸含量(n=3)Table 1 DM and uronic acid content of MRP and AP(n=3)
2.3果胶流变性质分析
两种果胶粘度与剪切速度的关系见图4。山竹壳果胶和苹果果胶粘度随剪切速度的增大而下降,山竹壳果胶显示出明显的假塑性流体特征。低剪切速度下,山竹壳果胶的粘度大于苹果果胶;但在0.1~1s-1,山竹壳果胶粘度突然减小,之后其减小幅度也远大于苹果果胶。这可能是由于果胶分子链间物理交联点被破坏的速度大于重建速度,使粘度下降[15];而两种果胶不同的分子链长度和结构组成造成了两流动曲线间的差异[13]。图4显示山竹壳果胶拥有更好的剪切变稀特性,可以作为一种潜在的食品增稠剂。
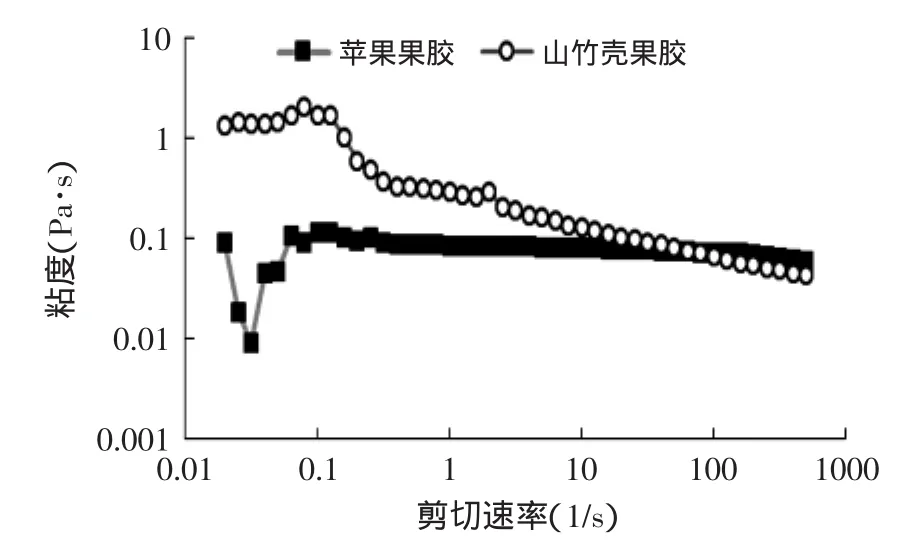
图4 山竹壳果胶和苹果果胶溶液的剪切流动曲线Fig.4 Shear flow curves of MRP and AP
图5体现了两种果胶凝胶的贮存模量/弹性模量(Storage modulus,G’)和损耗模量/粘性模量(Loss modulus,G”)随应变变化的关系。苹果果胶凝胶的G’和G”均高于山竹壳果胶凝胶,而且前者两模量交点值大于后者的值,说明山竹壳果胶凝胶的弹性形变范围要比苹果果胶凝胶小。由图5可知应变1%在线性粘弹范围内,因此选1%应变作果胶凝胶的频率扫描。

图5 山竹壳果胶凝胶和苹果果胶凝胶振幅扫描曲线Fig.5 Amplitude sweep curves of MRP gel and AP gel

图6 山竹壳果胶凝胶和苹果果胶凝胶的频率扫描曲线Fig.6 Frequency sweep curves of MRP gel and AP gel
图6可以看出苹果果胶凝胶的G’和G”皆高于山竹壳果胶凝胶,而且苹果果胶凝胶的两模量间差值要大于山竹壳果胶凝胶,这说明山竹壳果胶的凝胶内网络结构连接比苹果果胶要弱,更易发生形变[16]。提取所得的山竹壳果胶与苹果果胶在酯化度、糖醛酸含量两项性质上相近,而且在形成凝胶时速度更快,但其凝胶强度不及苹果果胶。这既有可能是山竹壳果胶本身分子量、单糖组成及结构等内部因素的原因,也有可能是因提取导致果胶降解、分子量降低,或是凝胶条件不适合等的外部因素造成的。
3 结论
山竹壳果胶在低pH、高温及1.5~2h时提取率较高,提取率范围为4.48%~8.49%;果胶的酯化度和糖醛酸含量分别为75.97%±3.49%,(626.52±24.15)mg/g。流变学特性显示,山竹壳果胶属假塑性流体,可作为食品增稠剂开发,其凝胶强度弱于苹果果胶。为深入了解山竹壳果胶,还需对山竹壳果胶的结构特性(分子量、单糖组成和连接方式等)、理化性质(如优化凝胶形成的条件)和生物学特性等做进一步研究。
[1]黄雪松,黄文烨.对-二甲基氨基肉桂醛法测定山竹原花青素[J].现代食品科技,2013(7):1687-1690.
[2]Voragen A G J,Coenen G J,Verhoef R P,et al.Pectin,a versatile polysaccharide present in plant cell walls[J].Structural Chemistry,2009,20(2):263-275.
[3]Mohnen D.Pectin structure and biosynthesis[J].Current Opinion in Plant Biology,2008,11(3):266-277.
[4]Caffall K H,Mohnen D.The structure,function,and biosynthesis ofplantcellwallpecticpolysaccharides[J].CarbohydrateResearch,2009,344(14):1879-1900.
[5]孙元琳,汤坚.果胶类多糖的研究进展[J].食品与机械,2005(6):60-63.
[6]Lira-Ortiz A L,Reséndiz-Vega F,Ríos-Leal E,et al.Pectins from waste of prickly pear fruits(Opuntia albicarpa Scheinvar‘Reyna’):ChemicalandRheologicalProperties[J].Food Hydrocolloids,2014,37:93-99.
[7]Gan C,Latiff A A.Extraction of antioxidant pecticpolysaccharide from mangosteen(Garcinia mangostana)rind:Optimization using response surface methodology[J].Carbohydrate Polymers,2011,83(2):600-607.
[8]Mai D S,Ngo T X.Survey the pectin extraction from the dried rind of mangosteen(Garcinia mangostana)in Vietnam[C]. Proceedings of First AFSSA Conference,2012:64-67.
[9]Fujihara M,Kurata Y,Kosaka Y,et al.Antitumor polysaccharidesfromthepericarbofmangosteengarcinia mangostana[J].Bull Chiang Mai Associated Medical Sciences,1997,30(1):1B97.
[10]Madhav A,Pushpalatha P B.Characterization of pectin extracted from different fruit wastes[J].Journal of Tropical Agriculture,2002,40:53-55.
[11]FCC.Food Chemical Codex[M].Washington DC:National Academy of Sciences,1981.
[12]Blumenkrantz N,Asboe-Hansen G.New method for quantitativedeterminationofuronicacids[J].Analytical Biochemistry,1973,54(2):484-489.
[13]Wang X,Lü X.Characterization of pectic polysaccharides extracted from apple pomace by hot-compressed water[J]. Carbohydrate Polymers,2014,102:174-184.
[14]Renard C M G C,Thilbault J.Degradation of pectins in alkaline conditions:kinetics of demethylation[J].Carbohydrate Research,1996,286(5):139-150.
[15]史铁钧,吴德峰.高分子流变学基础[M].北京:化学工业出版社,2009.
[16]郭秀君.果胶钙及果胶的生产工艺研究[D].广州:暨南大学,2014.
Effect of different extraction conditions on pectin from mangosteen rind and its rheological properties
HUANG Wen-ye,GUO Xiu-jun,HUANG Xue-song
(Department of Food Science and Engineering,Ji’nan University,Guangzhou 510632,China)
Hot-acid method was used to extract pectin from mangosteen rind in different pH,temperature and time conditions.Basic chemical and rheological properties of mangosteen rind pectin(MRP)were also determined and compared with apple pectin(AP).The yield of MRP increased significantly with decreasing pH and rising temperature,and the recommended extraction time was about 1.5~2h.The extraction yield ranged from 4.48%to 8.49%,degree of methylation(DM)and uronic acid content of MRP were 75.97%±3.49%and(626.52±24.15)mg/g,respectively.MPR solution was a kind of typical pseudo plastic fluid,while the gel strength of MPR was lower than that of AP.
pectin;Garcinia mangostana L.;rind;extraction;rheology
TS209
B
1002-0306(2015)10-0237-04
10.13386/j.issn1002-0306.2015.10.041
2014-08-01
黄文烨(1992-),女,硕士研究生,研究方向:功能食品。
黄雪松(1957-),男,博士,教授,研究方向:功能食品与食品安全。
“十二五”国家科技支撑计划项目(2012BAD031B03)。
